夏枯草通过HMGB1诱导人胃癌细胞增殖、凋亡、迁移、侵袭的影响及其作用机制
2019-12-13段莎王宗艳
段莎,王宗艳
胃癌是一种常见的恶性肿瘤,在2018年有超过100万例新增病例,死亡约78.3万人(相当于全球每12例死亡中有1例),已成为严重威胁人类健康的第五大癌症,和由癌症引起死亡的第三大原因[1]。预测到2020年,我国胃癌发病率将达到24.30/10万左右,新增病例将达到34.6万左右,其中男性约占23.7万,女性约占10.9万[2]。目前,手术、化疗、放疗等是临床治疗胃癌的主要措施。但由于胃癌细胞的高侵袭性和迁移性,化疗药物的毒副作用,以及患者可能产生的耐药性,导致临床治疗效果欠佳,患者预后不良[3-5]。因此,寻找更加安全有效的治疗方法具有极其重要的现实意义。夏枯草(PrunellavulgarisL.)是唇形科夏枯草属多年生草本植物,以干燥果穗入药,具清肝泻火,明目,散结消肿之功,用于目赤肿痛,目珠夜痛,头痛眩晕,瘰疬,瘿瘤,乳痈,乳癖,乳房胀痛[6]。研究发现,夏枯草注射液可以改善中晚期胃癌患者临床症状[7],抑制人胃腺癌细胞SGC-7901增殖,并促进其凋亡[8]。但夏枯草对胃癌细胞增殖、迁移等生物行为的影响及其机制尚未阐明。因此,本研究以胃癌细胞BGC-823为研究对象,评价夏枯草在胃癌细胞增殖、侵袭、迁移和凋亡中的作用,同时观察高迁移率族蛋白B1(High mobility group protein B1, HMGB1)对其治疗作用的影响,旨在阐明相关的分子机制。
1 材料与方法
1.1 夏枯草提取物的制备
夏枯草提取物的制备参照杜宏道等[9]的方法,即用水煮方式提取夏枯草药材,药液过滤后用旋转蒸发仪浓缩,配置成生药质量浓度为1 g/mL夏枯草提取物。之后经灭菌和微孔滤膜过滤,冷藏保存。使用时,用DMEM培养液分别稀释成30 mg/mL、60 mg/mL、90 mg/mL浓度备用。
1.2 实验主要试剂和仪器
胃癌细胞BGC-823购自美国ATCC细胞库;DMEM培养基、胎牛血清购自美国Gibco公司;胰酶、RIPA裂解液购自北京索莱宝公司;Lipofectamine 2000购自美国赛默飞世尔有限公司;噻唑蓝(Methyl thiazolyl tetrazolium,MTT)购自美国Sigma-Aldrich公司;pcDNA3.1-HMGB1载体购自广州锐博生物有限公司;细胞周期蛋白D1(CyclinD1)、P21、甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-phosphate dehydrogenase, GAPDH)、B细胞淋巴瘤/白血病-2(B cell lymphoma/lewkmia-2, Bcl-2)、Bcl-2相关X蛋白(Bcl-2 Associated X Protein, Bax)、基质金属蛋白酶-2(Matrix metalloproteinase 2,MMP-2)、E-钙黏蛋白(E-cadherin)、HMGB1蛋白抗体购自美国Cellular Signaling Technology公司;辣根过氧化物酶标记二抗购自北京中杉金桥生物技术公司;Annexin V-FITC细胞凋亡检测试剂盒(Annexin V-FITC Apoptosis Detection Kit)购自上海碧云天生物技术研究所;Transwell小室购自美国Corning公司;Matrigel基质胶购自美国BD公司。细胞培养箱购自美国Thermo公司,酶标仪购自美国Bio-Rad公司,BD FACSCalibur流式细胞仪购自美国BD公司。
1.3 细胞培养
BGC-823细胞培养于含10%胎牛血清的DMEM培养基,置于37 ℃、5% CO2的培养箱中培养。观察细胞生长状态,待细胞密度达80%,加入胰酶消化,进行传代培养。
1.4 细胞转染
选取处于生长对数期的BGC-823细胞,调整细胞密度为1×105个/mL,加入6孔板。根据Lipofectamine 2000试剂说明书的指示,将pcDNA3.1-HMGB1及相应的阴性对照转染入BGC-823细胞,并用60 mg/mL夏枯草进行处理。培养48 h后,收集细胞用于后续实验。
1.5 噻唑蓝(MTT)比色法检测细胞增殖
收集生长对数期的BGC-823细胞,将细胞以5×103个/孔的密度接种于96孔细胞板,细胞贴壁后,分别加入不同浓度(30 mg/mL、60 mg/mL、90 mg/mL)的夏枯草药物,同时以不加夏枯草药物的BGC-823细胞为对照,每组设置6个复孔,在37 ℃、5% CO2的培养箱中分别连续培养24 h、48 h、72 h,弃去原有的培养基,每孔加入20 μL MTT溶液(5 mg/mL),37 ℃孵育4 h。弃去MTT溶液,加入150 μL DMSO,37 ℃摇床震荡孵育10 min,在酶标仪上测定BGC-823细胞在波长490 nm处吸光值,计算细胞增殖率抑制率,细胞增殖率抑制率(%)=(1-实验组平均吸光值/对照组平均吸光值)×100%。
1.6 流式细胞仪分析细胞凋亡
在对数生长期的BGC-823细胞中加入60 mg/mL夏枯草药物,同时以不加药物的BGC-823细胞为对照。收集转染后的BGC-823细胞,以转染pcDNA3.1的细胞为对照。调整各组细胞密度为1×106个/mL,根据细胞凋亡试剂盒的说明,使用195 μL Annexin V-FITC结合液重悬细胞,加入5 μL Annexin V-FITC,10 μL PI,轻轻混匀,于室温避光孵育20 min,上流式细胞仪评估细胞凋亡率。
1.7 Transwell小室法检测细胞侵袭和迁移
(1)侵袭实验:收集各组细胞,胰酶消化后制成为5×105个/mL的细胞悬液,吸取100 μL接种于预先用Matrigel胶包被的上室。下室加入含10%胎牛血清的DMEM培养基。置于37 ℃,5% CO2培养箱中培养48 h,用无菌棉签擦去未穿膜细胞和Matrigel胶,甲醛固定15 min,结晶紫染色20 min,在显微镜下观察,随机选取10个视野,记录侵袭细胞数目。
(2)迁移实验:Transwell上室不铺Matrigel胶,其余步骤同侵袭实验。
1.8 蛋白质印迹法(Western blot)
为检测目的蛋白表达,在各组BGC-823细胞中加入RIPA裂解液,提取总蛋白,后经10%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis, SDS-PAGE),将蛋白转移到聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜,用5%脱脂奶粉于常温下封闭1 h,加入一抗,在4℃孵育过夜,随后用Tris-HCl-Tween缓冲盐溶液(Tris buffered saline with Tween, TBST)洗膜10 min,漂洗3次,加入二抗,室温下孵育1 h,TBST洗膜10 min,漂洗3次,加入化学发光液进行显色、显影,以β-actin作为内参蛋白,分析蛋白相对表达量。
1.9 统计学方法

2 结果
2.1 夏枯草对胃癌细胞BGC-823增殖、凋亡的影响
MTT法检测夏枯草对胃癌细胞BGC-823增殖的影响(表1),与对照组相比,不同浓度夏枯草分别处理BGC-823细胞24 h、48 h、72 h后,细胞增殖抑制率随时间增长、剂量增加呈升高趋势,差异均具有统计学意义(P<0.05)。与夏枯草30 mg/mL组相比,夏枯草60 mg/mL组和90 mg/mL组细胞增殖抑制率在24 h、48 h、72 h逐渐上升,差异均具有统计学意义(P<0.05)。与夏枯草60 mg/mL组相比,夏枯草90 mg/mL组细胞增殖抑制率在24 h、48 h、72 h明显提高,差异均具有统计学意义(P<0.05)。48 h时,夏枯草60 mg/mL组的BGC-823细胞增殖抑制率约为50%,因此选择60 mg/mL夏枯草浓度用作后续实验。
不同浓度夏枯草作用于胃癌细胞BGC-823后,与对照组相比,Cyclin D1蛋白表达明显下降,P21蛋白表达显著升高,差异均具有统计学意义(P<0.05)。与夏枯草30 mg/mL组相比,夏枯草60 mg/mL组和90 mg/mL组BGC-823细胞中Cyclin D1蛋白表达量显著减少,P21蛋白表达量明显增加,差异具有统计学意义(P<0.05)。与夏枯草60 mg/mL组相比,夏枯草90 mg/mL组BGC-823细胞中Cyclin D1蛋白表达水平显著降低,P21蛋白表达明显上升,差异具有统计学意义(P<0.05),见图1A、表1。

图1夏枯草对胃癌细胞BGC-823增殖、凋亡蛋白表达的影响 A:夏枯草对胃癌细胞BGC-823增殖蛋白表达的影响;B:夏枯草对胃癌细胞BGC-823凋亡的影响;C:夏枯草对胃癌细胞BGC-823凋亡蛋白表达的影响

表1夏枯草对胃癌细胞BGC-823增殖及其相关蛋白表达的影响
注:与对照组比较,aP<0.05;与夏枯草30 mg/mL组比较,bP<0.05;与夏枯草60 mg/mL组比较,cP<0.05
与对照组比较,夏枯草60 mg/mL组明显提高细胞凋亡率和Bax蛋白表达量,显著减少Bcl-2蛋白表达量,差异具有统计学意义(P<0.05),见图1B、表2。

表2夏枯草对胃癌细胞BGC-823凋亡及其相关蛋白表达的影响
2.2 夏枯草对胃癌细胞BGC-823迁移、侵袭的影响
Transwell小室法对胃癌细胞BGC-823迁移、侵袭的检测结果显示,夏枯草60 mg/mL组迁移细胞数和侵袭细胞数较对照组大幅减少,差异具有统计学意义(P<0.05)。Western blot检测BGC-823细胞中E-cadherin和MMP-2蛋白表达情况(图2和表3),发现相比于对照组,夏枯草60 mg/mL组E-cadherin蛋白表达量增加,MMP-2蛋白表达量降低,差异具有统计学意义(P<0.05)。
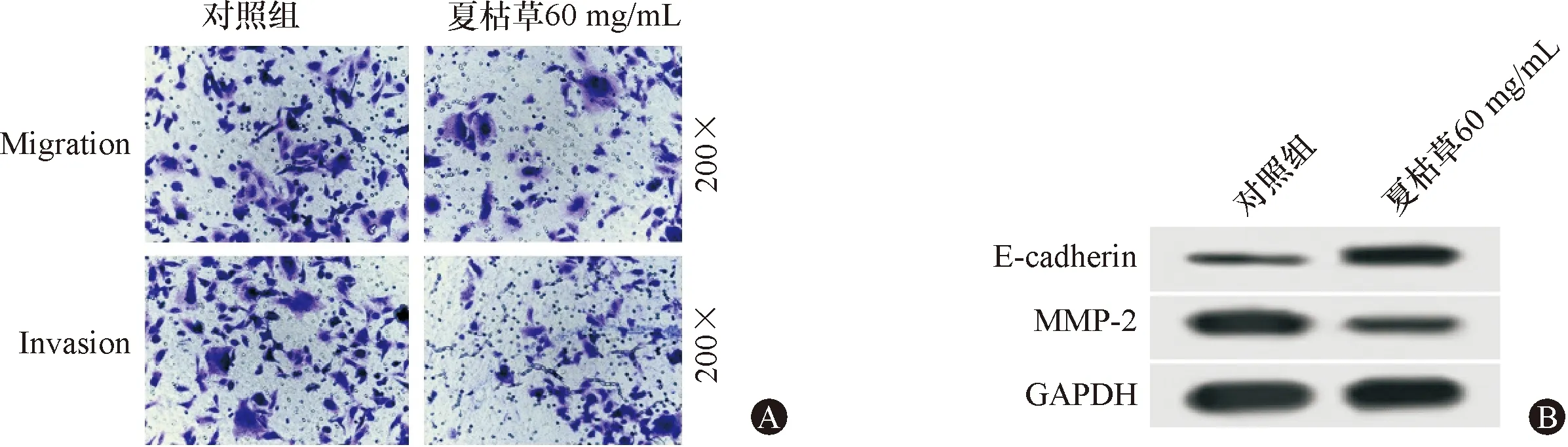
图2夏枯草对胃癌细胞BGC-823迁移、侵袭蛋白表达的影响 A:夏枯草对胃癌细胞BGC-823迁移、侵袭的影响;B:夏枯草对胃癌细胞BGC-823迁移、侵袭蛋白表达的影响

表3夏枯草对胃癌细胞BGC-823迁移、侵袭的影响
注:与对照组比较,aP<0.05
2.3 夏枯草对胃癌细胞BGC-823中HMGB1表达的影响
Western blot检测结果(图3)显示,夏枯草60 mg/mL组BGC-823细胞中HMGB1蛋白表达水平为0.37±0.03,低于对照组的0.82±0.08,差异具有统计学意义(t=12.901,P<0.001)。

图3Western blot检测HMGB1蛋白表达
2.4 过表达HMGB1能逆转夏枯草对胃癌细胞BGC-823增殖、凋亡的作用
在BGC-823细胞中转染pcDNA3.1-HMGB1载体,并加入夏枯草60 mg/mL进行处理,发现HMGB1蛋白表达量显著高于夏枯草60 mg/mL+pcDNA3.1组,差异具有统计学意义(P<0.05),见表6,表明转染成功。MTT法检测结果表明,与夏枯草60 mg/mL+pcDNA3.1组相比,过表达HMGB1明显降低60 mg/mL夏枯草处理BGC-823细胞后24 h、48 h和72 h时的细胞增殖抑制率,差异具有统计学意义(P<0.05),见表5。此外,过表达HMGB1还减少了BGC-823细胞凋亡率和P21、Bax蛋白表达量,促进P21、Bax蛋白表达,差异具有统计学意义(P<0.05),见图4、表4、表5。
2.5 过表达HMGB1能逆转夏枯草对胃癌细胞BGC-823迁移、侵袭的作用
与夏枯草60 mg/mL+pcDNA3.1组比较,过表达HMGB1显著增加夏枯草处理BGC-823细胞后的迁移细胞数和侵袭细胞数,减少E-cadherin蛋白表达量,提升MMP-2蛋白表达水平,差异具有统计学意义(P<0.05),见图5、表6。
3 讨论
夏枯草始载于《神农本草经》,作为我国传统中药,距今已有2000多年的药用历史。“此草夏至后即枯”,故名曰夏枯草[10]。夏枯草的活性成分主要有迷迭香酸和咖啡酸等酚酸类成分,芦丁、芸香苷和金丝桃苷等黄酮类成分,熊果酸和齐墩果酸等三萜类成分,以及多糖类成分[11-12]。药理研究表明,夏枯草具有抗肿瘤作用,广泛应用于甲状腺癌、乳腺癌、淋巴癌等的治疗[13-14]。本实验对夏枯草对胃癌中的作用进行研究,发现夏枯草可以抑制胃癌细胞增殖、迁移和侵袭,并促进其凋亡,作用机制可能与调控HMGB1基因有关。
熊燚等[15-16]的报道指出,夏枯草分别作用于人甲状腺髓样癌TT细胞、人甲状腺乳头状癌K1细胞24 h后,显著减少细胞凋亡率。Yin等[17]的实验显示,夏枯草促进人甲状腺滤泡癌细胞系(FTC-133)凋亡与Bcl-2,Bax和含半胱氨酸的天冬氨酸蛋白水解酶3(Cysteinyl aspartate specific proteinase 3, Caspase-3)信号通路有关。Zhu等[18]的研究表明,夏枯草可能通过激活促凋亡蛋白Caspase-3,诱导细胞凋亡通路,来抑制肺癌细胞A549生长。夏枯草乙醇提取物具有显著的抗肺癌A549细胞、人乳腺癌细胞MDA-MB-231迁移的活性[19-20]。本研究中,不同浓度夏枯草处理BGC-823细胞后,显著提高细胞增殖抑制率和P21蛋白表达水平,抑制Cyclin D1蛋白表达,差异均具有统计学意义(P<0.05)。而60 mg/mL夏枯草明显提高细胞凋亡率和Bax、E-cadherin蛋白表达量,显著减少迁移细胞数、侵袭细胞数和Bcl-2、MMP-2蛋白表达,差异具有统计学意义(P<0.05)。说明夏枯草具有一定的抗胃癌作用,可以抑制胃癌细胞增殖和迁移,并促进胃癌细胞凋亡,这与前述报道相符。另外,夏枯草还显示出了一定的抗侵袭能力。
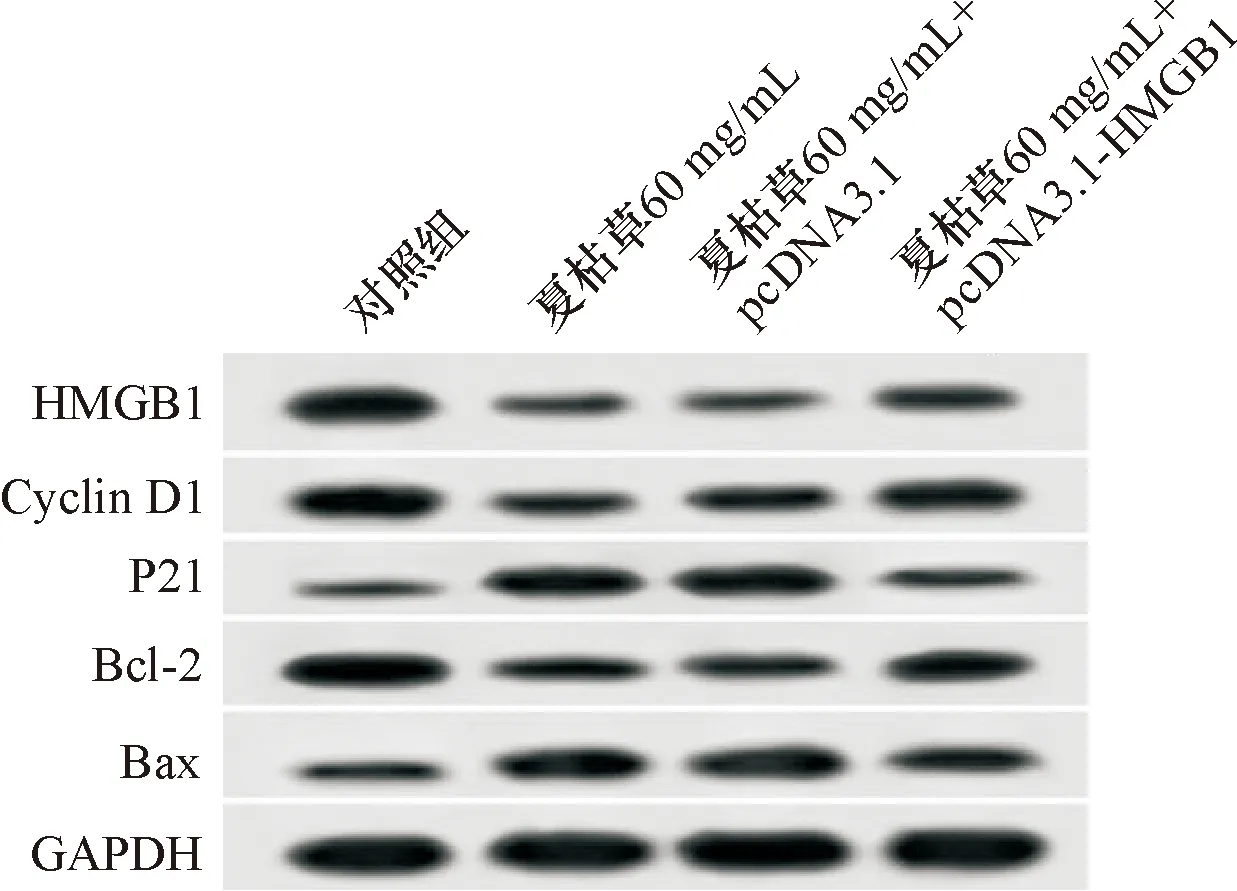
图4过表达HMGB1能逆转夏枯草对胃癌细胞BGC-823增殖、凋亡蛋白的表达

表4过表达HMGB1能逆转夏枯草对胃癌细胞BGC-823增殖的抑制作用
注:与对照组比较,aP<0.05;与夏枯草60 mg/mL+pcDNA3.1组比较,bP<0.05

表5过表达HMGB1能逆转夏枯草对胃癌细胞BGC-823凋亡的促进作用
注:与对照组比较,aP<0.05;与夏枯草60 mg/mL+pcDNA3.1组比较,bP<0.05

图5过表达HMGB1能逆转夏枯草对胃癌细胞BGC-823迁移、侵袭蛋白表达的影响

表6过表达HMGB1能逆转夏枯草对胃癌细胞BGC-823迁移、侵袭的抑制作用
注:与对照组比较,aP<0.05;与夏枯草60 mg/mL+pcDNA3.1组比较,bP<0.05
本实验中,60 mg/mL夏枯草处理胃癌细胞BGC-823后,HMGB1蛋白表达水平降低,推测调控HMGB1表达可能是夏枯草抗胃癌作用的重要机制。HMGB1属于高迁移率族蛋白(High mobility group protein, HMG)家族,是一种高度保守的核蛋白[21]。在细胞核中,HMGB1维持核内平衡,促进基因转录,几乎在所有真核细胞中都有表达[22]。资料显示,HMGB1在肺癌细胞[23]、胰腺癌[24]、宫颈癌[25]、前列腺癌[26]等癌症进程中发挥着关键作用。miR-505通过调控HMGB1抑制骨肉瘤细胞的增殖、迁移和侵袭[27]。沉默HMGB1表达抑制膀胱癌细胞增殖,而促进细胞凋亡[28]。为了进一步探索夏枯草对胃癌细胞的影响是否通过HMGB1介导,用夏枯草60 mg/mL处理转染pcDNA3.1-HMGB1载体的BGC-823细胞,结果发现,与夏枯草60 mg/mL+pcDNA3.1组相比,过表达HMGB1逆转了夏枯草对胃癌细胞增殖、侵袭、迁移和Cyclin D1、HMGB1、Bcl-2、MMP-2蛋白表达的抑制作用,以及逆转了夏枯草对胃癌细胞凋亡和P21蛋白、Bax蛋白、E-cadherin蛋白表达的促进作用。由此可见夏枯草通过调控HMGB1表达来抑制胃癌细胞增殖、侵袭和迁移,并诱导细胞凋亡。
综上所述,夏枯草能够抑制胃癌细胞的增殖、侵袭和迁移,并诱导细胞凋亡,其作用机制与调控HMGB1表达有关,这将为夏枯草在胃癌中的应用提供实验依据和参考。
