甘薯愈伤组织的形成及其影响因素研究进展
2019-12-11吕晓龙孙洁王希卓王彩霞周新群陈琳
吕晓龙 孙洁 王希卓 王彩霞 周新群 陈琳
摘要:愈伤组织处理是保证甘薯(Ipomoea batatas L.)有效安全贮藏的贮前预处理措施,不仅有助于甘薯愈伤组织周皮的形成,防止病害侵染,还能有效减少甘薯贮藏水分流失,甘薯热愈伤组织技术及装备的研究推广对中国甘薯产业发展具有重要意义。对甘薯愈伤组织的形成过程和作用、愈伤组织的合成途径及其影响因素等方面的研究进展进行了综述。重点概述了苯丙烷代谢途径、防御酶和次生代谢产物在甘薯愈伤中的作用,分析了影响甘薯愈伤组织形成的因素,为筛选甘薯愈伤组织条件、研发甘薯愈伤组织技术和装备提供理论依据。
关键词:甘薯(Ipomoea batatas L.);愈伤组织;苯丙烷代谢;防御酶;次生代谢产物;影响因素
中国分类号:S531 文献标识码:A
文章编号:0439-8114(2019)20-0014-07
DOI:10.14088/j.cnki.issn0439-8114.2019.20.003 开放科学(资源服务)标识码(OSID):
Recent advances in research on callus formation and influencing factors of sweet potato
LYV Xiao-long1,2,3,SUN Jie1,3,WANG Xi-zhuo1,3,WANG Cai-xia2,ZHOU Xin-qun1,CHEN Lin2
(1.Chinese Academy of Agricultural Engineering Planning & Design,Beijing 100125,China;
2.College of Food Science,Sichuan Agricultural University,Yaan 625014,Sichuan,China;
3.Key Laboratory of Agro-Products Postharvest Handling,Ministry of Agriculture and Rural Affairs,Beijing 100121,China)
Abstract: Callus treatment is a pretreatment measure to ensure the effective and safe storage of sweet potato (Ipomoea batatas L.), which not only contributes to the formation of sweet potato callus periderm and prevents the infection of diseases, but also effectively reduces the loss of water during storage. The research and promotion of the hot callus and equipment of sweet potato is of great significance to the development of sweet potato industry in China. The research progress of the formation process and action of sweet potato callus, the synthetic pathway of callus and its influencing factors were reviewed. The effects of phenylpropane metabolism pathway, defense enzyme and secondary metabolites on sweet potato callus were summarized, and the factors affecting the formation of sweet potato callus were analyzed, which provided theoretical basis for screening the callus conditions and developing the technology and equipment of sweet potato callus.
Key words: sweet potato (Ipomoea batatas L.); callus; phenylpropanoid metabolism; defense enzyme; secondary metabolite; impacting factors
甘薯(Ipomoea batatas L.)是中國重要的粮食和蔬菜兼用作物,2017年甘薯种植面积为893.73万hm2,总产量3 418.9万t,单位面积产量3 825.4 kg/hm2[1]。甘薯块根体积大、水分多、皮薄肉嫩,在田间采收、运输装卸和入库贮藏过程中都可能会遭受擦伤、刺伤、割伤、碰伤和压伤等伤害[2,3]。甘薯损伤一方面破坏了甘薯本身的组织结构,造成甘薯生理代谢紊乱,引发一系列不利于贮藏的生理生化反应;另一方面,损伤给微生物侵入提供了机会,使甘薯腐烂变质。据统计,中国采后15%的甘薯因保藏不当而腐烂变质[4]。为降低甘薯采后损失,阻止病原物的侵入,对采后甘薯进行适当的愈伤处理将有助于提高甘薯自身的抗病性并延长贮藏期限。
愈伤处理对甘薯损伤后减少病原物侵入、失水、干裂或干缩等具有重要意义。甘薯遭受机械损伤后,体内自我防御系统受伤信号的转导快速作出响应,启动自我修复功能,在损伤部位重新形成愈伤组织使伤口愈合,称为自然愈伤[5]。自然愈伤易受温度、湿度等外部条件影响,愈伤周期较长,处理不当甚至会加速腐烂。为加快愈伤速度,降低甘薯被病菌侵染的风险以及营养流失的速度,可采用高温愈伤处理。甘薯高温愈伤是受损伤的甘薯块根,在入窖初期用35~38 ℃的高温处理48 h,伤口自然形成愈伤木栓组织,使伤口愈合的生物学过程。愈伤组织的形成不仅可以减缓甘薯水分蒸发、氧化变质,阻止病原菌侵入,还可使损伤表面形成新的愈伤周皮,使甘薯块根恢复正常的生理功能,便于贮藏。近年来,随着甘薯产后处理技术的不断发展,有关甘薯产后愈伤的研究取得了很大的进展。本文从甘薯愈伤组织的形成过程和作用、愈伤组织的合成途径及其影响因素等方面进行阐述,旨在为甘薯产后愈伤的进一步研究提供理论参考。
1 甘薯愈伤组织的形成过程和作用
愈伤组织是由木栓细胞构成,无生命力,能阻止病原菌的侵入、减少水分散失,使甘薯呼吸平稳、干物质转化缓慢,耐贮性增强,从而起到保护甘薯块根的作用[6]。甘薯遭受机械损伤后,含有淀粉粒的薄壁细胞外露,在一定条件下即能形成愈伤组织。最初表现为伤口及邻近部位的2~3层薄壁细胞失水收缩,细胞变为长方形,淀粉粒聚积成团,在干缩细胞下有1~2层薄壁细胞木栓化,但细胞形状不变,仍呈圆形且细胞壁加厚。在木栓化细胞下面,有一层薄壁细胞中的淀粉粒逐渐消失,并在此部位重新分裂形成两层扁平形状的细胞,这两层细胞中,一层为木栓层细胞,另一层为木栓形成层细胞。木栓形成层细胞向内分裂出栓内层细胞,同时在木栓形成层外排列紧密的扁平细胞逐渐木栓化,形成愈伤木栓层,愈伤木栓层下面为排列整齐的木栓形成层和栓内层。因此,重新形成的甘薯愈伤组织自外向内依次分为三层:即木栓层、木栓形成层和栓内层[7]。木栓层是由木质素和软木质组成,其解剖结构与原来的周皮类似[8]。由于愈伤组织表层细胞中不含色素,故又叫无色素薯皮。图1为典型双子叶植物根的横切面[9]。
愈伤组织的形成对保证甘薯安全贮藏具有重要的生理作用,主要体现在两个方面:①抑制病菌侵染。黑斑病和软腐病是甘薯贮藏期间最常见的贮藏病害,采用适当的高温处理可有效抑制病菌的侵染。张晓申等[10]采用甘薯高溫窖藏方式,通过加热设备使窖内温度快速升高,在37 ℃下愈伤4 d后快速降温并通风贮藏,结果表明,此方法可有效防止病原菌的入侵,防止烂窖。同样将采收后的甘薯置于温度为29~32 ℃,相对湿度为90%的柴灰交替层中愈伤7 d能完全抑制病菌的发生、发展[11]。②代谢增强,抗性物质增加。研究发现,采后甘薯在温度为25~30 ℃,相对湿度为70%~90%条件下愈伤处理12 d后短期贮藏有助于甘薯中胡萝卜素的生成[12]。
种类和品种不同的甘薯,愈伤效果也存在差异。将采后Apomuden和Okumkom两个品种的甘薯在温度为25~30 ℃,相对湿度为80%~95%条件下自然愈伤后贮藏12周发现,Okumkom品种甘薯的愈伤效果优于Apomuden品种,虫害最低[13]。此外,愈伤组织的形成与木栓细胞的分化还会促使非木质化作用发生。细胞壁的非木质化修饰作用表现在一些特殊细胞壁蛋白质生成或增加,如伸展蛋白[14-16]、富含甘氨酸的蛋白质等,这些成分的变化与愈伤组织间的关系有待进一步研究。
2 甘薯愈伤组织的合成途径
甘薯愈伤是甘薯损伤后相关组织结构发生木栓化或木栓组织重新形成愈伤木栓组织的过程。愈伤木栓组织的形成主要是通过莽草酸途径、苯丙烷代谢途径在多种防御酶的催化作用下生成的木质素、类黄酮和总酚等次生代谢产物聚积而成。
2.1 苯丙烷代谢途径在甘薯愈伤中的作用
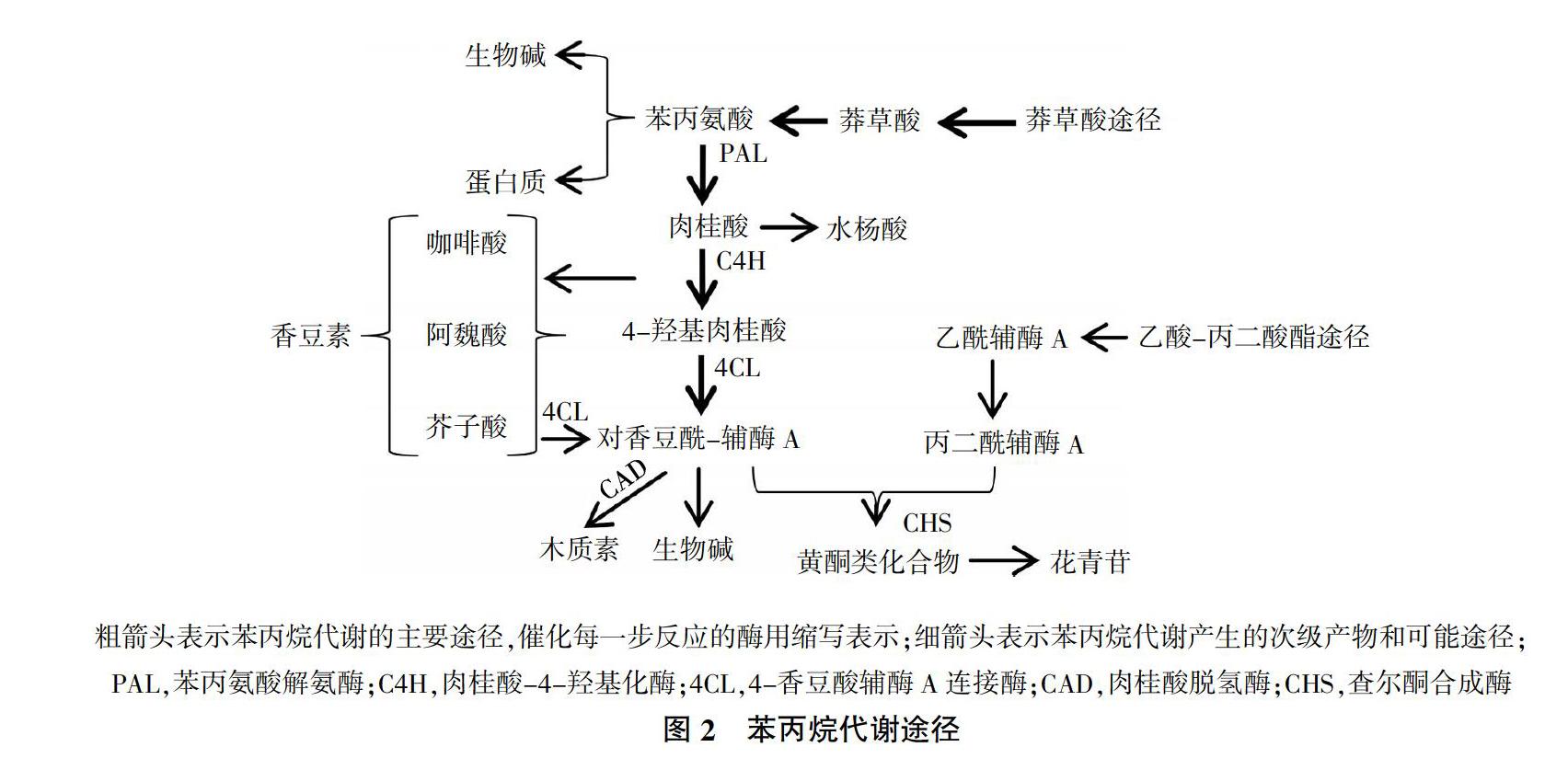
苯丙烷代谢途径是植物次生代谢产物合成的主要代谢途径之一,在采后甘薯愈伤过程中具有重要作用。甘薯遭受机械损伤后,促使木质素、总酚和类黄酮等次生代谢产物信号分子的生成和积累,这类信号分子通过输导组织传递给损伤部位的邻近细胞,激发甘薯启动防御反应抵御伤害[17]。莽草酸途径在糖酵解途径(EMP)和磷酸戊糖途径(PPP)的作用下产生的莽草酸经莽草酸激酶(SK)、分支酸合成酶(CS)催化生成分支酸、预苯酸,在转氨作用下形成苯丙氨酸,从而进入苯丙烷代谢途径[18-20]。在苯丙氨酸解氨酶(PAL)、肉桂酸-4-羟化酶(C4H)作用下,形成肉桂酸、4-羟基肉桂酸、咖啡酸、阿魏酸、芥子酸等多种中间产物,进一步转化成水杨酸、香豆素、绿原酸,也可在4-香豆酰-辅酶A连接酶(4CL)的作用下催化形成对香豆酰-辅酶A。最后,经木质素生物合成途径和类黄酮途径生成木质素、类黄酮等次生代谢产物[21,22]。图2为苯丙烷代谢途径[23]。
PAL、C4H和4CL作为苯丙烷代谢途径的关键酶,在甘薯伤口愈合过程中起至关重要的作用。研究发现,甘薯遭受机械损伤、微生物侵染等逆境时,莽草酸途径、苯丙烷代谢途径等防御系统被激活,诱导PAL活性迅速上升。Tanaka等[24]通过对切伤甘薯块根PAL活性研究发现,甘薯块根PAL在粗酶液中失活后,在经过10 h左右的剪切损伤处理后PAL活性显著上升,孵育24 h后达到最大值。Yin等[25]通过研究一氧化氮(NO)对甘薯块根中PAL活性和抗氧化反应的影响,结果表明经NO处理后的损伤甘薯块根,在温度为28±1 ℃,相对湿度为85%愈伤5 d后,NO可有效促进PAL活性升高,显著增强抗氧化防御系统,促进损伤甘薯伤口愈合。刘程惠等[26]对鲜切甘薯在不同温度下贮藏期间生理生化变化研究表明,随着贮藏时间的延长,PAL活性呈上升趋势。因此,PAL活性常作为甘薯抗性的重要指标。C4H是苯丙烷代谢途径中第二个关键酶,能够促进苯丙烷代谢途径发生,控制苯丙烷类化合物不同方向的生物代谢,生成以木质素为主的次级代谢产物,进而转化为木质醇类形成大分子的H-型、G-型和S-型木质素,并伴随POD单体和漆酶氧化聚合沉积在细胞壁上,增强甘薯的抗病性[27-29]。4CL又称4-香豆酰-辅酶A合成酶、羟基肉桂酸-辅酶A连接酶,是苯丙烷代谢途径的最后一种酶,是多种生物合成所必需的酶,它通过两步反应催化4-香豆酰辅酶A酯的生成和肉桂酸的羟基或甲基氧衍生物,如咖啡酸、阿魏酸和香豆酸[30-33]。
肉桂醇脱氢酶(CAD)是由PAL催化苯丙氨酸转化为肉桂酸,在还原型辅酶Ⅱ(NADPH)存在下催化肉桂醛还原成醇(4-香豆醇、松柏醇和芥子醇),CAD参与了单链烷基化醇的生成,它产生的酚类化合物被认为是单链烷烃,同时也是木质素生物合成途径中的最后关键酶[34-36],在甘薯木质素合成途径中发挥重要作用。查尔酮合成酶(CHS)是催化苯丙烷代谢途径转入黄酮类生物合成途径的第一个酶,由香豆酰辅酶A与苹果酰辅酶A缩合形成四羟基查尔酮,从而为黄酮类次生代谢产物的合成提供前体物质[37],目前该酶的基因克隆与表达已有学者进行了相关研究[38]。
2.2 防御酶在甘薯愈伤中的作用
甘薯遭受机械损伤等物理因素或化学物质等胁迫时,体内活性氧自由基积累会造成甘薯氧化褐变,而过氧化物酶(POD)和多酚氧化酶(PPO)两种防御酶作为愈伤过程中的重要酶,对愈伤周皮的形成具有重要作用,可有效清除活性氧自由基,减少氧化损失,增加甘薯块根抵抗外界不良环境的能力[39]。POD参与催化肉桂酸的聚合,是木栓化组织形成过程中的关键酶。甘薯受到机械损伤后POD活性呈上升趋势,促使木质素生成积累[40]。胁迫相关化学物质对损伤甘薯POD活性的影响研究发现,外源激素ABA和乙烯利可显著提高POD活性[41]。甘薯切片后置于25 ℃条件下,孵育84 h后,研究发现POD活性的提高是由于酶的重新合成所致[42],甘薯切割处理后亦发现类似结果[43]。PPO是引起甘薯酶促褐变的主要酶类,催化甘薯原料中的内源性多酚物质氧化生成黑色素,对甘薯愈伤组织的形成具有一定影响。鲜切紫薯的褐变程度影响研究发现,切割处理会引起PPO活性明显上升[44],同时对紫薯鲜切处理后PPO的热稳定性研究发现,紫薯中的PPO活性对温度的变化非常敏感,当温度分别为16、30 ℃时,PPO活性最高,但当温度低于5 ℃或高于45 ℃时,PPO活性迅速下降[45]。邵廷富等[46]分别将受伤甘薯放置于不同高温下愈伤处理,研究表明甘薯愈伤的最高温度不能超过40 ℃,否则PPO活性显著下降,不利于伤口愈合。
2.3 次生代谢产物合成
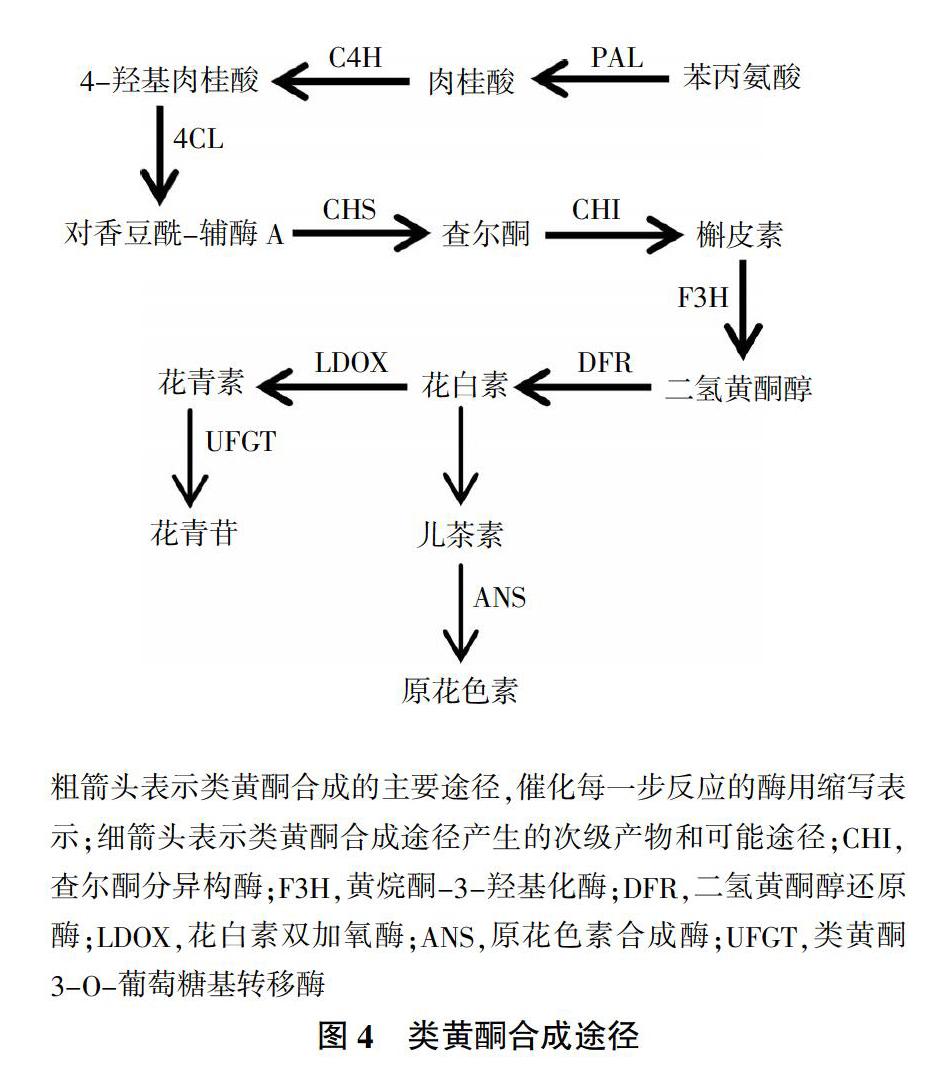
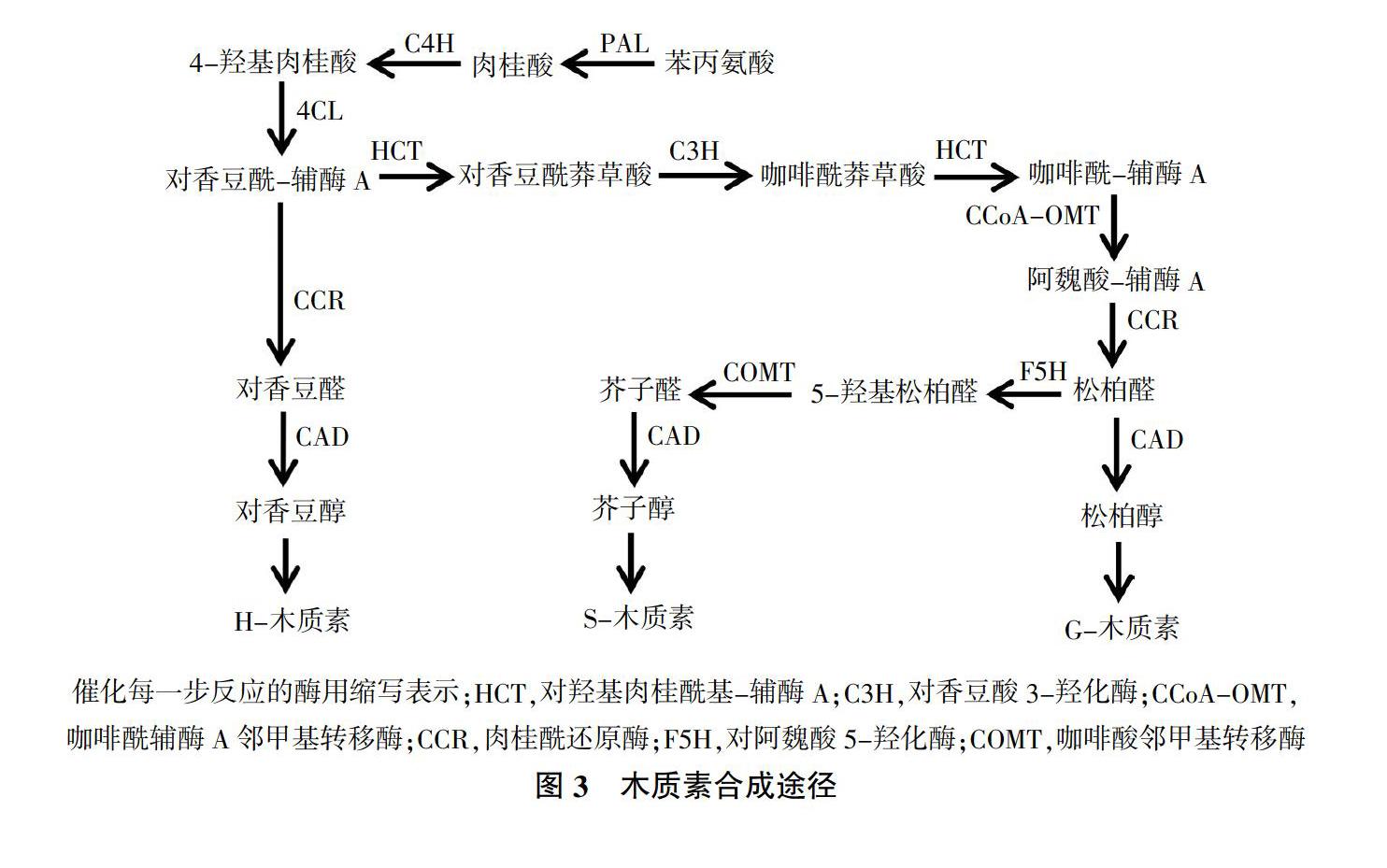
次生代谢产物(Secondary metabolites)是由苯丙烷代谢途径产生的一类细胞生命活动或植物生长发育正常运行所必需的小分子有机化合物,其产生速率及积累数量与甘薯品种、环境条件具有密切关系。甘薯遭受机械损伤后,会诱导产生一系列次生代谢产物,如木质素、类黄酮和绿原酸等。这些物质主要分布于甘薯损伤表面及邻近部位,参与愈伤组织形成,减少水分蒸腾和防止病原菌入侵。木质素作为植物细胞壁的重要组成部分,是细胞壁次生加厚过程中产生的主要代谢产物。木质素的合成经过脱氨基、羟基化和甲基化等过程,形成以对香豆醇、芥子醇和松柏醇为主的木质醇类,然后转运到细胞壁聚合形成H-型、G-型和S-型木质素[47,48](图3),目前关于木质素生物合成途径已有大量文献报道。类黄酮泛指两个芳香环通过3碳链连接而成的黄酮类、黄酮醇类和花色素类等系列化合物。黄酮类化合物是由莽草酸途径、苯丙烷代谢途径和乙酸-丙二酸酯途径衍生而来,主要是在CHS催化下,对香豆酰辅酶A和丙二酰辅酶A结合形成C15架的第一个黄酮类化合物四羟基查尔酮,在查尔酮异构酶(CHI)作用下形成槲皮素,槲皮素经各种基团转移酶修饰,形成二氢黄酮醇、花白素、儿茶素、花青素和花青苷等[49-51](图4)。绿原酸既是愈伤反应中产生木质素的来源,也是细胞木质化的物质基础。研究发现,将损伤甘薯在29 ℃条件下愈伤10 d,伤口愈合过程中绿原酸的积累与愈伤周皮的形成密切相关[52]。种类和品种不同的甘薯,产生次生代谢产物速率和生成量存在差异。Oirschot等[53]通过对不同品种甘薯伤口愈合效率研究得出,甘薯品种是影响甘薯愈伤周皮木质化形成的主要因素。
3 影响甘薯愈伤组织形成的因素
3.1 品种
甘薯品种较多,按照用途可分为淀粉加工用品种、菜用型品种和食用及食品加工用品种三大类,其中食用及食品加工用品种的含糖量较高、成熟早、耐贮藏,深受消费者青睐。然而,不同品种的甘薯对损伤后愈伤效果不同。Stewart等[54]分別将3个品种的损伤甘薯置于温度为30 ℃,相对湿度为85%条件下愈伤7 d后,放入14.4 ℃,相对湿度为85%条件下贮藏4个月对其品质进行研究,结果表明经愈伤处理的甘薯比未愈伤处理的甘薯贮藏效果好。Nabubuya等[55]通过对比乌干达的5个甘薯品种愈伤(29~31 ℃,相对湿度63%~65%,晒4 d)和未愈伤处理对甘薯块根总淀粉和还原糖含量的变化,发现经愈伤处理后的甘薯总淀粉含量显著低于未愈伤处理甘薯。Nabubuya等[56]通过对5个不同品种甘薯块根的发育过程中α和β-淀粉酶活性的变化以及不同采后处理和贮藏条件进行研究表明,在温度为29~31 ℃,相对湿度为63%~65%条件下愈伤4 d的甘薯贮藏8周后发现β-淀粉酶活性在第3周达到最大值,这一发现为甘薯品种的淀粉酶活性的抑制、产品开发和延长甘薯贮藏期限提供了参考。
3.2 损伤程度
甘薯块根根据其损伤严重程度,可分为生长裂纹、机械损伤、粉碎性压伤,其中机械损伤最为常见。甘薯受到机械损伤后,可诱导伤口周围细胞壁的氧化修饰和乙烯的产生,促进次生代谢产物的积累,细胞壁厚度增强,形成愈伤周皮。愈伤周皮的形成可有效阻止病菌入侵和水分逸失。机械损伤和化学损伤对甘薯块根乙烯产生的影响研究发现,化学损伤和机械损伤均会导致甘薯块根中乙烯含量增加,其中机械损伤后乙烯释放量相对较快[57]。切伤后的甘薯块根还可诱导损伤组织近端细胞的多酚类物质积累,PAL、4CL和POD等多种酶活性升高[58]。
3.3 温度和湿度
适宜的贮藏环境对甘薯愈伤组织的形成至关重要。温度是影响甘薯伤口愈合的一个重要因子[59],不同温度条件对甘薯愈伤的速率有所不同。据国外研究发现,甘薯收获后通常在温度为27~35 ℃,相对湿度为80%~90%条件下,愈伤周皮形成最快,当愈伤温度过高或过低时,愈伤困难,甚至伤口不能愈合。研究表明,18个品种的甘薯在温度为30 ℃,相对湿度为85%条件下愈伤7 d后,置于15 ℃条件贮藏5周可有效促进甘薯木质化和伤口周皮的形成[60]。在国外,愈伤的目的是促进伤口愈合,而国内主要是控制黑腐病和软腐病的侵染,防止甘薯腐烂变质,通常选择既能灭菌又能促进愈伤的温度。辽南地区主栽甘薯品种豫10号在温度为32 ℃,相对湿度为90%条件下愈伤4 d后发现经愈伤处理的豫薯10号比未愈伤处理的甘薯更耐贮藏[61]。除温度以外,湿度对甘薯愈伤组织的形成也具有极其重要的影响。适宜的湿度可有效防止甘薯愈伤过程中水分散失,品质下降,避免无氧呼吸发生而促使甘薯发芽腐烂。Rees等[62]将17种不同品种甘薯在低湿度(65%)常温条件下愈伤5 d后对其愈伤组织伤口附近的碳水化合物变化及其愈伤效率进行研究,结果表明,在低湿度条件下,17个品种的碳水化合物与伤口木质化评分呈正相关,且不同品种伤口愈合的效率不同。
3.4 外源生长调节剂
甘薯愈伤过程既有甘薯自身免疫作用,也可通过添加外源生长调节剂促进甘薯伤口快速愈合,如添加脱落酸(ABA)、苯丙噻重氮(BTH)、吲哚乙酸(IAA)和外源乙烯等,促使甘薯愈伤组织快速形成,延缓其贮藏期限。Amoah等[63]以新鲜甘薯为原料,损伤后置于温度为30 ℃,相对湿度为90%条件下愈伤7 d,研究了外源乙烯添加时间对甘薯贮藏块根的影响,结果表明,外源乙烯的添加不仅对甘薯块根中的单糖、酚类化合物和内源植物生长调节剂的代谢有明显的促进作用,而且还可以有效抑制贮藏块根的发芽。Tanaka等[64]通过研究生长素和其他生长调节剂对损伤甘薯代谢反应的影响,结果表明,IAA具有刺激损伤部位相关酶活性增强的能力,其他生长调节剂对酶活性无显著影响,同时IAA还可引起对无乙烯介导的损伤代谢反应。
4 结论与展望
影响甘薯高温愈伤途径和效果的因素主要取决于甘薯的品种、损伤程度、愈伤的温度和湿度以及外源生长调节剂等因素。甘薯愈伤组织的形成是一个涉及多途径、多种基因的复杂过程。目前,对于甘薯愈伤组织的形成过程虽已有研究,但整个合成代谢途径中仍存在许多未知领域,如甘薯愈伤组织形成速率在不同品种、不同组成与结构、不同贮藏环境可能存在差异,这些差异仍需深入研究。而苯丙烷代谢途径、愈伤防御体系和次生代谢产物合成途径是由多种生物酶系相互作用的结果,目前已被克隆并用于遗传操作的主要有PAL、C4H、4CL、CAD、CHS等多种酶系,不同酶系之间存在多种交互作用,其基因的表达与调控对甘薯愈伤体系的形成有不同程度的影响。
中国作为世界种植面积最大、产量最多的甘薯生产国,未来应结合现代分子生物学技术和分子遗传操作技术,综合内在基因表达、基因调控等多方面,深入挖掘甘薯愈伤的生理生化机制,加速培育品质保持更好、贮藏性能更佳的甘薯品种,积极研发适宜的甘薯产后愈伤控温控湿设备,降低防腐保鲜剂的使用,保障甘薯周年供应和贮藏品质,促进中国甘薯产业绿色科学发展。
参考文献:
[1] 国家统计局.国家统计局关于2017年粮食产量的公告[EB/OL].http://www.stats.gov.cn/tjsj/zxfb/201712/t20171208_1561546.html,2017-12-08.
[2] PARMAR A,KIRCHNER S M,STURM B,et al. Preharvest curing:Effects on skin adhesion,chemical composition and shelf-life of sweetpotato roots under tropical conditions[J].East african agricultural and forestry journal,2017,82:1-15.
[3] VAN OIRSCHOT Q E A,REES D,AKED A,et al. Sweetpotato post-harvest assessment:Experiences from East Africa. Chapter 6. Curing and the physiology of wound healing[M].Chatham,UK:Natural resources institute,2003.
[4] 张有林,张润光,王鑫腾.甘薯采后生理、主要病害及貯藏技术研究[J].中国农业科学,2014,47(3):553-563.
[5] LULAI E C,NEUBAUER J D. Wound-induced suberization genes are differentially expressed,spatially and temporally,during closing layer and wound periderm formation[J].Postharvest biology and technology,2014,90:24-33.
[6] EDWARD C,LULAI. Porometric measurements indicate wound severity and tuber maturity affect the early stages of wound-healing[J].American potato journal,1995,72(4):225-241.
[7] 韩雪源,茅林春.木栓质组成成分、组织化学特性及其生物合成研究进展[J].植物学报,2017,52(3):358-374.
[8] WALTER W M J R,SCHADEL W E. A rapid method for evaluating curing progress in sweetpotatos[J].Journal american society for horticultural science,1982,107(6):1129-1133.
[9] VISHWANATH S J,DELUDS C,DOMERGUE F,et al. Suberin:Biosynthesis,regulation,and polymer assembly of a protective extracellular barrier[J].Plant cell reports,2015,34(4):573-586.
[10] 张晓申,王慧瑜,李晓青.甘薯的收获和安全贮藏技术[J].陕西农业科学,2009,55(6):236-239.
[11] AGBEMAFLE R,OWUSU S J D,OTCHERE J K,et al. Effect of different storage methods on the proximate composition and functional properties of cream-skinned sweet potato(Ipomea batatas Lam)[J].Scholars journal of engineering and technology,2014,2(1):33-44.
[12] PRIYADARSHANI A M B,JANSZ E R,PEIRIS H. A study on post-harvest catotenogenesis of sweet potatos under two different storage conditions[J].J Natn Sci Foundation Sti Lanka,2007,35(1):53-55.
[13] ESSILFIE M E,DAPAAH H K,OFOSUANIM J,et al. Effect of different storage methods and fertilizer rates on quality of sweetpotato (Ipomoea batatas L.) storage roots[J].International journal of plant and soil science,2016,10(1):1-12.
[14] SABBA R P,LULAI E C. Immunocytological comparison of native and wound periderm maturation in potato tuber[J].American journal of potato research,2004,81(2):119-124.
[15] LULAI R P S A. Immunocytological analysis of potato tuber periderm and changes in pectin and extensin epitopes associated with periderm maturation[J].J Amer Soc Hoet Sci,2005, 130(6):936-942.
[16] SABBA R P,LULAI E C. Histological analysis of the maturation of native and wound periderm in potato (Solanum tuberosum L.) tuber[J].Ann Bot,2002,90(1):1-10.
[17] ENYEDI A J,YALPANI N,SILVERMAN P,et al. Signal molecules in systemic plant resistance to pathogens and pests[J].Cell,1992,70(6):879-886.
[18] FIRON N,LABONTE D,VILLORDON A,et al. Transcriptional profiling of sweetpotato(Ipomoea batatas) roots indicates down-regulation of lignin biosynthesis and up-regulation of starch biosynthesis at an early stage of storage root formation[J].Bmc genomics,2013,14(1):2-24.
[19] DIXON R A,ACHNINE L,KOTA P,et al. The phenylpropanoid pathway and plant defence-a genomics perspective[J].Molecular plant pathology,2010,3(5):371-390.
[20] WEISSHAAR B,JENKINS G I. Phenylpropanoid biosynthesis and its regulation[J].Current opinion in plant biology,1998, 1(3):251-257.
[21] 馬 杰,胡文忠,毕 阳,等.鲜切果蔬活性氧产生和抗氧化体系代谢的研究进展[J].食品科学,2013,34(7):316-320.
[22] BARBER M S,MITCHELL H J. Regulation of phenylpropanoid metabolism in relation to lignin biosynthesis in plants[J].International review of cytology,1997,172:243-293.
[23] 陈建业.葡萄酒中酚酸及葡萄果实苯丙烷类代谢途径研究[D]. 北京:中国农业大学,2005.
[24] TANAKA Y,MATSUSHITA K,URITANI I. Some investigations on inactivation of phenylalanine ammonia-lyase in cut-injured sweet potato root tissue[J].Plant and cell physiology,1977,18(6):1209-1216.
[25] YIN J Y,BAI S,WU F H,et al. Effect of nitric oxide on the activity of phenylalanine ammonia-lyase and antioxidative response in sweetpotato root in relation to wound-healing[J].Postharvest biology and technology,2012,74(6):125-131.
[26] 刘程惠,胡文忠,王艳颖,等.不同贮藏温度下鲜切甘薯的生理生化变化[J].食品工业科技,2012,33(17):342-345.
[27] BOERJAN W,RALPH J,BAUCHER M. Lignin biosynthesis[J].Annual review of plant biology,2003,54:519-546.
[28] 高 丽,杨海莉,王 沛,等.木栓质及其生理功能[J].草业科学,2018,35(5):1218-1231.
[29] TANAKA Y,KOJIMA M,URITANI I. Properties, development and cellular-localization of cinnamic acid 4-hydroxylase in cut-injured sweet potato[J].Plant and cell physiology,1974,15(5):843-854.
[30] LI Y,KIM J I,PYSH L,et al. Four isoforms of arabidopsis thaliana 4-coumarate:CoA ligase (4CL) have overlapping yet distinct roles in phenylpropanoid metabolism.[J].Plant physiology,2015,169(4):2409-2421.
[31] LI L,WANG X B,YANG L,et al. Quantitative evaluation of 4-coumarate:CoA ligase(4CL) activity and correlated chemical constituents in four plant materials by chromatographic analysis[J].Chinese journal of natural medicines,2010,8(4):274-279.
[32] KUMAR A,ELLIS B E. 4-coumarate:CoA ligase gene family in Rubus idaeus:cDNA structures,evolution,and expression[J].Plant molecular biology,2003,51(3):327-340.
[33] CUKOVIC D,EHLTING J,VANZIFFLE J A,et al. Structure and evolution of 4-coumarate:Coenzyme A ligase (4CL) gene families[J].Biological chemistry,2001,382(4):645-654.
[34] JIN N,AWANO T,TAKABE K,et al. Immunocytochemical localization of phenylalanine ammonia-lyase and cinnamyl alcohol dehydrogenase in differentiating tracheary elements derived from zinnia mesophyll cells[J].Plant and cell physiology,1997,38(2):113-123.
[35] RICHARD L M,GROSS G,STCKIGT J,et al. Purification and properties of cinnamyl alcohol dehydrogenase from higher plants involved in lignin biosynthesis[J].Phytochemistry,1974,13(11):2427-2435.
[36] KO H,KOICHIRO A,MARI K,et al. OsCAD2 is the major CAD gene responsible for monolignol biosynthesis in rice culm[J].Plant cell reports,2012,31(1):91-101.
[37] 徐 靖,朱家紅,王效宁,等.甘薯查尔酮合成酶基因IbCHS1的克隆和表达分析[J].分子植物育种,2018,16(6):1752-1757.
[38] YAO P F,ZHAO H X,LUO X P,et al. Chalcone synthase homologous genes cloning and expression pattern in flowering Fagopyrum tataricum Gaertn[J].Russian journal of plant physiology,2016,63(6):790-799.
[39] HYODO H,URITANI I. Properties of polyphenol oxidases produced in sweet potato tissue after wounding[J].Archives of biochemistry and biophysics,1967,122(2):299-309.
[40] PARK S Y,RYU S H,KWON S Y,et al. Differential expression of six novel peroxidase cDNAs from cell cultures of sweetpotato in response to stress[J].Molecular genetics and genomics,2003,269(4):542-552.
[41] KWAK S S,KIM S K,PARK I H,et al. Enhancement of peroxidase activity by stress-related chemicals in sweet potato[J].Phytochemistry,1996,43(3):565-568.
[42] SHANNON LM,URITANI I, IMASEKI H. De novo synthesis of peroxidase isozymes in sweet potato slices[J].Plant physiology,1971,47(4):493-498.
[43] 程 雙.鲜切果蔬酶促褐变发生机理及其调控的研究[D].辽宁大连:大连工业大学,2010.
[44] LIU X H,ZHANG K F,LI M Z.Study on browning degree of fresh-cut purple sweet potato and its inhibition during storage[J].Advanced materials research,2013,712-715:409-414.
[45] XUE M R,LI K M,LEE M H,et al. Study on heat stability of polyphenol oxidase from purple sweet potato[J].Applied mechanics and materials,2015,716-717:122-125.
[46] 邵廷富,谢永清.甘薯高温愈伤的代谢生理[J].河南工业大学学报(自然科学版),1983(1):3-8.
[47] YOON J,CHOI H,AN G. Roles of lignin biosynthesis and regulatory genes in plant development[J].Journal of integrative plant biology,2015,57(11):902-912.
[48] VANHOLME R,DEMEDTS B,MORREEL K,et al. Lignin biosynthesis and structure[J].Plant physiology,2010,153(3):895-905.
[49] XU F,GAO X,XI Z M,et al. Application of exogenous 24-epibrassinolide enhances proanthocyanidin biosynthesis in Vitis vinifera ‘Cabernet Sauvignon berry skin[J].Plant growth regulation,2015,75(3):741-750.
[50] LI Q,HE F,ZHU B Q,et al. Comparison of distinct transcriptional expression patterns of flavonoid biosynthesis in Cabernet Sauvignon grapes from east and west China[J].Plant physiology and biochemistry,2014,84:45-56.
[51] ALI M B,HOWARD S,CHEN S,et al. Berry skin development in Norton grape:Distinct patterns of transcriptional regulation and flavonoid biosynthesis[J].BMC Plant biology,2011, 11(1):2-23.
[52] MCCLURE T T. Chlorogenic acid accumulation and wound healing in sweet potato roots[J].American journal of botany,1960,47(4):277-280.
[53] OIRSCHOT O E A V,REES D,AKED J,et al. Sweetpotato cultivars differ in efficiency of wound healing[J].Postharvest biology and technology,2002,42(1):65-74.
[54] STEWART H E,FARKAS B E,BLANKENSHIP S M,et al. Physical and thermal properties of three sweetpotato cultivars (Ipomoea Batatas L.)[J].International journal of food properties,2000,3(3):433-446.
[55] NABUBUYA A,NAMUTEBI A,BYARUHANGA Y,et al. Influence of development, postharvest handling,and storage conditions on the carbohydrate components of sweetpotato (Ipomea batatas Lam.) roots[J].Food science and nutrition,2017,5(6):1088-1097.
[56] NABUBUYA A,NAMUTEBI A,BYARUHANGA Y,et al. Amylolytic activity in selected sweetpotato (Ipomoea batatas Lam) varieties during development and in storage[J].Food and nutrition sciences,2012,3(5):660-668.
[57] IMASEKI H,UHTTANI I,STAHMANN M A. Production of ethylene by injured sweet potato root tissue[J].Plant and cell physiology,1968,9(4):757-768.
[58] TANAKA Y,URITANI I. Polarity of production of polyphenols and development of various enzyme activities in cut-injured sweet potato root tissue[J].Plant physiology,1977,60(4):563-566.
[59] WIJEWARDANA C,REDDY K R,SHANKLE M W,et al. Low and high-temperature effects on sweetpotato storage root initiation and early transplant establishment[J].Scientia horticulturae,2018,240(20):38-48.
[60] AMAND P C S,RANDLE W M. Ethylene production as a possible indicator of wound healing in roots of several sweet potato cultivars[J].Euphytica,1991,53(2):97-102.
[61] 吳朝霞,季宏波,徐 冰,等.辽南地区三种主栽甘薯品种的耐贮性及愈伤处理对贮存品质影响的初步研究[J].食品工业,2011,32(6):70-72.
[62] REES D,OIRSCHOT Q E A V,AKED J. The role of carbohydrates in wound-healing of sweetpotato roots at low humidity[J].Postharvest biology and technology,2008,50(1):79-86.
[63] AMOAH R S,LANDAHL S,TERRY L A. The timing of exogenous ethylene supplementation differentially affects stored sweetpotato roots[J].Postharvest biology and technology,2016,120:92-102.
[64] TANAKA Y,URITANI I. Effect of auxin and other hormones on the metabolic response to wounding in sweet potato roots[J].Plant and cell physiology,1979,20(8):1557-1564.
