选择性上调pSmad 3C/3L基因对人肝星状细胞增殖及α平滑肌肌动蛋白、纤维酶原激活物抑制剂-1和Ⅰ型胶原蛋白表达的影响
2019-12-11徐媛媛闻广华张冲杨雁
徐媛媛,闻广华,张冲,杨雁
近年来,肝纤维化和肝癌已经逐渐成为一种常见的且危害性极大的疾病。国内外流行病学的相关研究报告均显示,我国目前是肝癌病人数量最多的国家之一,2012年全球肝癌就新增78.25万例,其中745 500例死亡,仅中国就占全球肝癌病例和死亡总数的50%左右,且肝癌的高发率和高病死率令广大医学研究者担忧[1-2]。鉴于肝癌的难治愈性,针对早期肝纤维化的逆转成为广大学者的研究重点[3-5]。已有文献报道,转化生长因子-β1(TGF-β1)是肝纤维化肝癌发生发展的主要调控因子[6],Smad3是TGF-β1在细胞内信号转导的关键信号分子[7-8]。TGF-β1自肝星状细胞分泌后,可进一步地与细胞膜上的特异性受体产生稳定结合,这种稳定结合的结果是促使Smad3蛋白在胞内的活化,活化后的Smad3蛋白可随即与胞内的Smad4蛋白进一步结合形成易于转导入细胞核内的蛋白分子共聚体,最终实现靶基因的激活、转录与表达[9]。临床病例研究表明,在慢性乙型肝炎到肝纤维化、肝癌的发展过程中,肝脏中pSmad3L逐渐升高,而pSmad3C逐渐降低。且在成功的抗肝炎病毒治疗后,肝细胞pSmad3C水平恢复正常,同时pSmad3L水平呈现降低趋势[10]。大量研究均表明Smad3不同位点磷酸化在肝纤维化肝癌的进展中发挥重要作用[11],然而具体作用机制仍未阐明。
本研究于2017年3月至2018年5月采用脂质体转染的技术向人肝星状细胞(LX-2)转染野生型Smad3基因(Smad3 WT)、Smad3连接区磷酸化位点突变的基因(Smad3 EPSM)及Smad3 C末端磷酸化位点突变的基因(Smad3 3S-A)3种质粒,实现选择性上调LX-2细胞中pSmad 3C/3L基因的表达水平。以蛋白质印迹法(Western Blot)验证转染效率,并检测LX-2细胞中的α平滑肌肌动蛋白(α-SMA)、纤维酶原激活物抑制剂-1(PAI-1)和Ⅰ型胶原蛋白(Collagen-Ⅰ)的表达水平。以四甲基偶氮唑盐微量酶反应比色法(MTT法)检测选择性上调pSmad 3C/3L对LX-2细胞增殖能力的影响。观察TGF-β1诱导的Smad3不同位点磷酸化对人肝纤维化细胞增殖和肝纤维化关键蛋白表达的影响,进一步探究pSmad 3C/3L在肝纤维化进展中的作用机制。
1 材料与方法
1.1 仪器与试剂YJ-1450型医用净化工作台(北京冠鹏净化设备有限责任公司);Nap-co-6100型二氧化碳培养箱(美国杜邦公司);多功能酶标仪(荷兰雷勃公司)。DMEM培养基(美国HyClone公司,20170213);新生胎牛血清(杭州四季青生物工程材料有限公司,19070503);TGF-β1(Peprotech 公司,20161015);FuGENE®HD转染试剂(Promega公司,20161121);选择培养基(Opti-MEM,20150507);3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)(美国Sigma公司产品,20161207);Western及IP细胞裂解液(20170530)、BCA蛋白浓度试剂盒(碧云天生物研究所20170918);3种质粒和pSmad3L抗体(日本关西医科大学Matsuzaki博士惠赠);Smad3(20170621)、Collagen-Ⅰ、PAI-1(20170309)和α-SMA抗体(Santa Cruz生物技术公司,20170415);pSmad3C抗体(Cell Signaling Technology公司,20170110)
1.2 细胞株LX-2细胞株购于上海康朗生物科技有限公司。
1.3 选择性上调pSmad3C/L的LX-2细胞系的建立
1.3.1 细胞培养与实验分组 LX-2细胞于含15%胎牛血清的DMEM培养基中,37℃,5%二氧化碳中常规培养。细胞转染和蛋白检测实验中,普通LX-2细胞和3种质粒转染组分别设置对照组,TGF-β1刺激1 h组,TGF-β1刺激12 h组。细胞增殖实验中,LX-2细胞和3种质粒转染组分别设置对照组和TGF-β1刺激组。
1.3.2 Smad3 WT、Smad3 EPSM和Smad3 3S-A质粒转染LX-2细胞 将15%的DMEM培养基中培养至95%融合的LX-2细胞接种到6孔板中,待24 h后,6孔板中细胞培养至对数生长期,接近80%融合即可进行质粒转染。转染前弃去培养基,用磷酸缓冲盐溶液(PBS)洗2遍,配制转染试剂100 μL选择培养基(Opti-MEM)+2 μg(计算体积)质粒/孔+6 μL/孔Fugene®HD(脂质体转染试剂),室温孵15 min,加入FuGENE®HD时注意不要触碰EP管壁,充分混匀。孵育时间到后贴壁加入6孔板中。对照组加入空质粒和等体积的Opti-MEM+Fugene HD。所有加入无血清无双抗的培养基放入37℃、5%二氧化碳培养箱中培养。6 h后,更换含血清的完全培养基。
1.4 MTT法检测转染3种质粒对细胞增殖能力的影响转染3种质粒的LX-2细胞接种于96孔板中,种板密度为1×104/L,15%胎牛血清的培养基中培养24 h后,细胞密度接近90%时,饥饿过夜。除对照组外其余各孔分别加入9 pmol/L TGF-β1,而对照组添加等体积的无血清培养基,培养6~8 h。每组设置6个复孔。20 μL MTT加入到每孔中,37℃培养4 h。弃去各组细胞的培养液,每孔加入二甲基亚砜(DMSO)150 μL,吹打,蓝紫色充分溶解后,用酶标仪测量各孔490 nm波长处吸光度值。
1.5 蛋白质印迹法检测LX-2细胞中相关蛋白表达水平 转染3种质粒的LX-2细胞,吸除培养基,PBS洗1遍,加无血清无双抗的培养基,细胞饥饿12 h,随后加入TGF-β1刺激1 h或12 h后,Western及IP细胞裂解液提取细胞总蛋白,BCA蛋白定量试剂盒定量并调平蛋白样本浓度并变性。用十二烷基硫酸钠/聚丙烯酰胺凝胶电泳法检测目的蛋白表达水平,湿转移法将凝胶上的条带转移到膜上。转膜结束后,用剪刀剪个角标记正反,封闭后依次进行目的蛋白的特异性一抗二抗结合。最后使用Super Signal TM West Femto Trial Kit(赛默飞,中国)显影。
1.6 统计学方法本研究采用SPSS 17.0软件。统计结果表示为xˉ±s。多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用LSD法,P<0.05被认为差异有统计学意义。
2 结果
2.1 Smad3 WT、Smad3 EPSM和Smad3 3S-A 3种质粒转染LX-2细胞的结果TGF-β1(9 pmol/L)刺激1 h后,提取各组细胞总蛋白,蛋白质印迹法结果显示,与LX-2对照组比较,转染Smad3 WT、Smad3 EPSM和Smad3 3S-A 3种质粒的LX-2细胞中Smad3蛋白的表达均明显增加[(0.48±0.02),(0.57±0.03),(0.60±0.02),(0.59±0.03);P<0.05]。与LX-2+Smad3 WT组相比,转染Smad3 EPSM质粒的LX-2细胞中pSmad3C蛋白表达明显增加[(0.33±0.02)比(0.44±0.01),P<0.05],转染Smad3 S-A质粒组pSmad3L蛋白表达明显增加[(0.36±0.01)比(0.42±0.02),P<0.05]。此结果提示,转染3种质粒成功地选择性上调了LX-2细胞中pSmad 3C/3L的表达。见图1。
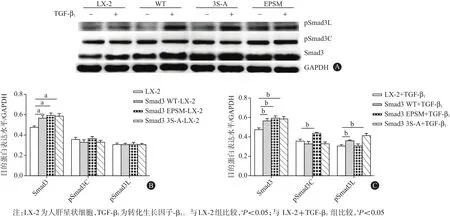
图1 转染野生型Smad3基因(Smad3 WT)、Smad3连接区磷酸化位点突变的基因(Smad3 EPSM)及Smad3 C末端磷酸化位点突变的基因(Smad3 3S-A)3种质粒后目的蛋白表达水平(n=3):A为蛋白质印迹法电泳图,B为无TGF-β1刺激时,目的蛋白表达柱状图,C为TGF-β1刺激后,目的蛋白表达柱状图
2.2 选择性上调pSmad 3C/3L对LX-2细胞增殖能力的影响MTT结果显示,在无TGF-β1刺激情况下,转染Smad3 WT、Smad3 EPSM和Smad3 3S-A 3种质粒本身对LX-2细胞增殖能力无明显影响[吸光度值(0.56±0.03),(0.59±0.09),(0.58±0.09),(0.59±0.04);P<0.05]。TGF-β1刺激6~8 h后,对LX-2组,Smad3 WT组、Smad3 3S-A组细胞增殖均有诱导作用,其中Smad3 3S-A质粒组对细胞增殖的促进作用更显著[吸光度值(0.78±0.06),(0.77±0.08),(0.93±0.05);P<0.05],提示:TGF-β1刺激可诱导LX-2细胞的增殖反应,选择性高表达pSmad3L可进一步促进TGF-β1诱导的细胞增殖反应。而转染Smad3 EPSM质粒组则表现出细胞增殖反应较无TGF-β1刺激组减弱[吸光度值(0.58±0.09)比(0.48±0.03),P<0.05],提示:TGF-β1刺激后,选择性高表达pSmad3C可抑制细胞增殖反应。见图2。

图2 选择性上调pSmad 3C/3L对LX-2细胞增殖能力的影响(n=6)
2.3 选择性上调pSmad 3C/3L对LX-2细胞中α-SMA、PAI-1和Collagen-Ⅰ蛋白表达水平的影响TGF-β1(9 pmol/L)刺激12 h后,提取各组细胞总蛋白,蛋白质印迹法结果显示,与对照组比较,α-SMA蛋白在Smad3 WT组略有增加,在Smad3 EPSM组明显降低,而在Smad3 S-A组表达明显增加[(0.66±0.04),(0.71±0.01),(0.50±0.004),(0.82±0.002);P<0.05]。与对照组比较,PAI-1蛋白在Smad3 WT质粒组无明显变化,在转染Smad3 EPSM质粒的LX-2细胞中表达明显减少,而在转染Smad3 S-A质粒组表达则明显增加[(0.30±0.006),(0.32±0.009),(0.20±0.004),(0.34±0.006);P<0.05]。Collagen-Ⅰ蛋白变化趋势与PAI-1相同[(0.27±0.002),(0.32±0.01),(0.24±0.003),(0.35±0.004);P<0.05]。此结果提示,选择性上调pSmad3C,可以抑制LX-2细胞中α-SMA、PAI-1和Collagen-Ⅰ的表达;而选择性上调pSmad3L则可促进α-SMA、PAI-1和Collagen-Ⅰ的表达。见图3。
3 讨论
研究表明,肝纤维化的主要病理机制在于细胞外基质(ECM)的沉积,而肝星状细胞是分泌ECM的主要细胞,是肝纤维化发生发展的关键环节[12]。Collagen-Ⅰ是ECM的主要成分,其含量的高低在一定程度上反应了肝纤维化的严重程度。抑制肝星状细胞的增殖,减少Collagen-Ⅰ的产生可以减轻甚至逆转肝纤维化[13]。α-SMA被普遍认为是肝星状细胞活化的标志性蛋白,有研究表明α-SMA含量的高低与肝星状细胞的增殖和肝纤维化的程度密切相关[12]。课题组前期研究表明,二乙基亚硝胺(DEN)诱导的大鼠肝纤维化-肝癌进展过程中,pS-mad3L和PAI-1蛋白的表达水平逐渐增加,进一步研究发现,复方丹参提取物和丹酚酸B均可通过调控TGF-β/Smad3信号通路的活化发挥抗肝纤维化-肝癌的作用,具体可能涉及到对Smad3不同位点磷酸化的水平的调控[14-15]。本研究通过转染Smad3 WT、Smad3 EPSM、Smad3 3S-A 3种质粒,选择性上调LX-2细胞中pSmad 3C/3L的表达,并进一步探讨选择性上调pSmad 3C/3L对LX-2细胞增殖功能的影响,及肝纤维化关键蛋白α-SMA、PAI-1和Collagen-Ⅰ表达的影响。

图3 选择性上调pSmad 3C/3L对LX-2细胞中α平滑肌肌动蛋白(α-SMA)、纤维酶原激活物抑制剂-1(PAI-1)和Ⅰ型胶原蛋白(Collagen-Ⅰ)表达水平的影响(n=3):A为蛋白质印迹法电泳图,B、C、D分别为α-SMA、PAI-1和Collagen-Ⅰ蛋白表达柱状图
瞬时转染和稳定转染是目前常用的质粒转染技术,瞬时转染方法由于其具有快速方便,转染周期较短,转染效率高等特点,目前在基础研究中使用越来越广泛[12-13]。瞬时转染技术可以在短时间内将携带特定外源基因的质粒转染进入细胞内,利用同源重组的原理整合到细胞染色体DNA上,实现进一步的表达[16-17]。本研究采用性能更优的FuGENE®HD脂质体转染试剂向LX-2细胞转染Smad3 WT、Smad3 EPSM及 Smad3 3S-A 3种质粒,选择性上调LX-2细胞中pSmad 3C/3L的表达水平,在细胞水平研究Smad3不同位点磷酸化在肝纤维化进展中的重要作用,进一步揭示肝病的临床病例研究中pSmad 3C/3L在肝脏中差异表达的内在分子机制[11],同时在一定程度上为本课题组后续构建的Smad3 C末端磷酸化位点突变的整体动物水平的研究提供了理论支撑。
肝星状细胞的过度增殖是肝纤维化发生发展的关键环节,本研究中,TGF-β1刺激后,选择性高表达pSmad3L可进一步促进TGF-β1诱导的细胞增殖反应,而选择性高表达pSmad3C可抑制TGF-β1诱导的细胞增殖反应。进一步的结果表明选择性上调pSmad3C,可以明显抑制LX-2细胞中PAI-1、Collagen-Ⅰ和α-SMA的表达;而选择性上调pSmad3L则可促进α-SMA、PAI-1和Collagen-Ⅰ的表达。上述结果提示,选择性上调pSmad 3C/3L表达可调控肝星状细胞的增殖和肝纤维化关键蛋白α-SMA、PAI-1和Collagen-Ⅰ表达,为肝纤维化的治疗提供新的思路。
