3-巯基丙酮酸硫转移酶产生的硫化氢在大鼠脑血管张力和脑血管内皮细胞缺氧损伤中的作用
2019-12-11李梦李亚男刘欣王香溢郭岩陈志武
李梦,李亚男,刘欣,王香溢,郭岩,陈志武
缺血性脑血管疾病是一种普遍的临床疾病,而且,目前对于全球,都是一个重要的公共卫生问题,可是它发病的病理、生理机制还不是很清楚。因此,对于医学界,如果能够明确缺血性脑损伤的机制是非常有价值的[1]。内源性硫化氢(hydrogen sulfide,H2S)是由血管内皮细胞产生和释放,并且参与脑血管疾病的过程。内源性硫化氢主要由胱硫醚-β-合成酶(l-cystathionine-β-synthetase,CBS)和胱硫醚-γ-裂解酶(L-cystathionine-γ-lyase,CSE)催化半胱氨酸(l-cysteine,L-Cys)生成[2]。线粒体酶3-巯基丙酮酸硫转移酶(3-mercaptopyruvate sulfurtransferase,3-MST)是在各种细胞和组织中新发现的内源性硫化氢来源之一[3]。据报道,3-MST主要存在于线粒体中,可催化线粒体中硫化氢的生成[4],有研究表明外源性硫化氢供体硫氢化钠对线粒体有明显的保护作用,可减少线粒体的损伤[5]。还有研究表明低浓度的硫化氢以及内源性线粒体内产生的硫化氢有利于哺乳动物细胞中线粒体电子运输和ATP生成[6]。因此,硫化氢可能也是保护线粒体免于损伤的一个重要的因素。鉴于硫化氢是参与缺血性脑损伤的重要因子,而目前文献资料对细胞质中CSE或CBS产生的硫化氢研究较多,但对线粒体中3-MST生成的硫化氢研究较少,而后者也有大量的硫化氢生成,因此本研究于2017年10月至2018年12月探讨内源性硫化氢来源之一——3-MST产生的硫化氢对血管张力的影响以及对缺氧损伤的血管内皮细胞是否具有保护作用。
1 材料与方法
1.1 材料血栓素A2受体激动剂U46619(美国Sigma公司,批号0481065);硫基丙酮酸二水合物(3-mercaptopyruvate,3MP)(美国Sigma公司,批号90374);天门冬氨酸(L-aspartic acid,ASP)(北京Solarbio公司,批号506B041);5-氨基-3-(4-吗啉基)-1,2,3-恶二唑鎓盐酸盐(SIN-1)(阿拉丁,批号C1828094);乙酰胆碱(acetylcholine)(源叶生物公司,批号M20A9K68269);3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)(西陇化工厂);H2DCFH-DA检测试剂盒(碧云天公司);Krebs Henseleit缓冲液(分别含氯化钠119 mmol/L,氯化钙2.5 mmol/L,氯化钾4.7 mmol/L,碳酸氢钠15 mmol/L,硫酸镁1.17 mmol/L,磷酸二氢钾1.18 mmol/L,葡萄糖5.5 mmol/L,调节PH至7.4)。
1.2 方法
1.2.1 血管环的制备和内皮完整性的检测[7]SD大鼠60只,雌雄各半,7~8周龄,200~220 g,购于安徽医科大学实验动物中心,医学实验动物合格证号与使用许可证号均为SCXK(皖)2017-001。本研究符合一般动物实验伦理学原则。称重,记录水合氯醛剂量(10%,0.3 mL/100 g);腹腔注射,麻醉;麻醉后,取脑,放置于4℃的Krebs Henseleit缓冲液中,该液通入95%氧气和5%二氧化碳;显微镜下,分离基底动脉,再制成3 mm的血管环,并且把血管固定在张力传感器的浴槽内;浴槽中有盛有5 mL Krebs Henseleit缓冲液(PH为7.4),37℃恒温并且持续不断的通入95%氧气和5%二氧化碳的混合气体。张力仪调零平衡后,再次调整,给予血管环预负荷张力2 mN,待血管稳定,用100 nmol/L的U46619收缩血管环10 min,再用10 nmol/L乙酰胆碱舒张血管,检测内皮完整。如果血管舒张率高于80%,那么,认为内皮完整;如果血管舒张率低于20%,即认为去除内皮。
1.2.2 观察3-MST底物3MP和抑制剂ASP对U46619预收缩的血管环的影响 将内皮完整的SD大鼠脑基底动脉血管按随机数字表法分为:Krebs Henseleit缓冲液对照组、3MP组、ASP组、SIN-1组、ASP+SIN-1组及3MP+SIN-1组,共6组。血管平衡后,用10-7mol/L U46619收缩血管稳定后,观察3MP和ASP在1×10-5.5~1×10-3mol/L范围内和SIN-1在1×10-7~1×10-3.5mol/L范围内对血管的舒张作用。以加入1×10-7mol/L U46619诱发的收缩张力为100%,按照下列各式计算ASP等的血管舒张百分率。舒张百分率=(U46619诱导的收缩张力-加ASP等后收缩张力)/U46619诱导的收缩张力×100%。再制备一批去内皮血管环,检测SIN-1对U46619预收缩的去内皮血管环的影响。
1.2.3 血管内腔灌注液中硫化氢含量的测定 各组血管实验结束,收集灌注液。取0.1 mL灌注液,根据试剂盒说明操作,按顺序加入各个试剂(蒸馏水、醋酸锌、硫酸铁铵等),室温静置20 min后,波长调为665 nm,用紫外分光光度计检测,记录各组的吸光度值(A665)。用硫氢化钠制备硫化氢标准曲线,计算各组硫化氢的含量。
1.2.4 原代培养大鼠脑血管内皮细胞 取大鼠6只,麻醉,用75%乙醇消毒2 min。将大鼠放在无菌操作台上,注射用0.9%氯化钠溶液进行心脏灌流,无菌状态下断头取脑,置于显微镜下小心剥离脑血管,用无菌磷酸缓冲盐溶液(PBS)涮洗2遍,将血管转移至预先加有胶原酶Ⅱ(工作浓度为2 mg/mL)的EP管中,用眼科剪将脑血管反复剪碎后,37℃消化30 min,消化后离心,保留沉淀。给予培养液培养;1~3 h后换液,目的是把悬浮的细胞和组织碎块去除,之后根据细胞状态,3~5 d再次换液。等到80%细胞融合,传代,进行实验。
1.2.5 实验分组以及内皮细胞缺氧损伤模型的建立 将铺满单层且生长状态良好的内皮细胞按随机数字表法分为6组,对照组,模型组,3MP组,ASP组,SIN-1组,3MP+SIN-1组;除对照组以外,其他5组进行缺氧处理,即将细胞置于37℃,95%氮气、5%二氧化碳的厌氧室中,厌氧室中的氧气浓度用氧传感器监测且维持在低于1%,急性缺氧4 h。
1.2.6 ASP、3MP及SIN-1对内皮细胞活力的影响按照“1.2.5”分组,检测细胞生存率。缺氧4 h后,每孔加入20 μL MTT(5 mg/mL),于37 ℃,5%二氧化碳避光孵育4 h,吸弃上清液,加入150 μL二甲基亚砜(DMSO),震摇10 min。于490 nm波长,用酶标仪检测吸光度,重复3次。
1.2.7 3-MST活性对内皮细胞培养上清中乳酸脱氢酶(LDH)的影响 将细胞按照“1.2.5”分组,缺氧后,收集培养液上清,测定LDH水平。LDH含量用二硝基苯肼法测定,反应完成后,溶液显红棕色,按照朗伯比尔定律(Lambert-Beer law),可比色得到酶活力。
1.2.8 3-MST对内皮细胞活性氧的影响 采用H2DCFH-DA荧光探针,检测细胞内活性氧,细胞种板后,细胞生长至70%时用无血清的DMEM饥饿24 h,处于同一生长周期后,按照“1.2.5”分组给药,缺氧4 h,加入H2DCFH-DA荧光探针后,37℃避光孵育30 min后,荧光显微镜下观察细胞内活性氧情况。
1.3 统计学方法 采用Graphpad 6软件对实验数据进行分析,所有数据均以xˉ±s表示。两组间比较采用成组t检验;多组之间比较用单因素方差分析(one-way ANOVA),组间两两比较用SNK法。P<0.05时,认为差异有统计学意义。
2 结果
2.1 ASP、3MP对U46619预收缩的血管环的影响如表1所示,与对照组相比,3-MST抑制剂ASP对U46619预收缩的血管环差异无统计学意义(P>0.05);3-MST底物3MP(1×10-5.5~1×10-3mol/L)可使U46619预收缩的血管环舒张,最大效应(Emax)为(25.36±0.81)%。与对照组相比,差异有统计学意义(P<0.05)。

表1 梯度浓度的ASP、3MP对血管张力的影响(n=6)
2.2 SIN-1对U46619预收缩内皮完整和去内皮血管环的影响如表2所示,3-MST激动剂SIN-1(1×10-4.5~1×10-3.5mol/L)能够舒张大鼠脑基底动脉环(P<0.05),并且具有浓度依赖性,其引起50%最大效应浓度(EC50)为(10-4.63±100.058)mol/L,Emax为(94.67±3.99)%;与内皮完整动脉环(+Endo)相比,SIN-1在1×10-4.5,1×10-4mol/L浓度下,去内皮动脉环(-Endo)对SIN-1的敏感度降低,但与对照组比较依然差异有统计学意义(P<0.05),EC50为(10-4.073±100.059)mol/L,Emax为(102.50±5.51)%,甚至超过在内皮完整动脉环上的Emax。

表2 梯度浓度的SIN-1对内皮完整/去内皮血管环的影响(n=6)
2.3 ASP、3MP对SIN-1舒张血管的影响如表3所示,SIN-1的 EC50为(10-4.63± 100.058)mol/L,Emax为(99.49±6.46)%。与单用SIN-1组比较,ASP+SIN-1组能够减弱SIN-1舒张血管作用,EC50升高至(10-3.886±100.622)mol/L,Emax为(95.56±9.62)%,差异有统计学意义(P<0.05);而3MP+SIN-1组能够增强SIN-1舒张血管的作用,EC50降至(10-5.586±100.1003)mol/L,Emax为(111.49±9.62)%,差异有统计学意义(P<0.05)。

表3 ASP、3MP对SIN-1舒张血管的影响(n=6)
2.4 3MP、SIN-1及ASP等对血管内腔灌注液中硫化氢含量的影响结果如图1,大鼠基底动脉在用U46619收缩后(对照组)就有(40.87±4.83)μmol硫化氢的产生,与对照组比较,3MP(1×10-5mol/L)组硫化氢的含量(51.19±2.45)μmol增加,差异有统计学意义(P<0.01),SIN-1(1×10-3.5mol/L)组硫化氢的含量(80.39±3.09)μmol增加(P<0.01),而单独用ASP(1×10-3mol/L)组硫化氢的含量(36.77±1.88)μmol没有影响(P>0.05)。与单用SIN-1组比较,ASP+SIN-1组硫化氢含量(69.25±2.26)μmol降低(P<0.01),3MP+SIN-1组硫化氢含量(90.09±5.36)μmol升高,差异有统计学意义(P<0.01)。
2.5 3MP、SIN-1及ASP对内皮细胞活力的影响结果如图2所示,与对照组比较,模型组MTT染色可见细胞活力(56.75±1.59)%降低(P<0.01)。与模型组相比,3MP组细胞活力(66.05±3.07)%增加,差异有统计学意义(P<0.05),SIN-1组细胞的活力(66.89±4.46)%也增加(P<0.05),3MP+SIN-1组更加提高了细胞活力(75.41±6.81)%,差异有统计学意义(P<0.05),而ASP组细胞活力(48.40±3.13)%下降(P<0.05)。
2.6 3MP、SIN-1及ASP对内皮细胞培养上清液中LDH的影响如表4所示,与对照组比较,模型组培养液中LDH升高(P<0.01),表明缺氧所致血管内皮细胞损伤引起LDH漏出增多;与模型组相比,单独使用3MP和SIN-1,能使内皮细胞上清液中LDH下降(P<0.01);3MP+SIN-1组,LDH水平下降(P<0.01);使用ASP,上清液中LDH有所升高(P<0.01)。

图1 ASP、3MP及SIN-1对灌注液中硫化氢含量的影响

图2 MP、SIN-1及ASP对内皮细胞活力的影响

表4 各组细胞培养液中LDH含量比较
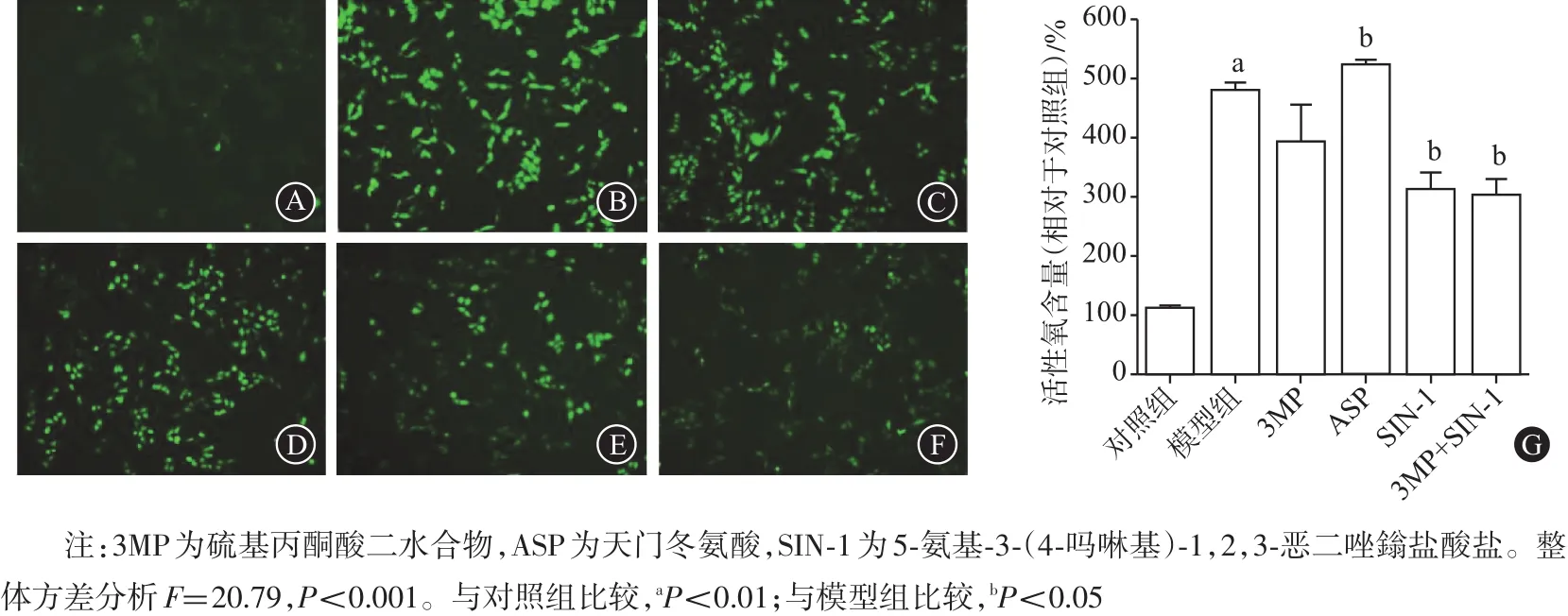
图3 3MP、SIN-1及ASP对细胞内活性氧的影响(H2DCFH-DA荧光探针×200)(n=3):A为对照组,B为模型组,C为3MP组,D为ASP组,E为SIN-1组,F为3MP+SIN-1组,G为量化图
2.7 3MP、SIN-1及ASP对细胞内活性氧含量的影响如图3所示,与对照组相比,模型组活性氧水平(487.5±19.48)%明显升高(F=21.54,P<0.01);与模型组比较,SIN-1组活性氧水平(310.18±42.80)%降低(P<0.05),3MP+SIN-1组活性氧水平(300.18±40.01)%降低(P<0.05);但是 3MP组(390.30±92.72)%和ASP组(520.87±14.82)%对活性氧水平影响小,差异无统计学意义(P>0.05)。
3 讨论
脑血管疾病是致死的重要原因之一[7]。对于脑缺血疾病,脑血管的自我调节对于保护大脑是具有重要意义的[8]。有研究表明,外源性新型硫化氢供体GYY4137能够减轻大鼠肾缺血损伤[9]。近年来,证实了硫化氢是一种重要的内源性的气体[9],并具有广泛的生理功能,如硫化氢参与调解血管舒张与收缩[10-12]、细胞的增殖和凋亡、脑保护等[13]。而在冠状动脉中,3-MST依赖3-MP产生内源性的硫化氢,进一步支持了3-MST是硫化氢的重要来源的观点[14]。而且,据报道,3-MST在血管内皮细胞[15],星形胶质细胞[16]和神经元[17]等都有表达。
在此基础上,本研究通过运用3-MST的抑制剂ASP,底物3MP和激动剂SIN-1探讨3-MST生成的硫化氢对血管舒张是否有作用以及能否保护脑血管内皮细胞,结果提示对于血管舒缩来说,3-MST底物3MP能够促进血管舒张,3-MST激动剂SIN-1对大鼠基底动脉有浓度依赖性的舒张作用,而ASP虽然有引起血管收缩的趋向,可是差异无统计学意义;ASP能够减弱SIN-1舒血管作用,3MP能够增强SIN-1舒血管作用。血管环灌注液中硫化氢含量同样表明,3MP和SIN-1能够增加硫化氢的生成量,并且3MP和SIN-1有协同作用,而ASP能够抑制SIN-1的作用,这与上述血管舒张作用的结果是一致的,进一步说明了3-MST生成的硫化氢参与了舒张脑基底动脉血管作用。
本研究进一步发现,SIN-1对内皮完整血管的舒张效应胜过去内皮血管,提示3-MST产生的硫化氢介导的舒血管作用有内皮依赖性机制的参与,也就是说,内皮细胞可以通过3-MST来产生释放硫化氢,舒张大鼠脑血管。因此,我们检测了3-MST的活性对内皮细胞的影响。内皮细胞缺氧损伤后,通过测定细胞活性、LDH漏出和活性氧的含量来反应细胞损伤程度。结果提示,3-MST的活性能够明显影响到内皮细胞的活力,加入ASP能够降低细胞活力,而使用3MP,SIN-1能够增加细胞活力,减少LDH漏出,减少细胞中活性氧的水平,保护线粒体。结果表明,3-MST产生的硫化氢对于缺氧的内皮细胞具有保护作用。
综上所述,3-MST可催化硫化氢的生成,对脑基底动脉有舒张作用而且能够保护缺氧损伤的脑血管内皮细胞。
