覆盖和埋置白三叶对黄土高原苹果园土壤细菌多样性的影响
2019-12-11马震珠魏倩倩李尚玮杨文权寇建村
马震珠,魏倩倩,李尚玮,杨文权,寇建村
(1.西北农林科技大学 草业与草原学院,陕西 杨凌712100;2.西北农林科技大学 生命科学学院,陕西 杨凌712100)
中国是世界苹果生产第一大国,据联合国粮农组织统计,2017中国苹果产区面积达2.22×105hm2,占世界苹果产区总面积的45%[1]。黄土高原位居中国苹果生产四大产区之首,且近几年种植面积还在不断扩大,是中国苹果产业的主力[2]。但许多果园建于干旱少雨、土壤瘠薄的高原沟壑地带,土壤有机质含量偏低、土壤稳定供水供肥能力较低[3],加之近几年农村产业结构的调整,传统有机肥减少而商品有机肥成本较高,导致苹果生产主要依赖化肥。而化肥的过量施用不但使肥料利用率降低,还造成了果园土壤和苹果质量的下降以及环境污染等问题[4-5]。在一些发达国家,普遍采用果园生草模式,近些年在中国也大力推广[6]。因为果园生草不仅可以提高土壤保水能力、减少水土流失、环境污染,还可以通过牧草降解改善果园土壤质量,提高土壤有机质,为果园提供稳定的有机肥源[7-8]。
土壤中的微生物是整个土壤生态系统里最为活跃的组成,对土壤质量,肥力功能以及可持续发展都存在着不容忽视的作用[9]。土壤细菌约占土壤微生物的70%~90%[10],它们直接参与土壤中有机质的分解、合成等各项生物循环[11]。对土壤细菌的传统研究是通过室内培养来进行的,但土壤中存在许多不可培养的细菌,因此传统研究下得到的土壤细菌信息量较少。高通量测序是目前使用广泛的现代生物技术之一,尤其在土壤微生物的相关研究中运用较多,采用此种技术不用像传统手段一样依赖细菌的分离培养,从环境中即可获取基因信息,能够快速、高效、准确且全面地反映土壤细菌多样性的真实情况[12]。
植物残体回归土壤会引起土壤生态以及肥力变化,这些变化必然对土壤细菌产生影响,这类研究多见于森林及农田生态系统[13-14]。有关果园白三叶返还苹果园土壤对细菌多样性的研究未见报道,本研究将苹果园白三叶分别以覆盖和埋置两种方式返园,探究在不同降解时期果园土壤细菌多样性的变化,以期为白三叶在果园中更好的利用及果园生草模式的推广提供一定的理论依据。
1 材料与方法
1.1 试验地概况
试验地选自陕西省延安市洛川县无公害苹果示范园,该地区地处东经109°13′,北纬35°26′。该地区位于黄土高原腹地海拔1 100 m,气候属于暖温带半湿润半干旱大陆性季风气候,年平均气温9.2°C,年平均降水622 mm,降水主要集中在5—9月,全年无霜期167 d。日照时数达2 448.6 h,日照充足,昼夜温差大。土壤为黑垆土,质地为中壤,土层深厚。试验区地势、地貌、土质等自然条件一致,试验果园种植半矮化红富士,采用旱作耕作模式。
1.2 试验设计
2014年5月27日,将苹果树行间的白三叶刈割后分装于20 cm×20 cm 的尼龙袋中,每袋装新鲜茎叶200 g。在果树行间等距离挖深40 cm 宽30 cm 的沟,将挖出土壤均匀混合,备用。试验设2 个处理。(1)覆盖。将备用土壤分装于30 cm×30 cm×40 cm的软塑料盆中,放入沟内,与地面持平,将装有白三叶的尼龙袋覆盖于花盆土壤表面,压平;
(2)埋置。在容器内装入15~20 cm 备用土,将装有白三叶的尼龙袋平放至上层,压平,覆土至装满容器,容器顶端与地面持平。对照组不放白三叶,仅用备用土装满容器。每个处理5次重复。
1.3 土壤样品采集
在白三叶降解1,3,6和12个月分别时采集土壤样品。采样时,将容器内土壤混合均匀,去除杂质,采用四分法留取土样。部分装入铝盒内用于土壤含水量测定,其余部分过20目筛、混合均匀后密封,储存于-80 ℃冰箱内备用。
1.4 土壤微生物总DNA 提取及检测
称取1 g 土样,使用E.Z.N.A.土壤基因组DNA 试剂盒(Omega公司,美国)按试剂盒操作说明,进行土壤微生物总基因组DNA 提取和纯化。采用紫外分光光度计法检测DNA 浓度及纯度,用0.8%琼脂糖凝胶电泳检测DNA 样品的完整性。
1.5 PCR扩增及产物纯化
以20 ng DNA 为模板,使用引物:515F(5-GTGCCAGCMGCCGCGGTAA-3)和806R(5-GGACTACVSGGGTATCTAAT-3)扩增土壤细菌16S r DNA上的V4 高度可变区。聚合酶链反应(polymerase chain reaction,PCR)扩 增 条 件 为:98 ℃5min;98 ℃30 s,50 ℃30 s,72 ℃30 s,27 个循环;72 ℃延伸5 min。完成PCR 扩增后,对产物进行检测,合格产物用AxyPrep DNA 凝胶回收试剂盒(Axygen公司,美国)进行切胶回收,并做纯化。另外,通过PCR 向16S rDNA 的PCR 产物末端加上带有Index 的接头,以便进行NGS测序。
所有数据均录入SPSS19.0统计学软件进行分析,计量资料以均数±标准差,采用t检验,以p<0.05表示差异有统计学意义。
1.6 文库质检及定量
使用Agilent 2100 生物分析仪(Agilent Technologies,Palo Alto,CA,USA)检测文库质量,通过Qubit2.0 Fluorometer(Invitrogen,Carlsbad,CA)检测文库浓度。DNA 文库混合后,使用Illumina MiSeq平台进行测序。
1.7 数据分析
双端测序得到的正反向reads首先进行两两组装连接,过滤拼接结果中含N 的序列,保留序列长度大于200 bp的序列。经过质量过滤,去除嵌合体序列,最终得到的序列用于操作分类单元即OTU(operational taxonomic units)分析,使用Qiime(1.9.1)软件RDP classifier贝叶斯算法对97%相似水平的OTU 代表序列进行分类学分析,比对参考数据库,在各个水平统计每个样本的群落组成。
用R 语言软件生成不同分类水平上的物种分布图,并将属水平下TOP 20 物种丰度绘制为聚类热图。基于OTU 分析结果,统计不同分组共有和特有的OTU,绘制韦恩图。根据OTU 列表中的各样品物种丰度信息,应用Qiime中的alpha_diversity.py命令计算Shannon,ACE及Chao1等指数,并作稀释曲线。基于Brary-Curtis样本间距离矩阵用R 语言软件进行PCA 分析并做图。
2 结果与分析
2.1 测序结果及土壤菌群多样性分析
OTU(operational taxonomic units)即操作分类单元,是在群体遗传学研究中,为了便于分析,人为设置的分类统一标志,通常在97%的相似水平下对所有序列进行OTU 划分。本试验中不同时期采集的各样本OTU 数如表1所示。
本试验中12个样本随着有效序列数的增加均表现为先快速增长,然后增速变缓,说明所有样本的物种组成比较均匀。此外,当有效序列数达到5 000时,增速趋于平缓,所有样本的有效序列数目均超过5 000(见图1),说明测序数据量已经足以真实反映样品中所有的物种组成。

表1 测序获得的土壤细菌OTU 数
2.2 土壤细菌OTU 概况
分别在不同降解时期,对土壤细菌OTU 进行对比分析。结果发现,在降解1,3,6,12 个月时,对照(CK)土壤细菌特有的OTU 数量分别为123,159,95,65,覆草处理(CG)特有的OTU 数量分别为131,102,90,171,埋草处理(BG)特有的OTU 数量分别为175,158,160,120(见图1)。分析比对各处理在不同降解时期特有的OTU,发现对照、覆草处理和埋草处理中分别有338,324和378个不同降解时间特有的OTU,分别占不同处理特有OTU 的76%,66%,62%(见图2)。

图1 不同返园方式下土壤细菌群落OUT的韦恩图
通过对不同降解时间特有OTU 对应物种的丰度分析发现,特有OTU 对应的土壤菌群在门水平上主要有以下几种:厚壁菌门(Firmicutes)、浮霉菌门(Planctomycetes)、芽 单 胞 菌 门(Gemmatimonadetes)、变 形 菌 门 (Proteobacteria)、酸 杆 菌 门(Acidobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、蓝细菌门(Cyanobacteria)以 及 疣 微 菌 门(Verrucomicrobia)(见表2)。值得注意的是,覆草降解一个月时,其土样菌群中还存在一定量的梭杆菌门(Fusobacteria),而相同降解时间下的埋草处理和对照组中则未出现;埋草处理在降解1,3,12个月时土样中均有广古菌门(Euryarchaeota),且降解1 个月时还有泉古菌门(Crenarchaeota)。另外,在覆草和埋草处理中增加了硝化螺旋菌门(Nitrospira)和螺旋体门(Spirochaetes)。

表2 各处理在不同降解时间特有物种门水平分布 %

图2 不同返园方式特有的OTU 在不同降解时期土壤细菌群落的韦恩图
2.3 土壤细菌群落多样性
ACE指数和Chao1指数是在生态学中估计物种总数的两种常用指数,均由Chao最早提出[15],两种指数算法有所不同,但都能够用来估计群落中OTU数目,反映菌群丰度。ACE 和Chao1 指数越大则表示土壤菌群丰度越高。在本试验中降解1,3,6,12个月时,覆草和埋草的Chao1和ACE指数均高于对照。在降解1个月和3个月时,埋草处理的ACE 指数高于覆草处理,然而在降解6个月和12个月时,埋草处理的ACE 指数则低于覆草处理(见表3)。Shannon指数[16]用来估算样本中的微生物多样性。覆草和埋草处理的Shannon指数均高于对照,且埋草的Shannon指数比覆草的高(见表3)。
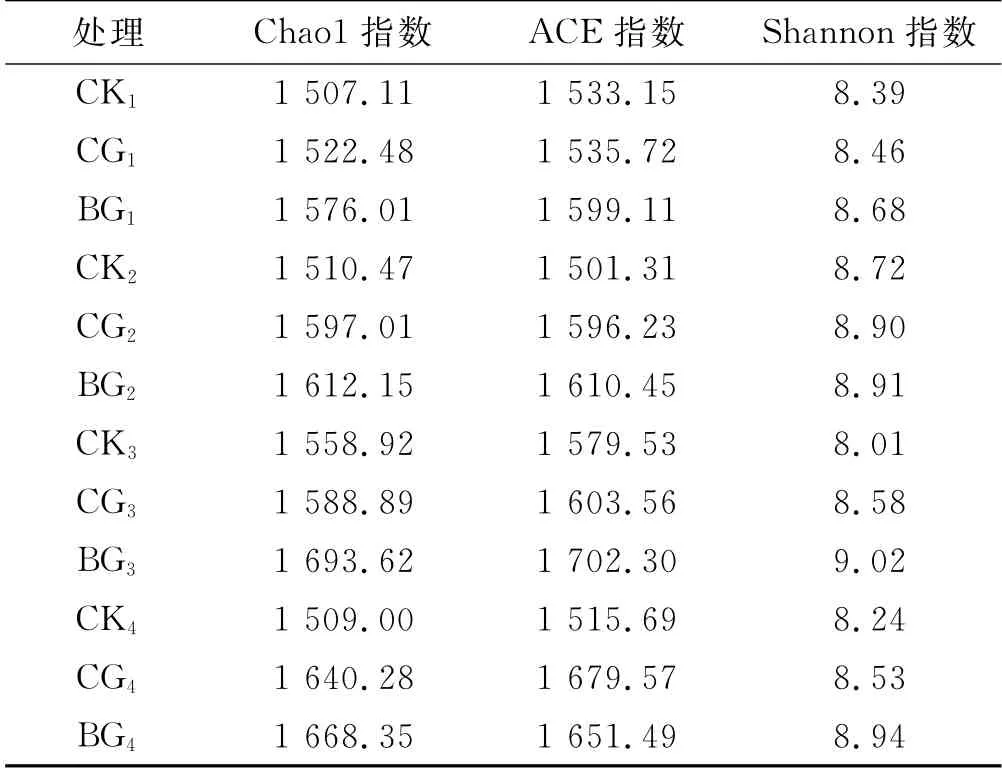
表3 土壤细菌丰富度和多样性指数
2.4 土壤细菌群落物种丰度
本试验对所有样本在不同分类水平下的土壤菌群丰度进行了分析。从门水平来看,共有22种细菌被检出,其中丰度较高的菌群有厚壁菌门(Firmicutes)、酸杆菌门(Acidobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、蓝 细 菌(Cyanobacteria)及 浮 菌 门(Planctomycetes)(见表4)。在不同处理下土壤主要菌群丰度存在差异,和对照相比,覆草和埋草处理的厚壁菌丰度降低;拟杆菌、蓝细菌和变形菌丰度增高,且覆草处理高于埋草处理;埋草处理浮霉菌丰度增加。
2.5 土壤细菌群落物种结构
将属水平TOP 20的物种分布绘制为聚类热图(见图3),通过颜色差异可直观显示菌群的相似性和差异性,图中由灰到黑代表菌群丰度由高到低。横向为样本分组聚类树,不同分解时间分为两类,降解1个月和3个月的所有样本归为一类,6个月和12个月归为一类。纵向为物种聚类树,TPO 20菌群被分为4 类,聚类Ⅰ由分支杆菌属(Mycobɑcterium)、马赛菌属(Mɑssiliɑ)、假单胞菌属(Pseudomonɑs)、节杆菌属(Arthrobɑcter)、乳球菌属(Lɑctococcus)以及(Solirubrobɑcte)组成;聚类Ⅱ由芽单胞菌属(Gemmɑtimonɑs)、Opitutu、黄 杆 菌 属(Flɑvobɑcterium)和Arenimonɑs组成;聚类Ⅲ由硝化螺旋菌属(Nitrospirɑ)、奈瑟菌属(Neisseriɑ)、Pirellulɑ 和Steroidobɑcter 组 成;聚 类Ⅳ由 鞘 氨 醇 单 胞 菌 属(Sphingomonɑs)、溶杆菌属(Lysobɑcter)、珊瑚球菌属(Corɑllococcus)、Flɑvisolibɑcte、Adhɑeribɑcter 及Skermɑnellɑ 组成。
不同物种聚类的菌群丰度在不同降解时间存在差异,聚类Ⅰ在降解1个月、6个月和12个月时菌群丰度高,而3个月时其丰度低;聚类Ⅱ细菌的丰度随着降解时间的增加而增加;聚类Ⅲ细菌在降解前期(1个月和3个月)丰度高,而降解后期(6 个月和12 个月)降低;聚类Ⅳ细菌在降解1个月时丰度最高。

表4 土壤细菌门水平菌群丰度 %

图3 土壤细菌丰度前20个属的聚类热图
2.6 土壤细菌群落主成分分析
本试验对TOP 20菌群分布进行了主成分分析(见图4)。结果表明,各处理多数样本点分别集中到坐标图的不同位置,说明不同处理下的土壤细菌结构存在差异。从降解时间来看,降解1个月和3个月时的样本点分别聚集,降解6个月和12个月的样本点聚集到了一起。有9个属的土壤菌群对PC1(第一主成分)贡献较大(负载的绝对值大于0.2),主要来自变形菌门和放线菌门,有12 个属对PC2(第二主成分)贡献较大,主要来自变形菌门和拟杆菌门。

图4 土壤细菌群落丰度前20属主成分分析
3 讨论
3.1 白三叶降解对土壤微生物群落结构的影响
白三叶返园未对土壤微生物优势菌群种类产生显著影响,不同处理组与对照间共有OTU 较多,但优势菌群的丰度在对照与两种返园处理组间均存在显著差异,并且出现了一些特有OTU,说明白三叶的两种返园方式均对土壤细菌群落结构产生了影响,这一结果与之前一些其他外源有机物返园研究结果一致[17]。白三叶返园后土壤中出现了梭杆菌门、广古菌门、泉古菌门、螺旋体门和硝化螺旋菌门,说明这些菌与白三叶的降解高度相关。
两种返园方式下特有OTU 分散在不同降解时间,同一时期重叠较少,推测这些菌群可能参与白三叶降解的不同过程。植物残体在土壤中的分解转化在不同时期的化学结构存在较大的差异,降解前期主要分解一些容易被微生物代谢利用的碳水化合物,后期则是一些诸如木质素、单宁等较难分解的物质,这也是菌群在不同时期结构有所不同的主要原因[18]。同时,覆草和埋草处理会对土壤环境造成一些影响,水分、温度以及光照等因素也会对微生物的生长和有机物降解产生影响,对土壤肥力而言此类影响通常都是积极的[19]。不同降解时期不同菌群的增加,有助于果园各种植物残体的分解利用。植物残体是有机质的重要来源[20],植物残体的分解速率决定着生态系统中各类养分循环的效率,对土壤养分有效性的高低有着重要影响[21],因此,通过菌群变化可以判断覆草和埋草均有利于果园土壤养分的积累和有效利用。
3.2 白三叶降解对土壤微生物群落物种分布及其丰度的影响
在苹果园覆盖或埋置白三叶对土壤细菌群落分布存在显著影响,且不同降解时期存在差异。在两种返园处理组中酸杆菌、拟杆菌、变形菌等细菌丰度提高。酸杆菌是土壤中一类重要的细菌类群,占土壤细菌总量的20%左右[22],酸杆菌和拟杆菌门具有纤维素降解功能[23],酸杆菌相对丰度与多糖含量、土壤理化性质及肥力状况密切相关[24]变形菌门是一种重要的固氮菌,其大多数细菌在土壤氮素循环、去磷以及有机物降解中有着重要的功能[25]。白三叶返园使得这些有益菌增多,说明两种返园方式均可通过提高土壤有益细菌丰度,促进土壤有机质的积累和转化,培肥地力,优化土壤理化性质。一些研究发现厚壁菌门细菌能够促进植物残体分解,增强土壤肥力[26]。但在本研究中,白三叶返园后厚壁菌门丰度却低于对照,这可能是由于植物残体的种类、大小以及在土壤中位置的不同造成的[27],此外,环境以及气候条件等综合因素也会影响微生物群落丰度[28]。
本研究发现在不同降解时期,属水平TOP 20细菌丰度存在明显差异,即随着白三叶降解时间增加,芽单胞菌、黄 杆 菌、Opitutu 和Arenimonɑs 属 的 细 菌丰度增高,而硝化螺旋菌属、奈瑟菌属、Pirellulɑ 和Steroidobɑcter 的相对丰度降低。焦奎宝[29]研究表明,土壤硝化螺旋菌的丰度与有机物含量有关。因此,白三叶随着降解时间增长养分释放量逐渐减少是造成这一现象的主要原因。此外,鞘氨醇单胞菌属、溶杆菌属、珊瑚球菌属、Flɑvisolibɑcte,Adhɑeribɑcter和Skermɑnell等菌群均大量存在于降解前期,可能与该时期土壤中存在易于降解的物质以及前期降解过程中释放出的大量可溶物质有关[30]。
4 结论
(1)白三叶覆盖和埋置返园处理下,苹果园土壤微生物优势菌群种类未表现出显著变化,丰度存在差异。返园处理组土壤中出现梭杆菌门、广古菌门、泉古菌门、螺旋体门和硝化螺旋菌门等特有菌群,分散于不同降解时期,与白三叶降解过程高度相关。
(2)白三叶覆盖和埋置返园,对苹果园土壤细菌群落分布存在显著影响,且不同降解时期存在差异,在两种返园处理组中酸杆菌、拟杆菌、变形菌等细菌丰度增高,厚壁菌门丰度降低。
(3)随着白三叶降解时间增加,芽单胞菌、黄杆菌、Opitutu和Arenimonɑs 属的细菌丰度增高,硝化螺旋菌属、奈瑟菌属、Pirellulɑ 和Steroidobɑcter 的相对丰度降低;鞘氨醇单胞菌属、溶杆菌属、珊瑚球菌属,Flɑvisolibɑcte,Adhɑeribɑcter 和Skermɑnell 等菌群均大量存在于降解前期。
