CTSB和bFGF在高氧诱导小鼠视网膜新生血管形成中的表达
2019-12-11石丽洪周国宏王文娟
石丽洪,孔 丽*,周国宏,王文娟
(1山西医科大学基础医学院人体解剖学教研室,太原 030001;2山西省眼科医院泪道病科;*通讯作者,E-mail:183085520@qq.com)
视网膜新生血管形成(retinal neovascularization,RNV)是由多种病因引发的脉络膜新生血管芽穿越Bruch膜并在视网膜色素上皮上、下增殖形成的纤维血管组织,常伴有视网膜下的浆液性渗出乃至出血,是多种眼底疾病,如糖尿病视网膜病变、视网膜静脉阻塞等,导致视功能损害的最主要原因[1]。高氧诱导小鼠是在体研究视网膜新生血管形成机制的主要模型之一[2]。据相关研究显示,RNV形成过程中涉及多种信号分子表达水平改变,如血管内皮生长因子(vascular endothelial growth factor,VEGF)、组织蛋白酶B(cathepsin B,CTSB)、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)[3-5]、白细胞介素8(IL-8)、肿瘤坏死因子(TNF-α)以及单核细胞趋化因子(MCP-1)[6]等。本课题组前期研究表明,CTSB和VEGF在RNV形成过程中可能存在双向调节关系[3]。本研究旨在探讨CTSB和bFGF在高氧诱导小鼠视网膜新生血管形成中的表达以及使用CA-074 Me抑制后二者表达水平的改变。
1 材料与方法
1.1 实验动物分组及处理
7日龄清洁级C57BL/6J小鼠56只,雌雄不限,与母鼠(山西医科大学实验动物中心提供,SCXK(晋)2015-0001)共同饲养。实验条件及实验动物均符合国家科学技术委员会的实验动物管理条例。采用随机数字表法将56只小鼠分为正常对照组、高氧诱导组、DMSO组和CA-074Me组,每组小鼠14只。正常对照组小鼠在普通环境下饲养5 d;高氧诱导组、DMSO组和CA-074Me组在高氧环境中饲养5 d建立氧诱导视网膜病变模型;而后DMSO组和CA-074Me组小鼠玻璃体腔分别注射1 μl DMSO和1 μl CA-074Me,各1次,此时各组小鼠均为12日龄,而后均转于标准环境中培养5 d,为17日龄小鼠。
1.2 主要试剂及仪器
CA-074 Me(美国Biomol公司);CA-074 Me溶于DMSO溶剂中,配制成浓度为100 mg/L的溶液;PrimeScriptTMRT reagent Kit试剂盒和引物合成(日本Takara公司);RNA裂解酶(美国Sigma公司);兔抗鼠CTSB抗体、鼠抗鼠bFGF抗体;辣根过氧化物酶标记羊抗兔IgG二抗;辣根过氧化物酶标记羊抗鼠IgG二抗(美国Santa Cruz公司)。氧体积分数为(75±2)%的密闭氧箱(青岛科凯电子研究所有限公司);PCR仪、离心机(德国Eppendorf公司);多功能数字凝胶成像分析系统(美国Bio-Rad公司)。
1.3 实时荧光定量PCR法检测小鼠视网膜中CTSB和bFGF mRNA表达水平
每组中随机各取7只17日龄小鼠。经颈椎脱臼法处死,摘取双侧眼球,剥离视网膜组织。采用RNA提取剂盒提取小鼠视膜总RNA,按RevertAidTMFirstStrand cDNA Synthesis Kit说明书将RNA逆转录为cDNA,配置PCR反应液,以cDNA为模板分别对CTSB和bFGF进行PCR扩增。CTSB和bFGF基因引物序列(见表1)。反应结束后提取实吋聚合酶链式反应的扩增曲线和熔解曲线数据,以β-actin基因作为内参照,用2-ΔΔCt显示相对表达量。
表1 CTSB和bFGF的引物序列
Table 1 Primer sequences of CTSB and bFGF

基因引物序列 CTSB上游:5′-GGCTTTGACTGCAGGACTTC-3′下游:5′-GACAGGACCAAGGAGAGGTG-3′bFGF上游:5′-AAGTGTGACGTTGACATCCG-3′下游:3′-TCTGCATCCTGTCAGCAATG-5′β-actin上游:5′-AAGTGTGACGTTGACATCCG-3′下游:5′-TCTGCATCCTGTCAGCAATG-3′
1.4 Western blot法检测小鼠视网膜中VEGF和bFGF蛋白表达水平
每组中随机各取17日龄小鼠7只。经颈椎脱臼法处死,摘取双侧眼球,剥离视网膜组织。用裂解液裂解小鼠视网膜,置于1.5 ml Eppendorf管中,超声匀浆,4 ℃ 10 000g离心10 min,取上清,蛋白定量,加入等体积2倍SDS缓冲液,95 ℃煮沸5 min,迅速冰浴,4 ℃ 10 000g离心10 min,收集上清。蛋白经SDS-PAGE电泳法进行分离(VEGF用质量分数8%的分离胶,bFGF用质量分数15%的分离胶),电转印法将电泳条带转移到PVDF膜上,质量分数5%BSA溶液,4 ℃封闭3 h;分别加入兔抗鼠CTSB抗体(1∶1 000稀释)或鼠抗鼠bFGF抗体(1∶1 000稀释),4 ℃孵育过夜,用TBST洗涤,再加入相应二抗(1∶10 000稀释),孵育2 h,洗涤;ECL底物化学发光,显影,定影,扫描。以β-actin为内参,通过Photoshop图像软件分析,以CTSB/β-actin,bFGF/β-actin的比值表示各组组织中CTSB和bFGF蛋白的相对表达量。
1.5 统计学分析
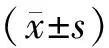
2 结果
2.1 小鼠视网膜中CTSB、bFGF mRNA相对表达水平
正常对照组、高氧诱导组、DMSO组和CA-074Me组小鼠视网膜中bFGF mRNA相对表达量分别为0.67±0.23,21.4±3.07,17.22±2.63和0.96±0.35,各组bFGF mRNA相对表达量总体比较,差异有统计学意义(F=226.89,P=0.000)。正常对照组、高氧诱导组、DMSO组和CA-074Me组小鼠视网膜中CTSB mRNA相对表达量分别为0.26±0.11,9.92±3.30,6.36±4.15和0.48±0.29,各组CTSB mRNA相对表达量总体比较,差异有统计学意义(F=25.23,P<0.05)。与对照组比较,高氧诱导组和DMSO组小鼠视网膜中CTSB和bFGF mRNA的相对表达量均显著升高,差异均有统计学意义(P<0.05)。CA-074Me组小鼠视网膜中CTSB和bFGF mRNA相对表达水平明显低于高氧诱导组(P<0.05)。正常对照组和CA-074Me组比较,高氧诱导组和DMSO组比较,差异均无统计学意义(P>0.05,见图1)。
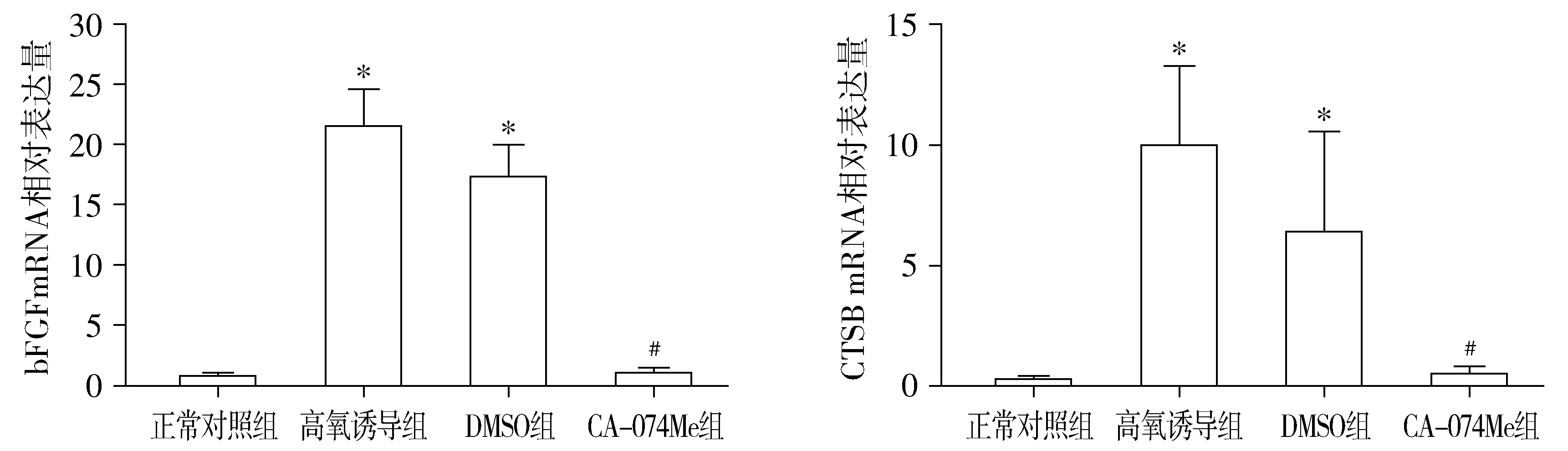
与正常对照组比较,*P<0.05;与高氧诱导组比较,#P<0.05
2.2 小鼠视网膜内bFGF和CTSB蛋白相对表达水平
正常对照组、高氧诱导组、DMSO组和CA-074Me组小鼠视网膜中bFGF蛋白相对表达量分别为0.38±0.02,0.91±0.07,0.95±0.05和0.59±0.08,各组bFGF蛋白相对表达量总体比较,差异有统计学意义(F=121.84,P<0.05)。CTSB蛋白相对表达量分别为0.42±0.07,0.97±0.13,0.97±0.13和0.71±0.12,各组CTSB蛋白相对表达量的总体比较,差异均具有统计学意义(F=30.69,P=0.000)。与对照组比较,高氧诱导组和DMSO组小鼠视网膜中CTSB和bFGF蛋白的相对表达量均显著升高,差异均有统计学意义(P<0.05)。CA-074Me组小鼠视网膜中CTSB和bFGF蛋白相对表达水平明显低于高氧诱导组和DMSO组,差异具有统计学意义(P<0.05)。正常对照组和CA-074Me组比较,高氧诱导组和DMSO组比较,差异均无统计学意义(P>0.05,见图2)。
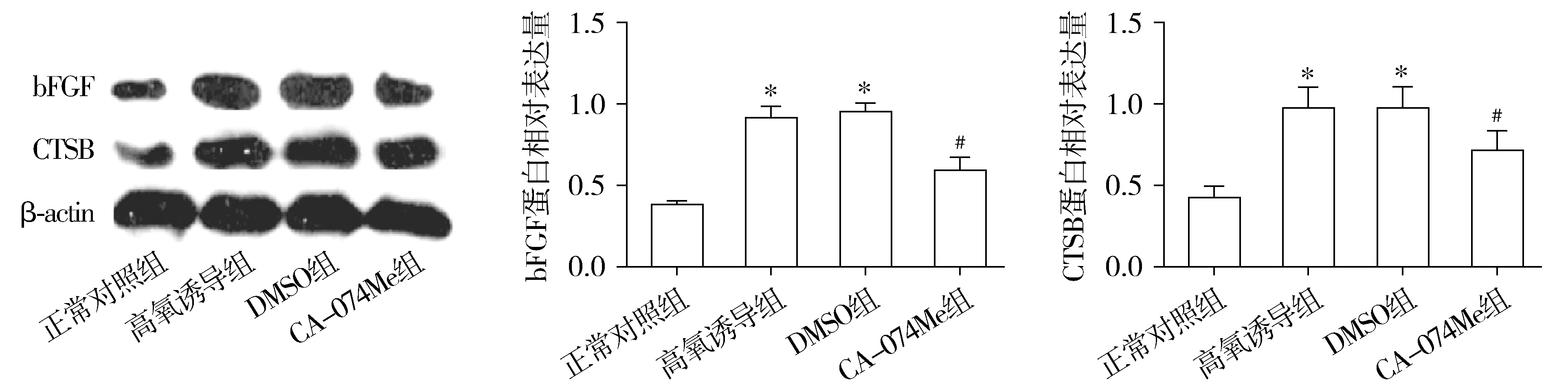
与正常对照组比较,*P<0.05;与高氧诱导组比较,#P<0.05
3 讨论
RNV形成是缺血、缺氧性视网膜疾病发展到终末阶段的特征性表现,如增殖性糖尿病视网膜病变和早产儿视网膜病变[7]。新生血管管壁发育不成熟、基底膜不完整,导致血管内大分子渗漏至组织间隙,进而出现玻璃体和视网膜前、后出血。若反复积血且不能完全吸收,玻璃体腔的血性物质就会发生浓缩、机化、增殖、牵拉,从而引起黄斑水肿,发生部分或完全牵拉性视网膜脱离,进而殃及其邻近组织,继发睫状体、脉络膜脱离等严重并发症[8]。正常眼组织能够维持血管生成的稳定性是基于血管生成刺激因子(如VEGF、bFGF等)和血管生成抑制因子(如色素上皮衍生因子PEDF)共同作用的结果。两者之间关系失衡是促使RNV形成的最主要原因[9]。另外,细胞外基质(ECM)固有成分中的胶原蛋白、弹性蛋白等经酶解后可促进RNV形成[10]。
bFGF也称FGF2,具有促分化、促增殖、营养神经及抑制凋亡等作用。动物试验中,已有研究表明bFGF与VEGF同时注入玻璃体腔视网膜血管病变最重[11]。给青紫蓝兔视网膜下注射bFGF能诱导其视网膜下新生血管形成[12]。bFGF可通过旁分泌和自分泌途径作用于视网膜各层细胞,并促进其他生长因子分泌。在糖尿病视网膜病变发病过程中,局部组织缺血、缺氧导致视网膜细胞bFGF分泌,从而刺激视网膜色素上皮细胞和内皮细胞增殖,导致血管腔狭窄、闭塞,加重视网膜血循环障碍[13]。同时,bFGF能够显著激活炎性反应的一个重要转录因子NF-κB及增加其下游与炎症有关的细胞因子白介素-8(IL-8)和单核细胞趋化蛋白-1(MCP-1)的基因表达,增加血管通透性,利于内皮细胞迁移、增殖[14]。
CTSB是一种半胱氨酸组织蛋白酶,以酶原形式储存于溶酶体中,参与体内多种蛋白的水解。正常情况下,大约10%的酶原被生理性分泌至胞浆。病理状态下,各种原因所致的细胞损伤导致溶酶体膜稳定性降低、通透性增高甚至破裂,大量CTSB释放到胞浆或组织间隙并被激活,介导细胞炎性坏死及凋亡[15]。高氧诱导小鼠模型中CTSB表达水平增加,活性增强,加速ECM降解,使ECM结构改变,还可促进ECM释放bFGF[15]。
CA-074 Me是CTSB的特异性抑制剂,能抑制视网膜新生血管中CTSB的表达[16]。本实验中,高氧诱导小鼠视网膜中CTSB和bFGF表达上调。给小鼠玻璃体腔注射CA-074 Me抑制高氧诱导小鼠视网膜组织中CTSB的表达,此时发现bFGF表达下调。这一机制可能是,CA-074 Me通过抑制CTSB来抑制bFGF的表达;也可能是CA-074 Me直接作用于bFGF,其具体机制需要我们在后期的实验中进一步验证。
