药品与个人护理品生物降解研究进展
2019-12-09程亚楠丁腾达钱毅光李猛李菊英
程亚楠,丁腾达,钱毅光,李猛,李菊英
综 述
李菊英 博士,副教授,深圳大学化学与环境工程学院硕士生导师,深圳市海外高层次B类人才。2014年毕业于浙江大学获理学博士学位,长期从事环境新兴有机污染物在环境介质中的行为与归趋、安全性评价和污染控制技术等研究工作,主持2项国家自然科学基金、1项国家重点研发计划子课题以及多项省市级自然科学基金,在国内外专业学术期刊上共发表相关论文40余篇,现为编委。

药品与个人护理品生物降解研究进展
程亚楠1,丁腾达1,钱毅光1,李猛2,李菊英1
1 深圳大学 化学与环境工程学院,广东 深圳 518055 2 深圳大学 高等研究院,广东 深圳 518060
药品与个人护理品(Pharmaceuticals and personal care products, PPCPs) 包括各种处方药和非处方药(如各类抗生素、人工合成麝香、止痛药、降压药、避孕药、催眠药和减肥药等) 与个人护理用品(如化妆品、香料、遮光剂、发胶、染发剂和杀菌剂等)。作为一类新兴环境微污染物,PPCPs因具有潜在的环境毒理学效应和人体健康风险逐渐受到人们的广泛关注。有关PPCPs的生物降解研究已展开了大量的工作并取得了较大进展。文中总结概括了目前国内外PPCPs生物降解方法、功能菌种类、PPCPs的生物降解特性及产物组成与降解途径等,分析了PPCPs微生物降解机理,并对PPCPs生物降解的研究方向进行了展望。
药品与个人护理品,生物降解,降解途径,功能菌
1 药品与个人护理品(PPCPs)
1.1 PPCPs概述
药品与个人护理用品(Pharmaceutical and personal care products,PPCPs) 作为一类新兴环境微污染物,自1999年由Christian G.Daughton在中首次报道以来逐渐受到科学界和公众的广泛关注[1-2]。PPCPs种类繁多,其中医药品大约有4 500种,广泛用于人类或动物的疾病预防与治疗等领域,主要包括各种处方药和非处方药(如X射线显影剂、咖啡因、抗生素、抗癌药、镇静剂、抗癫痫药、显影剂、止痛药、降压药、避孕药、D-阻滞剂、激素、类固醇、消炎药、催眠药、减肥药、利尿剂等);日常个人护理用品主要包括防晒霜、香料、遮光剂、染发剂、发型定型剂、洗发水、洗涤剂、消毒剂、香皂等一系列化妆品[3]。环境中常见的PPCPs见表1。
1.2 PPCPs的危害及污染分布
PPCPs种类繁多,结构多样,各组分没有共性结构,如激素和活性类固醇没有特异性可对几乎所有生命体产生生物学效应[4]。此外,PPCPs具有较强的环境持留性、生物活性和生物累积性等特征,其长期暴露对环境甚至人体健康可造成一定的潜在危害。例如,三氯生可以干扰硅藻的光合作用和细菌的繁殖[5]。双氯芬酸能够影响虹鳟鱼的生物化学功能,导致其生物组织的损害[6],氟喹诺酮类抗生素可引起.致突变和致癌,表现出很强的遗传毒性[7]。多种PPCPs共存条件下其毒性还可产生叠加效应,每种化合物的毒理效应也可能会得到不同程度的放大[8]。此外,Cheng等[9]研究指出,抗生素的缓慢生物降解性和持久性,可使细菌产生耐药性基因甚至变异为耐药性极强的“超级细菌”。
目前,PPCPs在全世界范围内被大量使用,日常生活中未使用的或过期药品、药品生产废物和医院垃圾等的排放成为环境中PPCPs的直接来源。此外,有研究调查表明,摄入人体或动物体内的药物并不能完全被吸收和利用,高达90%的未代谢或溶解的药物通过粪便和尿液等排泄物进入污水处理系统中[11]。然而,传统污水处理系统并无针对PPCPs等环境有机污染物的专门处理技术,现有技术虽对氮、磷等无机污染物具有较好的去除效果,但对于PPCPs的去除效果欠佳。因此PPCPs在污水处理系统中的低处理效率使其主要通过污水处理厂出水和活性污泥不断释放到环境中,对环境造成不可预估的危害。例如,Ternes等研究发现,卡马西平在污水处理厂中的去除率低于10%,甚至出现出水和污泥中浓度高于进水中浓度的现象[12]。随着环境分析技术的发展,PPCPs已在多种环境介质如水体、土壤、污泥、底泥甚至人体样品中检出,且检出浓度在ng/L至μg/L水平之间[13]。例如,我国的地表水陆续检测出不同种类的PPCPs[14]。Peng等[15]在我国广州珠江流域已检测到多种PPCPs,其中超过60%的水体可以检测到雌二醇,其最大浓度可达65 ng/L,水杨酸、氯丙酸、布洛芬在大多数水体中也可以被检测出,且其最大浓度高达2 098、248、1 417 ng/L。Zhang等[16]在上海市苏州河也检测出ng/L水平的PPCPs。
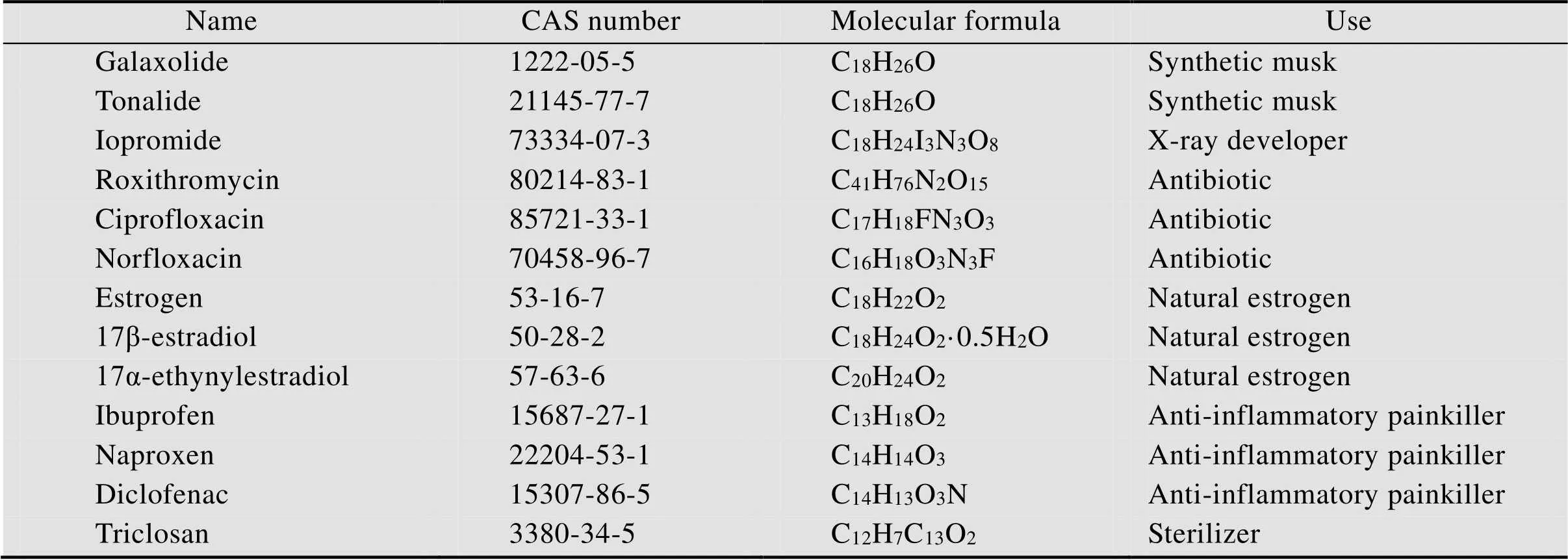
表1 环境中常见的PPCPs[10]
2 PPCPs的生物处理技术
因PPCPs在环境中的持续存在和潜在风险,有关PPCPs在环境中的去除研究显得尤为必要。目前国内外学者通过物理、化学、生物等多种技术研究了PPCPs的去除,物理和化学方法主要集中在混凝、膜分离、氧化和吸附等[17]。混凝法对PPCPs的去除效率因受混凝剂种类和PPCPs结构的变化影响较大而使去除效果具有一定的离散性;膜分离技术目前尚未进行规模化应用,大多停留在实验室水平,同时消毒剂及其连用技术,随消毒剂种类的变化其对PPCPs矿化程度差异大,且可能会产生对环境毒性更大的中间体,这些都需要进一步确定[17];氧化法会向环境中释放多种氧化产物及副产物,其毒性会更高所以氧化法不宜投入到实际工程中[18];吸附法所采用的材料(碳纳米管、活性炭和石墨烯等) 成本较高,导致其不能大规模应用[19]。生物处理技术由于具备环境友好、无二次污染、高效、成本低和操作管理简便等优势广泛应用于PPCPs的去除。
2.1 植物吸收降解
PPCPs的植物吸收、富集和转化是其环境中消减的一种重要途径[20]。Hijosa-Valsero等研究表明,植物的蒸腾作用与PPCPs去除率之间存在显著的正相关(2>0.893)[21]。PPCPs可通过根系吸附在蒸腾作用的驱动下,跨过细胞膜的双分子层进入细胞组织液,随后转运到其他组织器官并在不同组织器官累积,最终实现PPCPs的去除[20,22]。Zhang等[23]研究发现,水葱可通过根系摄取咖啡因和氯贝酸,并将其转运到芽等组织中进一步吸收,其中氯贝酸在根中的浓度为5.4–26.8 μg/g,占初始引入量的6%–13%;在芽中的浓度为7.2–34.6 μg/g,占初始引入量的22%–49%,且植物体内特定的生化酶可使氯贝酸进一步转化为CO2、H2O和Cl2等无机小分子。Zhang等[24]研究结果表明,香蒲的种植可使布洛芬在人工湿地中的去除率提高33%,使萘普生的去除率提高至近2倍。此外,PPCPs的植物修复与植物的种类和植物特性密切相关。阿丹[25]在调查花叶芦竹和再力花湿地对大环内酯类抗生素的去除效果时发现,地下根状茎粗而多结的花叶芦竹湿地对大环内酯类的去除效率可达88%,而再力花湿地仅为73%,表明植物的种类对大环内酯类化合物的去除效果有一定影响。Dordio等[26]有关湿地中阿替洛尔的去除研究指出,香蒲对阿替洛尔的去除效果要优于芦苇,这与香蒲具有发达的地上部分和较高的蒸腾速率有关。而Ranieri等[27]研究发现,对乙酰氨基酚在种植芦苇的水平潜流湿地中的去除效果优于其在种植香蒲的湿地,这可能是由于芦苇的根系体积大,其较大的比表面积更有利于生物膜的形成和对乙酰氨基酚的生物降解。需要指出的是,PPCPs的植物吸收也受污染物自身理化性质的影响。例如Dordio等[28]利用种植香蒲的人工湿地研究其对PPCPs的去除时发现,在种植香蒲的人工湿地对卡马西平和氯丙酸的去除率在夏季时分别为97%和75%。Christofilopoulos等[29]考察盐土植物L.对不同污染物的植物修复能力时发现,L.对初始浓度为50 mg/L的双酚A的去除效率都可高达98%,而对相同初始浓度磺胺甲恶唑的去除效率则仅为61%。
2.2 微生物降解
目前,国内外学者有关PPCPs的微生物降解做了大量的研究,并筛选出许多PPCPs的降解功能菌群,且对其生物降解特性、降解动力学和产物组成与降解途径进行了深入探讨,表2给出了部分PPCPs降解菌和PPCPs降解效率。本文将以使用最为广泛且在环境中检出浓度和频度均较高的几种PPCPs为例重点阐述。
磺胺类抗生素具有成本低和广谱性特点被广泛用于治疗或预防家畜和养牛的传染性疾病[30]。目前科研工作者已分离出一系列降解典型磺胺类药物磺胺甲恶唑的降解菌,如枯草芽孢杆菌、铜绿假单胞菌和马红球菌[31]、微杆菌sp. SMX B24、短波单胞菌sp. SMX B12[32]和嗜冷假单胞菌HA-4[33]。Reis等[34]研究指出,反硝化无色杆菌对磺胺甲恶唑具有一定的降解能力。南极冰藻sp. Tai-03、马红球菌和嗜冷假单胞菌HA-4对磺胺甲恶唑的降解效率分别为20%、29%和34.4%[18,31,33]。Wang等[35]研究发现,不动杆菌sp.在最适条件下,可以在48 h内使95%以上的浓度为5–240 mg/L磺胺甲恶唑发生矿化。白腐真菌变色栓菌由于其优异的污染物降解能力而受到人们的广泛关注。例如,García-Galán等[36]研究发现,当磺胺二甲嘧啶、磺胺吡啶和磺胺噻唑的浓度在7 mg/L以内时,对磺胺二甲嘧啶、磺胺吡啶和磺胺噻唑的去除率均高达100%,且漆酶在三者的转化过程中起着非常重要的作用。谢鹏等[18]研究表明,磺胺吡啶和磺胺甲恶唑在sp. Tai-03作用下可发生降解,在10 mg/L以内的去除率分别为50%和20%。谢鹏等[18]研究表明,环丙沙星和四环素在sp. Tai-03的作用下发生了开环反应,对浓度低于10 mg/L的环丙沙星和四环素的去除率均达到100%。
此外,三氯生作为一种广谱抗菌剂被广泛应用于人们日常生活用品和消费品中,在环境介质中不断被频繁检出,是最重要的环境微污染物之一[37]。目前,环境中三氯生的去除主要采用生物降解。例如,Wang等[38]从污泥中驯化分离出一种黄色透明、革兰氏染色显示细胞呈革兰氏阴性的新菌株sp.,发现sp.可以矿化90%以上的三氯生(<10 mg/L) 及其降解产物。同时,它也可以在少量葡萄糖作为碳源时合成生物质,发生共代谢作用降解三氯生。据报道,甲基杆菌属sp.[39]、鞘氨醇单胞菌sp. strain YL-JM2C[40]、鞘脂单胞菌strain KCY1[41]、恶臭假单胞菌TriRY[42]、产碱杆菌subsp.TR1[42]、新鞘氨醇杆菌sp. TrD22[43]、脱氮嗜脂环物菌[44]嗜麦芽窄食单胞菌[44]和亚硝化单胞菌[45]等菌株具有降解三氯生的能力,其中,strain KCY1可以将三氯生完全转化为中间产物[41],在三氯生初始浓度为5 mg/L时,sp. strain YL-JM2C可使三氯生完全矿化[40]。
扑热息痛(对乙酰氨基苯酚,俗称泰诺) 是世界范围内广泛使用的一种解热镇痛药,是美国最为广泛使用的处方药和非处方药[46],长期暴露会引起肝细胞和肾细胞坏死还可能诱发血小板减少性紫癜或白血病等。de Gusseme等[47]在膜反应器中分离出两株细菌(戴尔福特菌和铜绿假单胞菌),这两株菌都可将对乙酰氨基酚作为碳源,使其开环最终矿化生成二氧化碳和水,其中分别接种1%的两种菌株,48 h内对乙酰氨基酚(1 g/L) 的去除率分别达到97%和40%。Molina等[48]研究表明,革兰氏阳性菌株sp.可降解30%的萘普生,而沙雷氏菌sp.和假单胞菌可使萘普生发生彻底降解,即去除率为100%。
目前,科学家们也分离出了可以降解卡马西平的功能菌群,例如红球菌[49]、黑曲霉[49]、氯氰菊酯降解菌sp. C11[50]、根瘤菌属spC12[50]、假单胞菌属sp.CBZ-4[51]和链霉菌MIPUG 4.89[52]。Gauthier等[9]研究表明,黑曲霉对卡马西平的生物降解速率大于红球菌。Bessa等[50]研究发现,sp. C11与sp. C12对浓度为10 mg/L卡马西平的生物降解率约为30%,Ang等[51]研究指出sp. CBZ-4在144 h内对浓度为 100 mg/L卡马西平的降解效率可以达到46.6%。Popa等[52]研究表明,MIPUG 4.89在添加了5 g/L葡萄糖培养基上发生了共代谢反应,对卡马西平(0.05–8 mg /L) 的降解为35%。Golan-Rozen等[53]研究发现,白腐真菌可将99%的卡马西平去除。
最近的研究指出双酚A的降解细菌群落主要由变形杆菌[54]、细菌[54]、氯仿菌[54]、厚壁菌门Firmicutes[54]、芽单胞菌门Gemmatimonadetes、放线杆菌[54]和芽孢杆菌sp. GZB[55]组成。谢鹏等[18]研究发现,双酚A在sp. Tai-03的作用下发生了开环反应,并且其对 10 mg/L内BPA去除率为100%。Yang等[54]研究表明,在沉积物中变形菌门Proteobacteria,尤其是γ-变形菌和α-变形菌,在双酚A的降解中起主导作用。Li等[55]研究发现芽孢杆菌(sp. GZB) 在好氧和厌氧条件下对双酚A (10 mg/L) 均具有较强的降解能力,其在厌氧条件下可使双酚A彻底降解,在好氧条件下可使51%的双酚A降解。

表2 PPCPs微生物降解种类、去除率和微生物来源
3 生物降解机理
有机污染物的生物降解是微生物通过一系列生物化学反应使有机污染物在好氧或缺氧的条件下改变化学结构,最终实现去除的目的。微生物对有机污染物的降解能力依赖于污染物的生物可降解性和微生物的转化性能[56]。常见的反应有羟基化、甲基化、去甲基化、水解反应等。通常,PPCPs的生物降解过程可以分为3类[56]:1) 生物矿化,即在微生物作用下将PPCPs转化为小分子化合物,最后转化为H2O和CO2;2) 被微生物转化为疏水性降解产物与固相结合留存在环境中;3) 被转化成具有更高亲水性的降解产物残留在水体中。生物降解可能是将毒性高的污染物降解为毒性更低的化合物达到解毒的作用,另一方面,降解产物比母体污染物具有相当甚至更高的生物活性或毒性,产生二次污染,并对生态环境和人体健康造成不可预估的危害,因此,PPCPs的生物降解作用机制(如产物组成、降解途径和产物的活性等) 研究对于系统理解PPCPs的环境行为和合理评估其环境安全性是不可或缺的[57],在进行PPCPs环境风险评价时不可忽视其降解产物的潜在危害。
生物矿化作用可将难降解微污染物彻底降解为CO2和H2O。Wang等[38]从活性污泥中驯化分离出一种可以降解三氯生的新菌种sp. WW1,研究得出该菌种可实现生物脱氯,并将三氯生完全矿化为CO2和H2O,消除其对环境的不良影响。此外,他们检出了三氯生的6种降解产物,在此基础上提出了三氯生的两种生物降解途径:1)sp. WW1可能是先通过引入羟基自由基来攻击三氯生,生成羟基化产物/337,然后通过氧化反应发生间位裂解(-cleavage)环开裂生成两个环裂解产物(/195和/215),随后分别发生脱羰基、脱羟基反应或脱羧反应进一步降解,最终生成CO2和H2O;2)sp. WW1使三氯生发生脱氯反应,在单氧化酶或双氧化酶的作用下使三氯生羟基化,随后发生间位切割环开裂生成环裂解产物/215以及苯醚键水解反应生成1,5-二羟基苯酚,最终生成CO2和H2O,详见图1。

图1 三氯生的生物降解途径[38]
卡马西平是一种在污水废水和污泥中检出率最为频繁的药品之一。本课题组成员Li等[58]采用同位素标记法与HPLC-MS/MS分析联用技术较为系统地研究了卡马西平在土壤中的降解机理,研究结果表明,卡马西平在土壤中的降解主要以微生物降解为主,且土壤原有微生物在卡马西平的彻底矿化过程中发挥了尤为重要的作用,通过LC-MS/MS结构鉴定工作成功解析了卡马西平好氧土壤中的5个降解产物,分别为10,11-二氢-10-羟基卡马西平、环氧卡马西平、N-甲醛吖啶酮、4-乙醛-9-吖啶酮和吖啶,其中,N-甲醛吖啶酮是一种生物降解的代谢中间体,而并非化学降解所致。基于产物信息推断卡马西平在好氧土壤中的降解途径主要为:卡马西平分子的活性位点是C10-C11双键,微生物可通过中间杂环的烯水解和氧化作用生成氧化产物10,11-二氢-10-羟基卡马西平和环氧卡马西平。降解产物10,11-二氢-10-羟基卡马西平也可能为过渡态中间产物环氧卡马西平在酶作用下的下一步产物。卡马西平分子在保持两边的苯环不被破坏的情况下,可通过环氧化作用生成环氧化衍生物,并进一步通过环氧键断键发生缩环重排反应生成N-甲醛吖啶酮。缩环反应可能是频呐醇重排下富电子的杂环发生电子转移和重排将氮杂环庚三烯环转化为苯环结构。发生缩环反应后,进一步发生羰基化和去羰基化反应对应生成4-乙醛-9-吖啶酮和吖啶。这些降解产物在微生物的作用下最终开环矿化,生成二氧化碳和水,详见图2。Golan-Rozen等[53]研究了白腐真菌对卡马西平的生物降解作用机制,研究发现,的过氧化酶(如细胞色素P450酶和锰过氧化物酶) 可将99%的卡马西平去除,且转化为环氧卡马西平。
此外,本课题组成员Li等[59]首次研究了在环境中频繁检出的医药化合物对乙酰氨基酚在好氧土壤的转化规律,实验结果表明,土壤微生物可快速直接降解甚至彻底矿化对乙酰氨基酚,使其矿化率提高6.8倍,对乙酰氨基酚在好氧土壤中的8种降解产物有3-羟基对乙酰氨基酚、氢醌、1,4-苯醌、N-乙酰对苯醌亚氨、对甲氧基乙酰苯胺、4-甲基苯酚、2-己烯酸和1,4-二甲苯。根据产物组成及其动态变化规律推断,扑热息痛在土壤中的降解途径主要包括苯环支链水解、氧化作用、甲基化作用和苯环开环裂解等反应,详见图3。其中,3-羟基对乙酰氨基酚、1,4-苯醌和N-乙酰对苯醌亚氨具有与母体相近或更高的生物活性,这些产物本身或与母体共同作用可能产生更高的毒性效应,造成更大的环境风险。
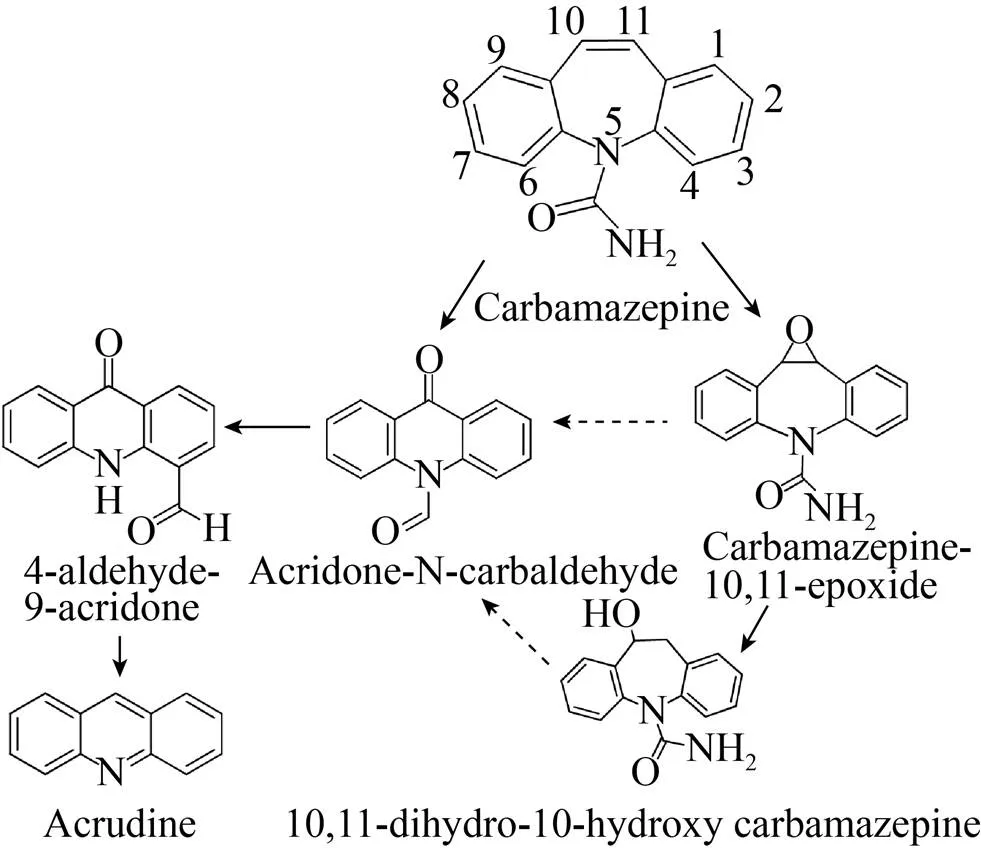
图2 卡马西平在土壤中可能的降解途径[58]
生物降解作用也可以将难降解的微污染物转化为更具有亲水性的降解产物(如无机化合物等)。例如,Wang等[35]在研究磺胺甲恶唑的生物降解及代谢途径中发现,不动杆菌sp在最适条件下,可以在48 h内矿化95%以上的磺胺甲恶唑。在微生物的作用下,磺胺甲恶唑可能首先发生酰化反应生成乙酰磺胺甲恶唑,随后发生侧链乙酰羰基的还原反应生成一个过渡中间体。该过渡中间体随后发生去甲基化反应和异噁唑环氮氧键断裂的开环反应,使异噁唑环转化为3-氨基丙酸基侧链;砜基对位的碳氮键发生加羰基化反应,进一步水解为3个小分子产物,最终转化为可溶于水的硝酸铵、硫酸铵、H2O和CO2,降解途径见图4。Fischer等[60]活性污泥反应器中检测到了磺胺甲恶唑的两个主要降解产物(3-氨基-5-甲基-异恶唑和4-羟基-磺胺甲恶唑)。在微生物作用下,磺胺基的水解裂解也可导致磺胺酸和3-氨基-5-甲基异恶唑的生成[33]。
在不同微生物作用下PPCPs的降解产物组成和降解机理是存在较大差异的,即降解菌株的种类直接影响PPCPs的降解途径。磺胺甲恶唑是最常用的磺胺类药物之一,有关磺胺甲恶唑的微生物降解已被广泛研究。本文以磺胺甲恶唑为例,讨论其在不同微生物作用下的降解机制,磺胺甲恶唑不同菌株和不同条件下的微生物降解途径见图5。sp. BR1中的两种单氧化酶Sad A和Sad B在降解磺胺甲恶唑时发挥了重要作用,且磺胺甲恶唑经本位羟基化反应生成降解产物对氨基苯酚、苯三酚和3-氨基-5-甲基异恶唑,其中3-氨基-5-甲基异恶唑为主要降解产物[61-62]。3-氨基- 5-甲基异恶唑也是嗜冷假单胞菌HA-4降解磺胺甲恶唑的主要代谢物,且HA-4同时可将磺胺甲恶唑降解为苯胺和4-氨基苯磺胺[33]。此外, 3-氨基-5-甲基异恶唑和4-羟基-磺胺甲恶唑也是磺胺甲恶唑作为碳源和氮源时降解而成的中间产 物[60]。在sp. strain BR1和嗜冷假单胞菌HA-4以磺胺甲恶唑作为碳源和氮源时4-羟基-磺胺甲恶唑并未生成。在磺胺甲恶唑被sp.降解时,3-氨基-5-甲基异恶唑和4-羟基-磺胺甲恶唑均未检出,而羟基化3-氨基-5-甲基异恶唑和羟基苯磺酸作为中间产物被检出[35]。Mulla等[64]在sp.和sp.降解磺胺甲恶唑的过程中还发现了4-氨基酚和氢醌。微生物的共代谢作用可使磺胺甲恶唑降解为更多的产物。例如,在磺胺甲恶唑的共代谢过程中,除了3-氨基-5-甲基异恶唑和4-羟基-磺胺甲硫胺以外,还有磺胺酸和N-乙酰基-磺胺甲恶唑的生成[31,49,65]。除上述中间产物外,氨氧化菌共代谢降解磺胺甲恶唑时还发现了4-硝基-磺胺甲恶唑和脱氨基磺胺甲恶唑的产生。与氨氧化细菌不同的是,硫酸盐还原菌可通过3种途径降解磺胺甲恶唑[66]。综上,磺胺甲恶唑在不同的降解菌株作用下可产生不同的降解产物,这可能是由于不同菌株所含酶和基因的差异所致;另一方面,磺胺甲恶唑降解生成的产物结构和浓度的差异也会反向影响其降解菌的结构组成和基因等,降解菌的变化转而再次影响其降解产物的生成。

图3 对乙酰氨基酚的生物降解产物[59]
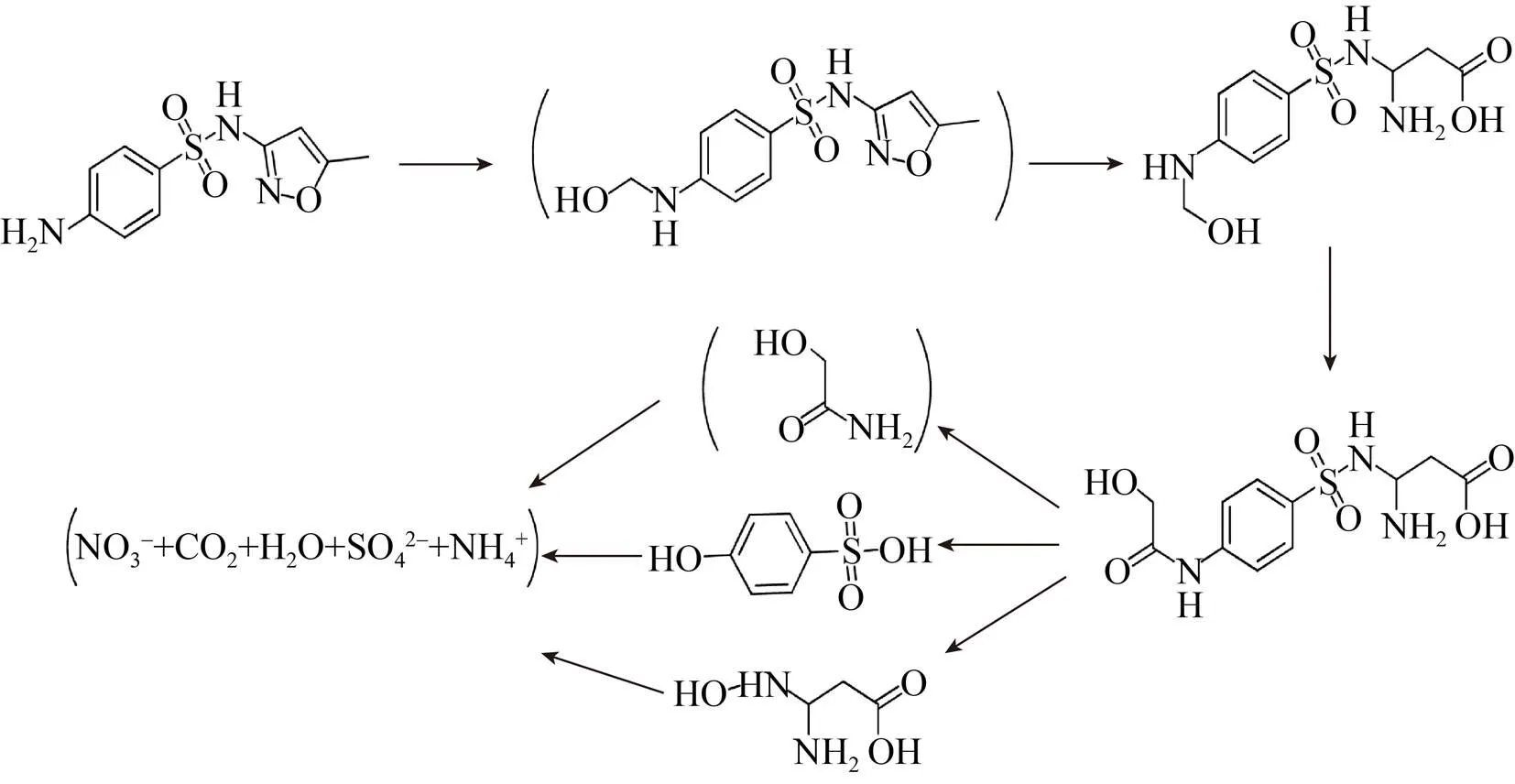
图4 不动杆菌对SMX的生物降解途径[35]
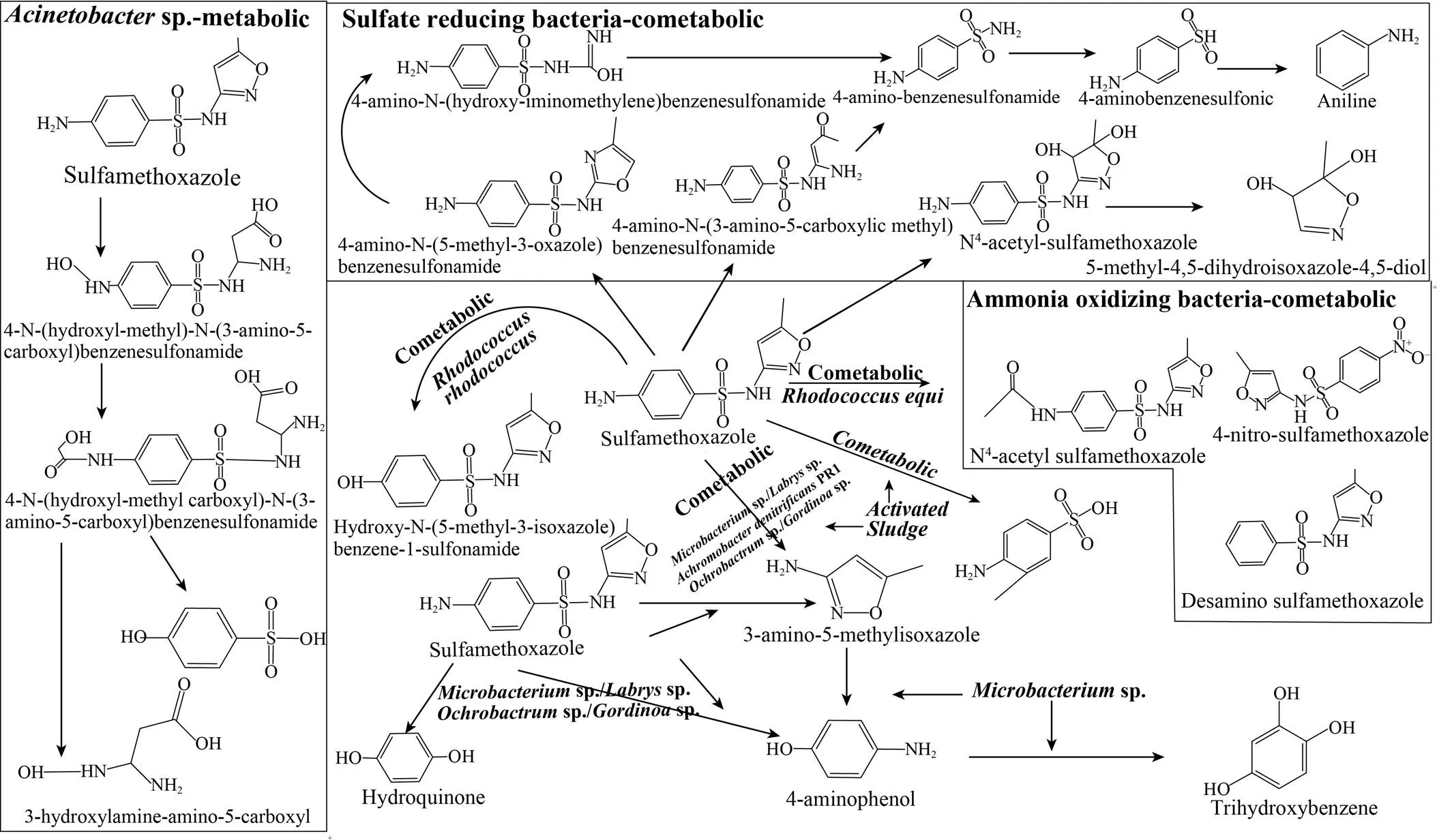
图5 磺胺甲恶唑的微生物降解途径[63]
PPCPs还可被微生物转化为更高吸附能力的降解产物。例如,Yang等[67]从猪粪中驯化富集得到了一种可降解睾丸素(Testosterone)的细菌,通过液相色谱飞行时间质谱分析发现,睾丸素通过脱羟基化反应生成脱羟基睾丸素,通过脱氢反应生成雄烯二酮和雄二烯二酮(降解途径见图6)。需要指出的是,Das等[68]通过土柱实验研究了睾丸素及其降解产物在土壤中的吸附能力,实验结果表明,睾丸素的降解产物雄烯二酮在土壤中的吸附分配系数d值(142 L/kg) 较母体睾丸素(42.7 L/kg)的高出2.3倍,由此可见,降解产物雄烯二酮具有比母体更弱的迁移能力,而使其较之母体具有更高的环境持久性和发生被植物吸收等二次污染的潜在风险性。

图6 睾丸素的生物降解途径<[67]
4 总结与展望
综上所述,人们对PPCPs的生物降解已开展了大量的工作,对其生物降解特性和机制也有了一定的认识,但仍需从以下几个方面进一步深入研究。
1) PPCPs可降解为不同的降解产物,但鉴定出的降解产物由于缺乏标准物质的对照和参考,结构组成尚不明确。
2) 有关PPCPs的毒理学研究目前还处于母体毒性研究的阶段,但对其降解产物的活性、生物可利用性和迁移能力等的研究尚少,而这些方面的研究对于全面客观评价PPCPs环境安全性尤为必要。
3) PPCPs种类繁多,结构多样,各组分没有共性结构,不同PPCPs生物降解机理必然存在较大差异,除现有已阐明的PPCPs生物降解机理外,大部分PPCPs生物降解作用机制尚不明晰,而全面系统研究PPCPs各化合物生物降解机理对开发PPCPs高效降解与去除技术并将其应用于污水处理、土壤修复及其他环境问题的解决具有重要的科学指导意义。例如,城市污水处理厂出水和活性污泥是PPCPs进入环境的两大主要来源,如何将PPCPs功能菌应用于污水处理过程,开发有针对性的PPCPs生物处理技术,提高实际污水处理厂PPCPs的去除率,降低其环境释放量,对于PPCPs等微污染物的水污染控制具有十分重要的现实意义。
4) 现有PPCPs的微生物降解研究主要侧重于功能降解菌的筛选和降解特性等方面,而未从基因水平研究功能菌群基因和降解机制之间的关系,该方面研究有望成为PPCPs微生物降解的一个重要方向。
5) 目前仅有少数研究报道通过植物吸收进行PPCPs的修复,并且其中主要为人工湿地系统中植物部分的讨论,有关PPCPs高富集及超富集植物鲜有报道,相关科研和应用工作有待于进一步展开。
[1] Li JN, Zhou QZ, Campos LC. Removal of selected emerging PPCP compounds using greater duckweed () based lab-scale free water constructed wetland. Water Res, 2017, 126: 252–261.
[2] Daughton CG, Ternes TA. Pharmaceuticals and personal care products in the environment: agents of subtle change? Environ Health Perspect, 1999, 107 (Suppl 6): 907–938.
[3] Li JY. Environmental fate and behavior of three commenly used pharmaceutical and novel chiral pesticide paichongding in soil[D]. Hangzhou: Zhejiang University, 2014 (in Chinese).李菊英. 三种常用医药及新型手性农药哌虫啶在土壤中的环境行为与归趋研究[D]. 杭州: 浙江大学, 2014.
[4] Dai CM, Zhou XF, Zhang YL. Research advancements in potential risk of PPCPs of environmental media. Environ Pollut Control, 2009, 31(2): 77–80 (in Chinese).代朝猛, 周雪飞, 张亚雷. 环境介质中药物和个人护理品的潜在风险研究进展. 环境污染与防治, 2009, 31(2): 77–80.
[5] Ricart M, Guasch H, Alberch M, et al. Triclosan persistence through wastewater treatment plants and its potential toxic effects on river biofilms. Aquat Toxicol, 2010, 100(4): 346–353.
[6] Mehinto AC, Hill EM, Tyler CR. Uptake and biological effects of environmentally relevant concentrations of the nonsteroidal anti-inflammatory pharmaceutical diclofenac in rainbow trout (). Environ Sci Technol, 2010, 44(6): 2176–2182.
[7] Hartmann A, Alder AC, Koller T, et al. Identification of fluoroquinolone antibiotics as the main source of umuC genotoxicity in native hospital wastewater. Environ Toxicol Chem, 1998, 17(3): 377–382.
[8] Cleuvers M. Aquatic ecotoxicity of pharmaceuticals including the assessment of combination effects. Toxicol Lett, 2003, 142(3): 185–194.
[9] Cheng JQ, Liu SC. Warning of super bacteria and the potentially public health problems caused by antibiotics abuse. Chin J Publ Heal, 2010, 26(12): 1521–1522 (in Chinese).程锦泉, 刘少础. 超级细菌的警示与滥用抗生素潜在公共卫生问题. 中国公共卫生, 2010, 26(12): 1521–1522.
[10] Luckenbach T, Epel D. Nitromusk and polycyclic musk compounds as long-term inhibitors of cellular xenobiotic defense systems mediated by multidrug transporters. Environ Health Persp, 2005, 113(1): 17–24.
[11] Gao Y, Zhao YZ, Wang LJ. Pollution sources and removal methods of pharmaceuticals and personal care products (PPCPs) in municipal waste water. Environ Sanit Eng, 2017, 25(6): 63–66 (in Chinese).高燕, 赵玉柱, 王利军. 城市污水系统中PPCPs的污染来源及去除方法研究进展. 环境卫生工程, 2017, 25(6): 63–66.
[12] Ternes TA. Occurrence of drugs in German sewage treatment plants and rivers. Water Res, 1998, 32(11): 3245–3260.
[13] Yu HJ, Cao WP. Assessment of pharmaceutical and personal care products (PPCPs) of Dalong lake in Xuzhou by concentration monitoring and bio-effects monitoring process. Environ Toxicol Pharmacol, 2016, 43: 209–215.
[14] Lin T, Yu SL, Chen W. Occurrence, removal and risk assessment of pharmaceutical and personal care products (PPCPs) in an advanced drinking water treatment plant (ADWTP) around Taihu Lake in China. Chemosphere, 2016, 152: 1–9.
[15] Peng XZ, Yu YY, Tang CM, et al. Occurrence of steroid estrogens, endocrine-disrupting phenols, and acid pharmaceutical residues in urban riverine water of the Pearl River Delta, South China. Sci Total Environ, 2008, 397(1/3): 158–166.
[16] Zhang XL, Yao Y, Zeng XY, et al. Synthetic musks in the aquatic environment and personal care products in Shanghai, China. Chemosphere, 2008, 72(10): 1553–1558.
[17] Lin LL, Liu GG. Research progress on occurrence and pollution control of PPCPs in aquatic environment. Water & Wastewater Eng, 2017, 53(S1): 142–146 (in Chinese).林龙利, 刘国光. PPCPs在水环境中的污染现状与控制研究进展. 给水排水, 2017, 53(S1): 142–146.
[18] Xie P. Research on degraduation of typical PPCPs and resources productivity by microalgae[D]. Harbin: Harbin Institute of Technology, 2017 (in Chinese).谢鹏. 微藻对五种典型PPCPs的去除效能及生物质资源的回收[D]. 哈尔滨: 哈尔滨工业大学, 2017.
[19] Dong JJ. Research on aerobic granular sludge process for enhance nitrogen and typical PPCPs removal[D]. Hangzhou: Zhejiang University, 2018 (in Chinese).董晶晶. 强化脱氮与典型PPCPs去除的好氧颗粒污泥工艺研究[D]. 杭州: 浙江大学, 2018.
[20] Burken JG, Schnoor JL. Predictive relationships for uptake of organic contaminants by hybrid poplar trees. Environ Sci Technol, 1998, 32(21): 3379–3385.
[21] Hijosa-Valsero M, Matamoros V, Sidrach-Cardona R, et al. Comprehensive assessment of the design configuration of constructed wetlands for the removal of pharmaceuticals and personal care products from urban wastewaters. Water Res, 2010, 44(12): 3669–3678.
[22] Nan YB, Zeng LY, Ma J, et al. Research progress of PPCPs wastewater treatment with constructed wetlands. Technol Water Treatm, 2017, 43(5): 16–21 (in Chinese).南彦斌, 曾立云, 马娟, 等. 人工湿地处理PPCPs污水研究进展. 水处理技术, 2017, 43(5): 16–21.
[23] Zhang DQ, Gersberg RM, Hua T, et al. Assessment of plant-driven uptake and translocation of clofibric acid by. Environ Sci Pollut Res, 2013, 20(7): 4612–4620.
[24] Zhang DQ, Tan SK, Gersberg RM, et al. Removal of pharmaceutical compounds in tropical constructed wetlands. Ecol Eng, 2011, 37(3): 460–464.
[25] A D. The removal efficiency and impact factors of 14 antibiotics in constructed wetlands[D]. Guangzhou: Jinan University, 2012 (in Chinese).阿丹. 人工湿地对14种常用抗生素的去除效果及影响因素研究[D]. 广州: 暨南大学, 2012.
[26] Dordio A, Pinto J, Dias CB, et al. Atenolol removal in microcosm constructed wetlands. Int J Environ Anal Chem, 2009, 89(8/12): 835–848.
[27] Ranieri E, Verlicchi P, Young TM. Paracetamol removal in subsurface flow constructed wetlands. J Hydrol, 2011, 404(3/4): 130–135.
[28] Dordio A, Carvalho AJP, Teixeira DM, et al. Removal of pharmaceuticals in microcosm constructed wetlands usingspp. and LECA. Bioresour Technol, 2010, 101(3): 886–892.
[29] Christofilopoulos S, Syranidou E, Gkavrou G, et al. The role of halophyteL. in the remediation of mixed contamination in a hydroponic greenhouse experiment. J Chem Technol Biotechnol, 2016, 91(6): 1665–1674.
[30] Boxall ABA, Kolpin DW, Halling-Sørensen B, et al. Peer reviewed: are veterinary medicines causing environmental risks? Environ Sci Technol, 2003, 37(15): 286A–294A.
[31] Larcher S, Yargeau V. Biodegradation of sulfamethoxazole by individual and mixed bacteria. Appl Microbiol Biotechnol, 2011, 91(1): 211–218.
[32] Herzog B, Lemmer H, Horn H, et al. Characterization of pure cultures isolated from sulfamethoxazole-acclimated activated sludge with respect to taxonomic identification and sulfamethoxazole biodegradation potential. BMC Microbiol, 2013, 13: 276.
[33] Jiang BC, Li A, Cui D, et al. Biodegradation and metabolic pathway of sulfamethoxazole byHA-4, a newly isolated cold-adapted sulfamethoxazole-degrading bacterium. Appl Microbiol Biotechnol, 2014, 98(10): 4671–4681.
[34] Reis PJM, Reis AC, Ricken B, et al. Biodegradation of sulfamethoxazole and other sulfonamides byPR1. J Hazard Mater, 2014, 280: 741–749.
[35] Wang SZ, Wang JL. Biodegradation and metabolic pathway of sulfamethoxazole by a novel strainsp. Appl Microbiol Biotechnol, 2018, 102(1): 425–432.
[36] García-Galán MJ, Rodríguez-Rodríguez CE, Vicent T, et al. Biodegradation of sulfamethazine by: removal from sewage sludge and identification of intermediate products by UPLC-QqTOF-MS. Sci Total Environ, 2011, 409(24): 5505–5512.
[37] Thelusmond JR, Strathmann TJ, Cupples AM. Carbamazepine, triclocarban and triclosan biodegradation and the phylotypes and functional genes associated with xenobiotic degradation in four agricultural soils. Sci Total Environ, 2019, 657: 1138–1149.
[38] Wang SZ, Yin YN, Wang JL. Microbial degradation of triclosan by a novel strain ofsp. Appl Microbiol Biotechnol, 2018, 102(4): 1997–2006.
[39] Lolas IB, Chen X, Bester K, et al. Identification of triclosan-degrading bacteria using stable isotope probing, fluorescence in situ hybridization and microautoradiography. Microbiology, 2012, 158(11): 2796–2804.
[40] Mulla SI, Wang H, Sun Q, et al. Characterization of triclosan metabolism insp. strain YL-JM2C. Sci Rep, 2016, 6: 21965.
[41] Lee DG, Zhao FM, Rezenom YH, et al. Biodegradation of triclosan by a wastewater microorganism. Water Res, 2012, 46(13): 4226–4234.
[42] Meade MJ, Waddell RL, Callahan TM. Soil bacteriaandsubsp. denitrificans inactivate triclosan in liquid and solid substrates. FEMS Microbiol Lett, 2001, 204(1): 45–48.
[43] Zhou NA, Lutovsky AC, Andaker GL, et al. Cultivation and characterization of bacterial isolates capable of degrading pharmaceutical and personal care products for improved removal in activated sludge wastewater treatment. Biodegradation, 2013, 24(6): 813–827.
[44] Lee DG, Cho KC, Chu KH. Identification of triclosan-degrading bacteria in a triclosan enrichment culture using stable isotope probing. Biodegradation, 2014, 25(1): 55–65.
[45] Roh H, Subramanya N, Zhao FM, et al. Biodegradation potential of wastewater micropollutants by ammonia-oxidizing bacteria. Chemosphere, 2009, 77(8): 1084–1089.
[46] Kaufman DW, Kelly JP, Rosenberg L, et al. Recent patterns of medication use in the ambulatory adult population of the United States: the Slone survey. JAMA, 2002, 287(3): 337–344.
[47] de Gusseme B, Vanhaecke L, Verstraete W, et al. Degradation of acetaminophen byandin a membrane bioreactor.Water Res, 2011, 45(4): 1829–1837.
[48] Molina MDC, González N, Benitez LF, et al. Bioremediation techniques for naproxen and carbamazepine elimination. Toxicity evaluation test. Chim Oggi, 2016, 34(2): 52–55.
[49] Gauthier H, Yargeau V, Cooper DG. Biodegradation of pharmaceuticals byandby co-metabolism. Sci Total Environ, 2010, 408(7): 1701–1706.
[50] Bessa VS, Moreira IS, Tiritan ME, et al. Enrichment of bacterial strains for the biodegradation of diclofenac and carbamazepine from activated sludge. Int Biodeterior Biodegrad, 2017, 120: 135–142.
[51] Li A, Cai R, Cui D, et al. Characterization and biodegradation kinetics of a new cold-adapted carbamazepine-degrading bacterium,sp. CBZ-4. J Environ Sci, 2013, 25(11): 2281–2290.
[52] Popa C, Favier L, Dinica R, et al. Potential of newly isolated wildstrains as agents for the biodegradation of a recalcitrant pharmaceutical, carbamazepine. Environ Technol, 2014, 35(24): 3082–3091.
[53] Golan-Rozen N, Chefetz B, Ben-Ari J, et al. Transformation of the recalcitrant pharmaceutical compound carbamazepine by: role of cytochrome P450 monooxygenase and manganese peroxidase. Environ Sci Technol, 2011, 45(16): 6800–6805.
[54] Yang YY, Wang Z, He T, et al. Sediment bacterial communities associated with anaerobic biodegradation of bisphenol A. Microb Ecol, 2015, 70(1): 97–104.
[55] Li GY, Zu L, Wong PK, et al. Biodegradation and detoxification of bisphenol A with one newly-isolated strainsp. GZB: Kinetics, mechanism and estrogenic transition. Bioresour Technol, 2012, 114: 224–230.
[56] Meng X. Treatments and research progress of PPCPs in aquatic environment. Urban Construction Theory Res: Electronic Version, 2017, (20): 220 (in Chinese).孟霞. 水环境中PPCPs的处理方法及研究进展. 城市建设理论研究: 电子版, 2017, (20): 220.
[57] Kang D. Removal of nutrients and pharmaceuticals and personal care products from wastewater using periphyton photobioreactors[D]. Beijing: China University of Geosciences, 2018 (in Chinese).康杜. 生物膜光反应器去除污水中营养盐和药品及个人护理品的研究[D]. 北京: 中国地质大学, 2018.
[58] Li JY, Dodgen L, Ye QF, et al. Degradation kinetics and metabolites of carbamazepine in soil. Environ Sci Technol, 2013, 47(8): 3678–3684.
[59] Li JY, Ye QF, Gan J. Degradation and transformation products of acetaminophen in soil. Water Res, 2014, 49: 44–52.
[60] Fischer K, Majewsky M. Cometabolic degradation of organic wastewater micropollutants by activated sludge and sludge-inherent microorganisms. Appl Microbiol Biotechnol, 2014, 98(15): 6583–6597.
[61] Ricken B, Corvini PFX, Cichocka D, et al.-hydroxylation and subsequent fragmentation: a novel microbial strategy to eliminate sulfonamide antibiotics.Appl Environ Microbiol, 2013, 79(18): 5550–5558.
[62] Ricken B, Kolvenbach BA, Bergesch C, et al. FMNH2-dependent monooxygenases initiate catabolism of sulfonamides insp. strain BR1 subsisting on sulfonamide antibiotics. Sci Rep, 2017, 7: 15783.
[63] Wang JL, Wang SZ. Microbial degradation of sulfamethoxazole in the environment. Appl Microbiol Biotechnol, 2018, 102(8): 3573–3582.
[64] Mulla SI, Hu AY, Sun Q, et al. Biodegradation of sulfamethoxazole in bacteria from three different origins. J Environ Manage, 2018, 206: 93–102.
[65] Müller E, Schüssler W, Horn H, et al. Aerobic biodegradation of the sulfonamide antibiotic sulfamethoxazole by activated sludge applied as co-substrate and sole carbon and nitrogen source. Chemosphere, 2013, 92(8): 969–978.
[66] Jia YY, Khanal SK, Zhang HQ, et al. Sulfamethoxazole degradation in anaerobic sulfate-reducing bacteria sludge system. Water Res, 2017, 119: 12–20.
[67] Yang YY, Borch T, Young RB, et al. Degradation kinetics of testosterone by manure-borne bacteria: influence of temperature, pH, glucose amendments, and dissolved oxygen. J Environ Qual, 2010, 39(4): 1153–1160.
[68] Das BS, Lee LS, Rao PSC, et al. Sorption and degradation of steroid hormones in soils during transport: column studies and model evaluation. Environ Sci Technol, 2004, 38(5): 1460–1470.
Advances in biodegradation of pharmaceuticals and personal care products
Yanan Cheng1, Tengda Ding1, Yiguang Qian1, Meng Li2, and Juying Li1
1,,518055,,2,,518060,,
Pharmaceuticals and personal care products (PPCPs) are a group of emerging environmental micropollutants, including prescription drugs and over-the-counter drugs (e.g., antibiotics, synthetic musk, painkiller, depressor, contraceptive drugs, soporific and weight-loss drug), and personal care products (e.g., cosmetics, synthetic perfume, sunscreen, hair spray, tint and fungicide). Extensive attention has been paid to PPCPs because of their potential negative effects on the environments and human health. Abundant researches have focused on the biodegradation of PPCPs. This review summarizes and discusses the biodegradation method, the diversity of PPCPs-degrading microorganisms, the degradation ability, metabolites and proposed pathways as well as the mechanisms of PPCPs’ biodegradation. In addition, prospects for further research on biodegradation of PPCPs are also discussed.
pharmaceuticals and personal care products (PPCPs), biodegradation, degradation pathway, functional bacteria
May13, 2019;
August1, 2019
National Natural Science Foundation of China (No. 21777104), Natural Science Foundation of Guangdong Province,China (No. 2017A030313226), Shenzhen Science and Technology Project (No. JCYJ20170818142823471).
Juying Li. Tel: +86-755-26733095; E-mail: jyli@szu.edu.cn
程亚楠, 丁腾达, 钱毅光, 等. 药品与个人护理品生物降解研究进展. 生物工程学报, 2019, 35(11): 2151–2164.
Cheng YN, Ding TD, Qian YG, et al. Advances in biodegradation of pharmaceuticals and personal care products. Chin J Biotech, 2019, 35(11): 2151–2164.
国家自然科学基金(No. 21777104),广东省自然科学基金(No. 2017A030313226),深圳市科技计划项目(No. JCYJ20170818142823471)资助。
(本文责编 陈宏宇)
