微生物驱动下铁氧化还原循环与生物脱氮
2019-12-06邓良伟肖友乾
杨 含, 郑 丹, 邓良伟, 肖友乾, 王 虹
(农业部沼气科学研究所, 四川 成都 610041)
在发酵、畜禽养殖、制药、化工等众多行业,产生大量含有高浓度氨氮的生产废水。这些高氨氮废水不经处理或处理不彻底而排放,会造成严重的氮素污染问题,例如,造成水体富营养化,形成酸雨等[1-2]。目前,废水脱氮的费用仍然比较高,开发高效低耗的脱氮技术是国内外环保领域的研究重点与热点[3-6]。
1 生物脱氮技术概况
废水生物脱氮技术是防治水体氮素污染的重要途径,在高氨氮废水的处理中得到了广泛应用[1-2,7]。
1.1 传统生物脱氮技术

1.2 厌氧氨氧化生物脱氮技术
近年来,废水处理领域涌现出的以厌氧氨氧化(Anammox)为核心的新型生物脱氮技术为实现低C/N废水的脱氮带来了希望,迅速成为国内外的研究热点[10, 12, 13]。厌氧氨氧化脱氮的原理是:在厌氧或缺氧条件下,厌氧氨氧化菌以氨氮作为电子供体、亚硝酸盐氮作为电子受体,直接将二者转化成N2,是一个完全自养的过程[14-15]。与传统硝化反硝化生物脱氮工艺相比,厌氧氨氧化工艺可以节省62.5%的供氧量以及100%的有机碳源,是非常简洁、经济的生物脱氮途径[10]。但是,实际废水中的氮素常以氨氮为主,厌氧氨氧化过程中亚硝酸盐氮的获取仍然需要强制曝气[16];同时,厌氧氨氧化反应会有部分硝酸盐氮生成,不能实现完全脱氮[17];另外,厌氧氨氧化菌的细胞产率低、倍增时间长,从而导致厌氧氨氧化反应器的启动时间较长,限制了该工艺在高氨氮废水处理中的应用[18]。以上因素均成为制约该新型生物脱氮技术应用发展的重大瓶颈因子。因此,如何在已有的传统硝化反硝化工艺、厌氧氨氧化工艺基础上寻求突破,探索经济有效的生物脱氮技术,扫除实际应用中的障碍因子,是目前新型生物脱氮技术研究的一大趋势。
2 微生物驱动铁循环与脱氮
铁元素是地壳中含量第四高的元素,其地球化学丰度为5.1%,全铁量在4%~15%之间,普遍存在于水圈、岩石圈、生物圈以及大气层中[19-20]。在自然界中,许多微生物的生存和发展都依赖于铁的氧化还原反应[21-22]。各种具有不同生理结构的微生物均进化出了以铁为底物进行能量代谢的能力,足见铁在生命形成过程中的重要性[23-24]。长期以来,非生物机制被误认为是主导环境中Fe(Ⅱ)氧化与Fe(Ⅲ)还原的主要方式,如受非生物因素pH-Eh条件控制等。直至20世纪80年代,研究者才开始认识到,部分Fe(Ⅱ)氧化与Fe(Ⅲ)还原是由特定微生物驱动的酶促反应[25]。许多研究发现,铁的氧化还原循环与环境中碳、氮、硫、重金属等元素的循环转化过程密切相关[26-28],包括温室气体排放[29]、农药降解[30]、重金属的固定和回收[31-32]、污水处理和饮用水净化等[33-34],铁循环及其与环境过程的耦合已经成为国际研究前沿[35-38],同时也得到国内同行的重点关注[39-41]。
2.1 基于零价铁的自养反硝化
在非生物环境中,铁在有氧存在的水环境中会发生腐蚀,腐蚀产物常常为氧化铁或氢氧化物的混合物,厌氧条件下零价铁几乎不会发生腐蚀。Roe[42]等证明,在有氧的水环境中,低碳钢上会附着一层薄薄的生物膜,其主要成分为微生物分泌的EPS海藻酸钙,足以引发铁的腐蚀[42]。生物膜内细胞的代谢活动会导致金属表面的氧浓度降低,从而在生物膜下(阳极)区域和暴露在最大氧浓度下(阴极)的未附着区域之间形成氧浓度差,此时腐蚀的基本机制为电子从阳极流向电子受体即氧的阴极区域,伴随着腐蚀产物的形成和局部pH值降低。在厌氧条件下,铁腐蚀最重要问题是在微生物和金属之间建立电子接触,零价铁作为电子供体失去电子生成Fe(Ⅱ),水中的质子或硫化氢作为电子受体,反应式如(1)~(3)[43]:厌氧腐蚀常与硫酸盐还原菌的活性有关,如脱硫弧菌属(Desulfovibrio)能促进铁在水中的厌氧氧化生成氢气[44]。
Fe(0)→Fe2++2e-
(1)
2H++2e-→2H→H2
(2)
2H2S+2e-→2HS-+H2
(3)

Fe(0)+2H2O→H2+Fe2++2OH-
(4)

(5)
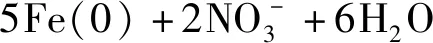
(6)
基于零价铁的自养反硝化属于氢营养型自养反硝化。氢营养型自养反硝化是指以H2为电子供体,硝酸盐为电子受体,在氢营养型微生物的作用下进行自养反硝化脱氮[46-47]。氢营养型自养反硝化处理过程无副产物产生,并且其成本相比需要额外添加有机碳源的异养反硝化低3~15倍[48],但利用氢营养反硝化从水中去除硝酸盐的主要技术难点是氢气的有效供应,由于氢气供应和生产成本较高运输和保存困难,使该技术的广泛使用受到限制[49]。使用金属铁的厌氧腐蚀原位制氢正好解决这一问题,金属铁在水中能还原水生成H2,并且金属铁相对便宜和安全[50]。厌氧条件下,纯培养的脱氮副球菌属(Paracoccusdenitrificans)和混合培养的自养反硝化微生物均可利用铁腐蚀产生的氢气实现自养反硝化[51]。Biswas[52]等将被硝酸盐污染的地下水通过包含0.5,1.0和1.5 g钢丝棉的沙土(体积为125 cm3)制成的活性多孔介质,并接种氢营养型反硝化微生物,经过13 d的停留时间,水中硝酸盐浓度从40 mg·L-1降低至2 mg·L-1以下。在序批式SBR反应器中,铁屑腐蚀产生H2,能为微生物的自养反硝化提供所需总电子的66.5%以上,实现稳定的硝酸盐去除[53]。但在零价铁和硝酸盐之间也存在非生物还原反应,其化学计量式为式(7)[54-55],硝酸盐与铁的非生物还原过程可能与生物反硝化同时发生,致使脱氮不彻底,产生大量的氨。

(7)
因此,减少硝酸盐非生物还原,促进零价铁自养反硝化,更有利于废水脱氮。零价铁比表面积越小,浓度越低,越不利于非生物还原,但是零价铁浓度较低也会影响自养反硝化的效果[52]。在纳米零价铁(NZVI)参与的自养反硝化过程中,硝酸盐在3天内完全还原,在非生物还原的对照实验中,在7天内只有50%的硝酸盐被非生物还原,可见零价铁自养反硝化的可行性,且在厌氧铁腐蚀过程中产生的铁(II)也可以作为硝酸盐还原的电子供体,进一步提高还原速率[56]。
2.2 硝酸盐型厌氧亚铁氧化
在pH值接近或略高于中性条件下(pH值为7),铁(Fe)主要是以不溶的固态矿物形式存在,包括Fe(II)与Fe(Ⅲ)的氧化物等[19, 25]。其中,pH的下降会显著提高Fe(II)的稳定性,在有分子氧(O2)存在时,Fe(II)只有在酸性条件下(pH<4.0)才能保持稳定;若在中性条件下,Fe(II)则会被O2迅速氧化为Fe(Ⅲ)[20, 57]。因此,在好氧情况下,Fe(II)在酸性环境下稳定,此时嗜酸微生物可以进行有效的代谢活动,实现微生物Fe(II)氧化[58, 59];在中性环境中,只有厌氧或微氧条件下,微生物才能进行有效的Fe(II)氧化和代谢过程[20]。Fe(II)可以作为电子供体被微生物利用,微生物通过Fe(II)的氧化获得能量,合成细胞物质并维持自身代谢,这类微生物称为铁氧化菌(Fe-oxidizing microoganism,FOM)[25, 60]。自然界中的FOM分布广泛,种类繁多,主要归属于细菌域的变形菌门(Proteobacteria)、硝化螺菌门(Nitrospira)、厚壁菌门(Firmicute)以及古菌域的广古菌门(Euryarchaeota)铁球菌属(Ferroglobus)中[22, 25, 61-62]。微生物Fe(II)氧化根据FOM的代谢类型可以分为酸性好氧型、中性微氧型、中性厌氧光能自养型以及中性厌氧化能自养型(硝酸盐型亚铁氧化和氯酸盐型亚铁盐化)四种[19, 61]。


(8)
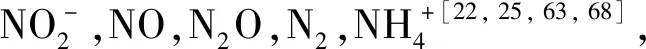

表1 与NAFO过程相关的电子对氧化还原电势(pH值7.0,25 oC) (mV)
注:引自[19, 22, 63]。

Straub[63]等也发现了归属于β-Proteobacteria的Thiobacillusdenitrificans,该菌是严格无机自养的NAFO菌,能氧化FeS并同时耦合硝酸盐还原。从淡水湖泊沉积物中分离到的归属于β-Proteobacteria的Pseudogulbenkianiastrain 2002菌株,是第一株在厌氧、常温、中性条件下得到的无机自养型NAFO菌,该菌利用Fe(II)作为电子供体,将硝酸盐还原为N2和N2O[71];随后的研究也表明,strain 2002菌同样可利用多种有机物异养生长[72]。
Blöthe[73]等利用Straub[63]等的无机自养NAFO富集培养物,采用分子克隆技术构建16S rRNA基因文库,证明Sideroxydans是该自养富集物中的主要属,但是对于Fe(II)氧化、硝酸盐还原的生物化学机理以及主导无机自养型NAFO过程的基因,目前尚未有定论[28, 73, 74]。
2.3 亚硝酸盐型厌氧亚铁氧化

(9)
(10)
(11)
(12)
(13)
(14)
(15)
2.4 铁氨氧化
铁还原菌(Fe-reducing microoganism,FRM)是指通过氧化电子供体并同时耦联Fe(III)还原,从这一过程中贮存生命活动的能量,即铁呼吸,合成细胞物质的一类微生物[84]。自Lovely等(1993)首次从淡水沉积物中分离出金属还原地杆菌(GeobactermetallireducensGS-15,β-Proteobacteria)以来,Fe(III)作为最终电子供体的铁还原研究取得了巨大进展[85],目前已经报道的FRM超过200株,广泛分布于湖泊、海底沉积物、土壤以及水稻根际等厌氧生境中[86-89],归属于铁还原古菌的泉古生菌门(Crenarchaeota)和广古生菌门(Euryarchaeota),以及涵盖铁还原细菌的热脱硫杆菌门(Thermodesulfobacteria)、放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、脱铁杆菌门(Deferribacteres)、热袍菌门(Thermotogae)、异常球菌-栖热菌门(Deinococcus-Thermus)、厚壁菌门(Firmicutes)、酸杆菌门(Acidobacteria)等[24]。已有研究表明,由微生物驱动的Fe(III)还原与环境过程中的有机碳矿化[90]、腐殖质还原[91-92]、有机氯还原脱氯[93-94]、重金属还原[95-96]、甲烷氧化[97-98]以及氨氧化[99-100]等过程有关,而与生物脱氮过程密切相关的则是厌氧铁氨氧化。


△G=-30.9 kJ
(16)

图1 土壤环境中Fe循环与N循环相互作用的原理图



(17)

(18)

(19)
Huang[108]等采用NH4Cl与水铁矿或针铁矿培养同样的河滨湿地土壤,经过180天的培养,富集物中的微生物群落发生显著变化,占主导地位的微生物归属于酸微菌科(Acidimicrobiaceae),其在系统发育上的近亲是Ferrimicrobiumacidiphilum(相似性为92%)以及Acidimicrobiumferrooxidans(相似性为90%)。
2.5 铁氧化还原与废水生物脱氮工艺

3 结论与展望
本文概述了目前生物脱氮技术的发展现状,以硝化反硝化,厌氧氨氧化等为主流生物脱氮工艺。主要论述铁氧化还原循环与生物脱氮密切相关的新型生物脱氮途径的研究发展历程,包括基于零价铁的自养反硝化,硝酸盐型厌氧亚铁氧化,亚硝酸盐型厌氧亚铁氧化,铁氨氧化,以及与其相关的新型生物脱氮工艺。目前部分新型生物脱氮工艺还处在实验阶段,相关微生物的营养类型和代谢途径、主导基因研究等方面相当缺乏;可以预见未来基于铁氧化还原耦合生物脱氮研发的新型生物技术对环境领域氮素污染控制具有非常重大的现实意义。
