环形铁粒幼细胞评价骨髓增生异常综合征患儿预后的价值
2019-12-06蓳雅梅
蓳雅梅,周 斌
(海宁市中医院检验科,浙江 海宁 314400)
骨髓增生异常综合征(myelodysplastic syndrome,MDS)是一种恶性克隆性疾患,其特征是难治性一系或多系髓系细胞减少,造血质量差、骨髓造血功能衰竭及演变成急性髓系白血病,所以该疾病也被称之为白血病前期,而关于克隆性造血异常的病因目前尚未明确[1-3]。环形铁粒幼细胞(ringed sideroblast,RS)是MDS分型的指标之一,既往研究多关注其对环形铁粒幼红细胞性难治性贫血(RARS)的生存预后,但关于伴RS增高的其他MDS亚型的分析不多[4-5]。考虑到不同分型其预后存在较大差异,本研究观察了RS水平变化与伴RS增高MDS生存预后的关系,现报道如下。
1资料与方法
1.1临床资料
选取海宁市中医院2012年1月至2018年1月在海宁市中医院初诊为MDS的180例患儿作为主要研究对象,对患儿进行骨髓穿刺和骨髓活检,参照2008世界卫生组织(WHO)标准[6],确诊为MDS。患儿中男125例,女55例;年龄6~18岁,平均(15.3±3.1)岁。根据WHO标准进行分型,分型标准及纳入的例数见表1。

表1 分型标准及纳入各组例数
1.2方法
血常规的检测:患儿于入院后第2天清晨空腹抽取静脉血,对血红蛋白、白细胞、血小板进行检测。
骨髓形态的检查:取患儿骨髓标本,油镜下计数骨髓涂片细胞,原始细胞计数根据髓系原始细胞在有核细胞中的百分比计算。以红系所占比例≥35%定义红系增生活跃。病态造血定量标准:粒系、红系及巨核系每系细胞中≥10%细胞存在病态。
选择骨髓涂片进行骨髓内铁染色,将其放在甲醛蒸气加以固定,待3min后混合等量亚铁氰化钾及盐酸溶液,加热后放入骨髓片30min,取出后加以冲洗,复染5min,冲洗后干燥,并于显微镜下进行观察,计算细胞内铁水平。沉积于胞质铁颗粒≥5个,并环核周≥1/3即铁染色RS。
染色体核型的检测:选择骨髓标本3mL,依据常规方法制备染色体标本,用R显带技术进行染色体核型分析。将染色体核型依据《人类细胞遗传学国际命名体制(ISCN2009)》标准分为预后好、中、差三型。
基因突变的检测:取骨髓标本3mL,参照Tripure Isolation试剂(瑞士罗氏制药公司)说明书提取其RNA。采用反转录试剂盒(反转录系统由美国普洛麦格公司提供)反转录合成cDNA。对目的基因特异引物实施实时定量PCR扩增。在软件上分析GATA1基因突变或异常表达及预后不良基因(MLL、N-RAS、FLT3、EVI-1等)突变状况。本次研究均获得所有研究对象家属知情同意并通过我院伦理委员会同意。
1.3随访观察
对各组患儿进行随访观察,随访至患儿死亡或至2018年1月18日,随访方式为电话、门诊复诊等,随访时间约为(16.3±5.1)个月。
1.4统计学方法
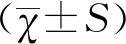
2结果
2.1各组临床参数及血常规指标的比较
与MDS RS-组比较,MDS RS+组在血红蛋白水平上差异无统计学意义(P>0.05),而在年龄、白细胞计数、血小板计数上明显高于MDS RS-组,经比较差异均具有统计学意义(均P<0.001);与MDS—LBRS-组比较,MDS—LBRS+组在血红蛋白水平上差异无统计学意义(P>0.05),而在年龄、白细胞计数、血小板计数上均明显高于MDS—LBRS-组,经比较差异均具有统计学意义(均P<0.05);与RAEB RS-组比较,RAEB RS+组在年龄、血红蛋白水平、血小板计数上差异均无统计学意义(均P>0.05),而在白细胞计数上明显高于RAEB RS-组,经比较差异具有统计学意义(P<0.05),见表2。
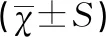
表2 各组临床参数及血常规指标的比较结果
2.2各组骨髓细胞形态及基因变化的比较
与MDS RS-组相比,MDS RS+组红系增生程度及巨幼变阳性率均明显更高,差异均具有统计学意义(均P<0.05),而在染色体核型预后分布上差异无统计学意义(P>0.05);与MDS—LBRS-组相比,MDS—LBRS+组红系增生程度及巨幼变阳性率均明显更高,差异均具有统计学意义(均P<0.05),而在染色体核型预后分布上差异无统计学意义(P>0.05);与RAEB RS-组比较,RAEB RS+组在红系增生程度阳性率明显高于RAEB RS-组,差异具有统计学意义(P<0.05),在红系巨幼变阳性率上差异无统计学意义(P>0.05),在染色体核型预后分布上较差(P<0.001),见表3。
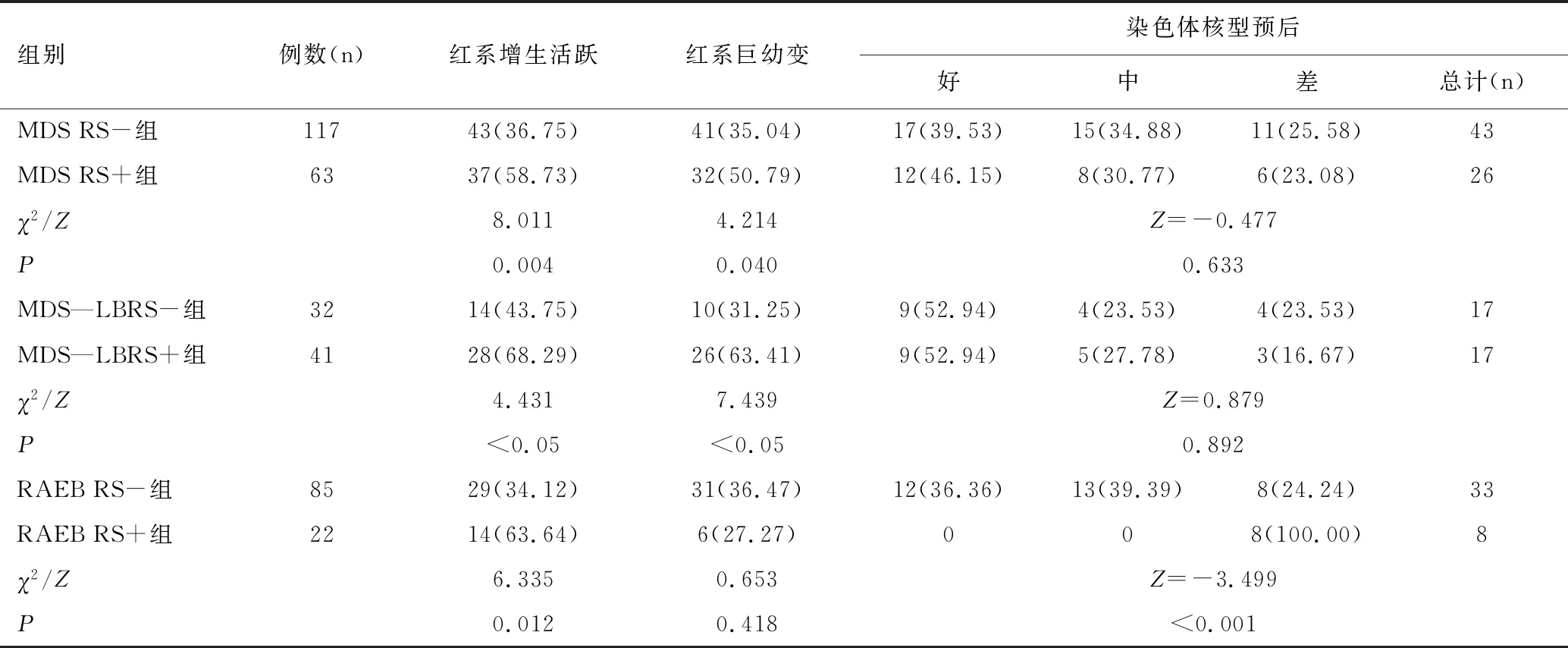
表3 各组骨髓细胞形态的比较结果 [n(%)]
MDS RS+组基因突变率与MDS RS-组比较差异均无统计学意义(均P>0.05);MDS—LBRS+组基因突变率明显高于MDS—LBRS-组,差异具有统计学意义(均P<0.05);RAEB RS-组基因突变率与RAEB RS+组比较差异均无统计学意义(均P>0.05),见表4。

表4 各组基因变化的比较结果 [n(%)]
2.3生存分析
截至2018年1月18日,MDS RS-组中位生存时间为21.6个月,MDS RS+组为12.6个月(χ2=14.549);MDS—LBRS-组中位生存时间为24.3个月,MDS—LBRS+为17.6个月(χ2=15.687);RAEB RS-组中位生存时间为14.3个月,RAEB RS+组为6.9个月(χ2=18.372)。与非RS增高组相比,伴RS增高组的中位生存时间更短(均P<0.05)。将RS引入COX回归模型分析MDS的患儿预后影响因素,结果显示RS是MDS患儿预后的独立影响因素(B=-2.499,OR=0.082,Wald=0.857,P=0.009)。
3讨论
3.1 RS水平变化与MDS患儿预后及染色体核型的关系
铁粒幼细胞性贫血是一组铁利用障碍性疾病。铁粒幼细胞性贫血患者骨髓出现大量RS,红细胞无效生成,组织铁储量过多,外周血呈小细胞低色素性贫血,RS也是MDS分型的一个重要指标[7]。2008年WHO修订的MDS诊断分型标准进行确诊分型,而其中RS占有核红细胞比例是否<15%是其分型的关键指标[8-9]。本研究结果显示,与非RS增高组相比,伴RS增高组的中位生存时间更短,提示RS增高和MDS患儿预后具有相关性,可应用于MDS的预后评估。国外学者研究显示MDS患儿生存预后可能与染色体核型异常及多系病态造血有密切联系[10],与本研究部分结论类似,发现MDS RS+组在红系增生程度及巨幼变阳性上均明显高于MDS RS-组,但在染色体核型上无明显差异。
3.2 RS-MDS患者血红蛋白水平及白细胞数的变化与预后的关系
目前认为年龄、血红蛋白水平及白细胞计数可作为MDS的预后指标[11-12]。有研究表明MDS患者外周血细胞减少可反映MDS无效造血,RS增高MDS组白细胞、血小板水平相对较高,说明RS可能主要影响红系造血,对粒系和巨核系影响不大。RS≥15%的患者骨髓红系增生程度和巨幼变更加明显[13-14]。本研究中MDS RS+患儿的发病年龄相对高,初诊时白细胞计数、血小板计数较高证实了这一点。MDS的发病关键在于骨髓无效造血,而在MDS预后中粒系、红系及巨核系病态造血具有重要作用,而MDS RS+组白细胞计数、血小板计数均明显高于MDS RS-组提示RS可能对红系造血造成主要影响[15-16]。RS≥15%的患儿在红系增生程度、巨幼变阳性率上相对较高,进一步说明RS主要影响红系造血而非粒系及巨核系。究其原因可能是与过高的铁负荷抑制MDS红系祖细胞增殖有关,从而加快了MDS进程[17-18]。
本研究中,MDS—LBRS+组在基因突变率均明显高于MDS—LBRS-组,说明基因突变也可能影响MDS预后。相关研究也表示基因突变可作为分子生物学标志评估MDS预后,当基因异常表达可进一步引起癌基因的激活和转录调节异常等,以此对MDS进展造成影响[19]。
综上所述,RS是MDS患儿预后的独立影响因素,这可能与红系造血、发病年龄、基因突变等有密切联系,对RS检测可预测MDS预后。
