单核细胞/高密度脂蛋白胆固醇比值对阵发性心房颤动导管消融术后复发的预测价值
2019-12-06雷倩魏宝柱
雷倩,魏宝柱
心房颤动(房颤)是临床常见的快速型心律失常,不仅影响患者的生活质量,还会引起脑卒中、心力衰竭和心动过速性心肌病等严重并发症。近年来以肺静脉电隔离为主的导管消融术已成为治疗房颤的主要手段,尤其适用于药物疗效差、症状反复发作者[1]。导管消融技术虽然日趋完善,但房颤复发率仍较高,其中远期复发率约20%~60%[2]。因此,房颤导管消融术后的复发率及其预测因素受到越来越多学者的关注。单核细胞/高密度脂蛋白胆固醇(HDL-C)比值(MHR)是一种新型心血管生物标志物,已被报道与冠状动脉(冠脉)粥样硬化相关,且可预测急性心肌梗死患者的预后[3,4]。MHR综合反映了炎症和氧化应激的信息[5],而后两者在房颤的发生、维持和复发中扮演了重要角色[6],但目前仍不明确MHR能否预测导管消融术后房颤的复发。本研究通过分析164例患者的随访资料,拟探讨MHR对阵发性房颤导管消融术后复发的预测价值。
1 资料与方法
1.1 研究对象连续选取2014年1月至2015年12月于武汉大学中南医院行导管消融术的阵发性房颤患者为研究对象,其定义为持续时间≤7 d的房颤。所有患者均自愿签署心脏电生理检查及导管消融术知情同意书。排除标准:①既往接受房颤导管消融治疗或其他心脏手术者;②左房内径>50 mm;③术前经食道超声提示存在心房血栓;④伴心脏瓣膜病、先天性心脏病或心肌梗死病史者;⑤合并甲状腺功能亢进、感染、炎症免疫性疾病或严重心肝肾功能不全者。最终纳入患者164例,其中男性93例(56.7%),平均年龄(56.1±10.4)岁。
1.2 资料收集记录患者各项临床资料,包括年龄、性别、体质指数、心血管疾病史、药物使用情况(他汀类、ACEI/ARB类)、房颤病程及类型等,计算CHADS2评分。收集患者心脏超声参数,包括左房内径和左室射血分数(LVEF)。所有患者均于导管消融术当日抽取空腹静脉血,检测血常规、血脂、肌酐及高敏C反应蛋白(hs-CRP),根据检测结果计算MHR值。
1.3 导管消融患者消融前均行经食道超声排除心房血栓,口服华法令者于术前5 d停用,改用低分子肝素抗凝治疗至术前1 d。在肺静脉造影后,于CARTO三维标测系统指导下行左房三维重建及环肺静脉线性消融。术中房颤消融后未恢复窦性心律者,行左房线性消融。若房颤仍未终止,再行左房碎裂电位消融。所有患者手术结束前均应用Lasso导管再次验证肺静脉消融情况,手术成功指征为肺静脉电位完全消失或仅能记录到与心房无关的肺静脉电位。
1.4 消融术后随访所有患者于消融术后第1、3、6、9、12个月时门诊复查12导联心电图或24 h动态心电图,此后每6个月复查一次。整个随访期间,嘱患者若出现心悸等症状应立即就诊并记录心电图。房颤复发定义为消融术3个月后出现持续30 s以上的房性心律失常(包括房颤、心房扑动和房性心动过速)。术后3个月为空白期,期间发作的快速房性心律失常视作早期复发。
1.5 统计分析应用SPSS 20.0软件进行统计分析,计量资料以(均数±标准差)表示,组间比较采用独立样本t检验;而计数资料以频数表示,组间比较采用χ2检验。采用Pearson相关系检验分析两类计量资料间的相关性。采用Kaplan-Meier曲线描述不同MHR水平组患者房颤的复发情况,并通过Log-rank检验进行比较。根据单因素和多因素Cox回归进行逐步分析,以探究房颤复发的独立预测因素。当P<0.05时,为差异有统计学意义。
2 结果
2.1 基线特征纳入的164例患者中,合并高血压、糖尿病和冠心病患者分别占42.1%(69例)、23.2%(38例)、11.6%(19例),房颤病程为(6.4±4.5)年。患者平均体质指数为(24.5±3.7)kg/m2,左房内径为(37.5±5.1)mm,LVEF为(62.7±5.2)%,CHADS2评分为(1.8±1.0)分。
2.2 不同MHR水平组的资料比较根据MHR水平的中位值将患者分为MHR≤0.54组(n=82)和MHR>0.54组(n=82)。MHR>0.54组患者的左房内径、房颤病程、早期复发比例、白细胞计数和hs-CRP水平均高于MHR≤0.54组,而其阵发性房颤比例和HDL-C水平低于MHR≤0.54组,差异有统计学意义(P<0.05)。Pearson相关性分析表明,MHR水平与左房内径(r=0.31,P<0.01)、房颤病程(r=0.24,P=0.028)和hs-CRP水平(r=0.27,P=0.040)间均存在相关性,而与其他临床指标无关(表1)。

表1 不同MHR水平组的临床资料比较
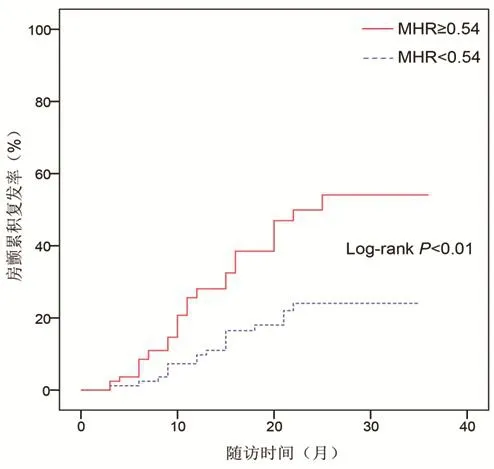
图1 不同MHR水平组患者房颤复发的Kaplan-Meier曲线

表2 影响房颤复发的Cox回归分析
2.3 房颤复发的预测因素平均随访时间为(18.9±7.7)月,期间共53例(32.3%)患者出现房颤复发。其中,MHR≥0.54组患者的房颤复发率为43.9%(36/82),而MHR<0.54组患者为20.7%(17/82),差异有统计学意义(Log-rankP<0.01,图1)。单因素Cox回归分析表明,年龄、体质指数、左房内径、房颤病程、早期复发和MHR水平均与阵发性房颤导管消融术后的复发相关。进一步行多因素Cox回归分析,结果提示左房内径(HR=1.40,95%CI:1.05~1.86;P=0.021)、早期复发(HR=2.13,95%CI:1.25~3.63;P<0.01)和MHR(HR=1.62,95%CI:1.13~2.13;P≤0.01)水平是术后房颤复发的独立预测因素(表2)。
3 讨论
导管消融是房颤安全有效的治疗手段之一,在改善患者生活质量和预后方面均明显优于抗心律失常药物治疗[7,8]。随着导管消融在房颤治疗中的普及,其术后复发率也日益受到重视。本研究对164例阵发性房颤患者进行(18.9±7.7)个月的随访,最终53例复发,复发率与既往报道相近。同时发现,不同MHR水平组患者的复发率存在明显差异,通过Cox回归进一步证实高MHR水平是导管消融术后房颤复发的独立危险因素。本研究中左房内径和早期复发也与房颤复发密切相关,这些结果与其他学者报道一致[9-11]。
心房的结构重构和电重构在房颤的发生和维持中扮演了重要角色,炎症和氧化应激相互作用使心房肌细胞变性和纤维化,引起心房上述的两种重构[12],促进房颤的发生发展。既往研究表明,循环中的单核细胞可粘附于内皮细胞并渗入受损组织,诱导白介素-1、白介素-6和肿瘤坏死因子-α等炎症因子的表达[13]。单核细胞在细胞外基质中可分化成熟为巨噬细胞,后者分泌白介素-1β和基质金属蛋白酶-9,促进炎症反应并刺激成纤维细胞增殖[13]。有报道指出,房颤患者的心房肌中存在巨噬细胞浸润,且其浸润程度与心房扩大明显相关[14]。HDL-C主要参与胆固醇的逆向转运,但与单核细胞不同的是其可发挥抗炎、抗氧化和抗血栓形成等多种效应[15]。Alonso等通过调查普通人群中血脂与房颤发生间的关系发现,HDL-C水平是房颤发生的独立预测因素[16]。Watanabe等研究指出,低HDL-C水平的女性患房颤的风险比高HDL-C水平的女性增加1.86倍[17]。据此推测,低水平的HDL-C可能通过减少胆固醇的逆向转运引起心房肌细胞异常,间接降低抗炎和抗氧化作用,导致房颤发生。因此,MHR综合反映了单核细胞和HDL-C的以上作用,从而可预测导管消融术后房颤的发生。本研究中,MHR与左房内径和房颤病程存在明显相关性,进一步支持MHR这一标记物在房颤发生发展中的作用。
目前国内外关于MHR与房颤发生间关系的研究相对较少。Saskin等研究表明,冠脉旁路移植术前的MHR水平是术后房颤发生密切相关[18]。胡晓等的一项回顾性分析[19]指出,伴MHR升高的阵发性房颤患者导管消融术后的复发率更高,但MHR并不是房颤复发的预测指标,推测可能与其样本量较小有关。本研究采用前瞻性设计,发现MHR可作房颤复发的一个独立预测指标。但需注意的是准确判断患者房颤的复发情况相对困难,故本研究可能低估了患者术后的复发率。
总之,本研究结果提示导管消融术前的MHR水平可独立预测术后房颤的复发,MHR仅需检测血常规和血脂即可获得,两者均为常规检查项目,相对容易获取且经济,因此可作为预测导管消融术后房颤复发的一个简单有效的指标。
