骨髓增殖性肿瘤患者心房颤动的发生情况及影响因素分析
2019-12-06白贝贝韩雪赵森陈烨林运
白贝贝,韩雪,赵森,陈烨,林运
骨髓增殖性肿瘤(MPN)是一组由多能造血干细胞克隆性增殖引起的以一种或多种血细胞质、量异常为特点的慢性骨髓增生性疾病。其中以真性红细胞增多症(PV)、原发性血小板增多症(ET)、原发性骨髓纤维化(PMF)最常见,多好发于50~70岁的中老年人[1]。而心房颤动(AF,房颤)是一种由于心房细胞退行性变引起的心房电不均一而出现的心律失常。一般人群中AF患病率1%~2%,我国人群为0.77%,多见于老年患者[2]。与较年轻人群(51~60岁)比较,71~80岁人群AF患病率增加了5倍,80岁以上的高龄老人增加了6倍[2]。众所周知,AF常引起动脉血栓形成的高风险,需接受抗凝治疗。而MPN引起的高凝状态也被广泛研究,其发生机制与慢性血管内皮损伤、血小板活化、血管壁高剪切应力、血液高黏度、低氧血症均有关,高凝状态可导致血栓并发症[3]。从临床角度上看MPN和AF有相同的年龄和病理背景,且已有报道发现MPN患者房颤的发生率明显高于非MPN人群[4]。目前研究对于MPN罹患房颤的报道较少,本文总结我院2011~2018年收治的173例MPN患者的心律失常情况,发现AF发生率显著高于普通人群,故对MPN发生房颤的影响因素进行分析,旨在探讨评估MPN发生房颤的危险因素,为此类患者早期诊断和精准治疗提供临床依据。
1 资料与方法
1.1 研究对象选择首都医科大学附属北京安贞医院于2011年9月至 2018年9月收治的MPN患者173例,ET、PV、PMF诊断符合2016年世界卫生组织制定的诊断标准[5]。排除标准:肺源性心脏病、风湿性心脏病、先天性心脏病、胸廓畸形、急性或严重感染、肝肾功能不全、其他恶性肿瘤等对心电图、心脏超声参数有明显影响的疾病。
1.2 研究方法
1.2.1 一般资料的收集收集患者初诊时骨髓细胞形态学及活检、骨髓JAK2 V617F基因突变、血管并发症等资料,以及患者性别、年龄、主要心血管危险因素(吸烟、高脂血症、高血压、糖尿病等)、三酰甘油(TG)、胆固醇(CHO)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、C反应蛋白(CRP)、血细胞计数等临床资料。血管并发症定义:含血栓形成、出血、肺动脉高压、门静脉高压症等。包括:①动脉血栓:脑梗死、短暂性脑缺血发作、急性冠脉综合征及周围动脉血管病等;②静脉血栓:周围或内脏静脉血栓形成等;③出血:指胃肠道出血、颅内、眼底、关节出血等[6]。
1.2.2 心脏资料的收集收集患者心电图、超声心动图等临床资料,超声参数包括:瓣膜反流(二尖瓣、三尖瓣、主动脉瓣)、肺动脉高压(PAH)、左室舒张及收缩功能、左房内径、左室舒张末内径、主动脉根部内径(AORD)、左室射血分数(LVEF)等。心脏结构与功能的定义与判断标准参照《超声心动图学(第4版)》、《超声心动图诊断要点》等[7,8]。AF诊断标准为:通过心电图或动态心电图证实为AF者,包括阵发性AF和持续性或永久性AF,或有明确AF病史者。AF诊断标准参照2016版欧洲心脏病学会(ESC)AF指南[9]。所有173例MPN患者超声心动参数中获得评估左房大小、左室大小、AORD结果各171例,获得评估左室舒张功能结果163例,其余参数均获得173例结果。
1.2.3 基因检测采用等位基因特异性聚合酶链反应(AS-PCR)技术,检测JAK2V617F、MPL、CALR、BCR-ABL等基因突变情况。
1.3 统计方法采用SPSS 20.0软件,计量资料符合正态分布采用均数±标准差表示,不符合正态分布采用中位数(四分位数间距)表示;计数资料采用率或构成比表示;计量资料比较采用两独立样本t检验或非参数Mann -Whitney U检验;采用χ2/Fisher确切概率法检验来计算计数资料的构成比的差异程度;多因素相关性采用Logistic回归模型分析,以P<0.05为差异有统计学意义。
2 结果
2.1 研究对象的基本特征173例MPN患者,其中PV58例,ET103例,PMF12例;男性96例,女性77例;平均年龄(61.66±12.86)岁。72例患者发生80例·次血管事件,其中动脉事件71例·次,静脉事件7例·次,同时合并动、静脉事件1例·次,出血1例·次。外周血液学指标分析,PV组红细胞(RBC)、红细胞压积(Hct)、血红蛋白(Hb)均明显高于ET及PMF组(P<0.05);ET组血小板计数(PLT)明显高于PV及PMF组(P<0.05)。心脏结构及功能分析,ET组二尖瓣反流(MR)、三尖瓣反流(TR)及PAH发生率(分别为52.43%、51.5%、14.6%)明显高于PV组(分别为27.59%、29.3%、3.4%,P<0.05);获左室舒张功能检测结果163例患者中左室舒张功能减退135例,发生率为82.8%。ET、PV、PMF三组血脂均在正常范围内,PMF组CHO、HDL、LDL均低于ET及PV组,有统计学意义(P<0.05)。MPN患者伴高血压109例(63%),伴高脂血症61例(35.3%),伴糖尿病34例(19.7%),ET患者伴糖尿病的比例显著低于其他两组(P<0.05)。吸烟者51例(29.5%),三组间比较无统计学意义。所有173例患者获108例基因检测结果,有两种基因突变被检测到,主要是JAK2V617F突变(70例),此外还发现MPL突变阳性1例,其他37例未被检测到基因突变,基因突变率为65.7%(表1)。
2.2 MPN患者的心律失常173例MPN中,51例患者(29.5%)被记录伴有心律失常,其中单项心律失常事件41例(23.7%),2项以上者10例(5.8%),ET、PV及PMF三组间心律失常发生率无明显差异(P>0.05)。心律失常类型有:窦性心动过缓、心动过速(包括窦性心动过速、室上性心动过速、房室结折返性心动过速)、心房扑动、AF、传导阻滞(包括房室传导阻滞、室内传导阻滞以及左、右束支传导阻滞)、房性早搏、室性早搏。AF(8.7%)、传导阻滞(8.7%)和心动过速(5.2%)发生率居MPN患者前三位;ET、PV及PMF三型之间心律失常类型略有不同:ET组以AF(9.7%)最常见,其次为心动过速(7.8%)、传导阻滞(4.9%);PV组以传导阻滞(12.1%)最常见,其次为房性早搏(10.3%)、AF(6.9%),其中房性早搏发生率明显高于ET组(1.9%),差异有统计学意义(P<0.05);PMF组类似PV组,以传导阻滞(25%)最多见。AF发生率在ET最高,为9.7%,PV和PMF组分别为6.9%、8.3%,三组间无统计学差异(P>0.05)(表2)。
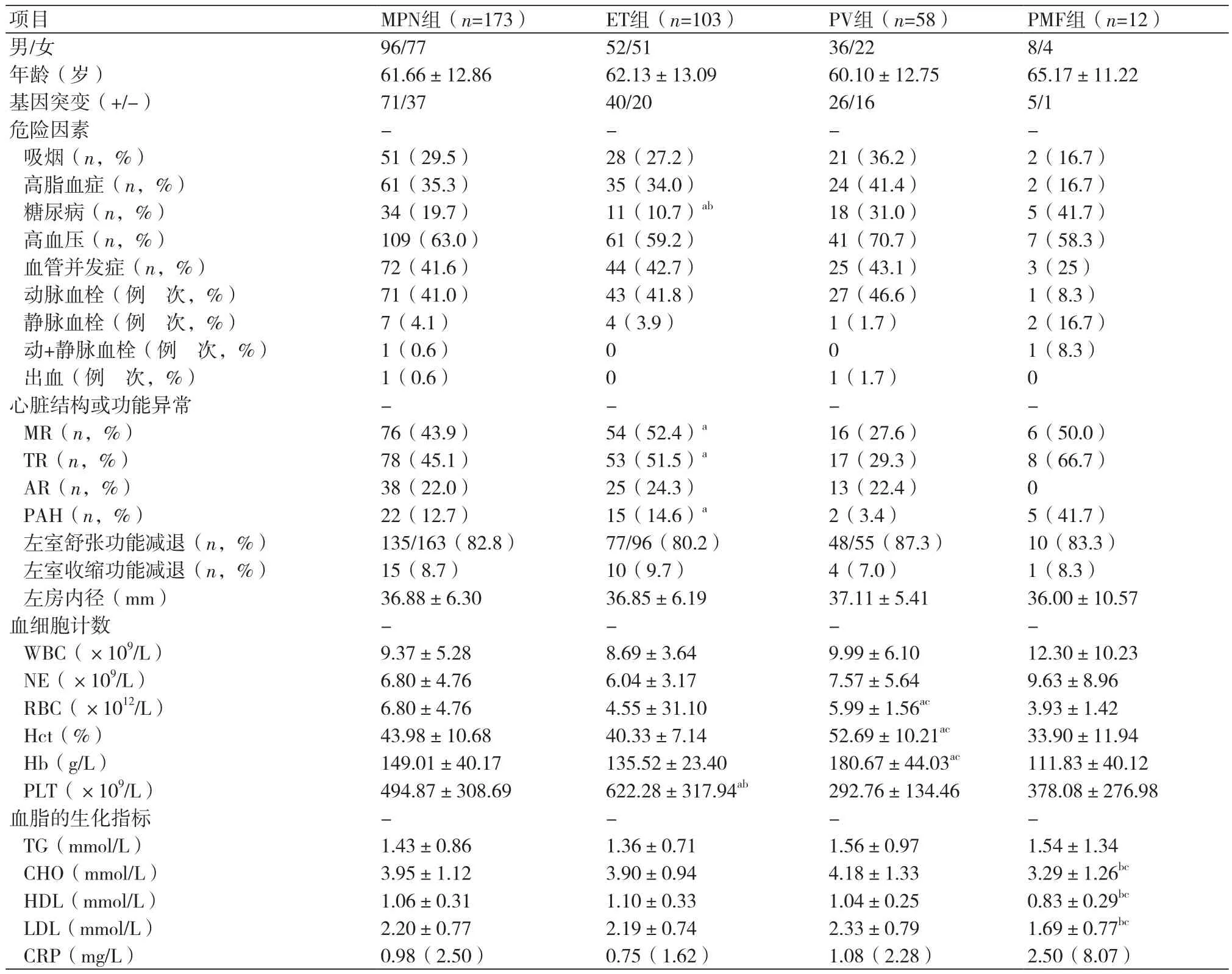
表1 MPN患者一般资料及临床特征
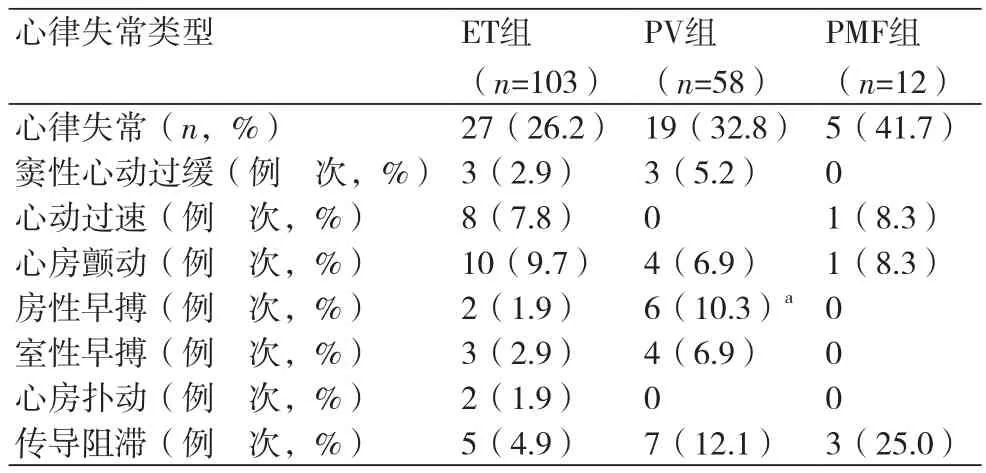
表2 MPN患者各型心律失常发生率
2.3 MPN患者伴发AF的单因素分析患者有无AF在性别、年龄、分型、JAK2基因突变等方面比较无显著差异;高血压、糖尿病、高脂血症、冠心病、心肌梗死、是否吸烟等因素在两组间差异无统计学意义(P>0.05)。MPN伴AF组左房增大、AORD≥31 mm、LVEF<60%的比例分别为80%、93.3%及66.7%,显著高于不伴AF组(42.3%、59%、25.3%),差异有统计学意义(P<0.05)(表3)。
2.4 MPN患者伴发AF的多因素Logistic回归分析将左房增大、AORD、LVEF(表3中P<0.05的因素)以及文献[9]报道中AF危险因素如性别、年龄、高血压、糖尿病、高脂血症、吸烟共9个因素作为自变量,以有无AF作为因变量,进行多因素Logistic回归分析,结果显示左房增大(OR=1.089,95%CI:1.006~1.178)是MPN患者发生AF的独立危险因素(表4)。
2.5 MPN患者左房增大的单因素分析MPN伴左房增大与无左房增大组比较,不同性别、年龄、分型方面均无显著差异;高血压、糖尿病、高脂血症、冠心病、心肌梗死、是否吸烟等因素在两组间亦无统计学意义(P>0.05)(表5)。

表3 MPN患者伴发房颤的单因素分析

表4 MPN患者伴发房颤的多因素Logistic回归分析

表5 MPN患者左房增大的单因素分析
3 讨论
MPN患者罹患心律失常的比例明显高于非MPN患者,且不同类型的MPN患者心律失常发生类型略有不同。MPN对心脏节律的影响国内外的相关研究较少。Wu等[10]报道MPN患者心律失常发生率(12%)明显高于非MPN人群(6%)。Birgegård等[11]研究的一组ET患者中,心律失常发生率只有0.33%,但几乎完全由AF构成。Kadikoylu等[12]报道36例MPN中3例合并AF,发生率为8%,其中PV和PMF患者AF发生率分别为17%(1/6)和14%(1/7),ET组无AF发生。Mahé等[4]研究纳入713例MPN患者,其中AF发生率为13%,ET组AF发生率为15%,PV组为12%。本组173例MPN患者心律失常发生率为29.5%,明显高于Wu等的报道; AF发生率为8.7%,明显高于与之年龄匹配的非MPN人群(0.6%)[13],与Kadikoylu等报道发病率一致,但ET及PV的AF发生率分别为9.7%、6.9%,低于Mahé等的报道。本组传导阻滞发生率为8.7%,略高于非MPN人群(4.3%~7.7%)[14-16]。
MPN患者AF高发与左房重构有关。目前认为AF的发生源于心房结构重构,易诱导心肌电的紊乱,导致持续性或永久性AF[17]。心力衰竭、瓣膜病变、左房扩大、高血压、老年、肥胖和阻塞性睡眠呼吸暂停等均是AF发生的独立危险因素[9]。MPN与心脏结构的关系目前研究较少。文献发现MPN患者左房内径、室间隔厚度较对照组明显增大,31%的患者出现主动脉瓣及二尖瓣增厚、钙化[12]。Reisner等研究了30例MPN患者,发现63%的患者心脏瓣膜出现不同程度的损害,明显高于对照组(4.5%),以主动脉瓣及二尖瓣受累为主[18]。Kayrak等通过心电图的改变提出负荷增加引起的左室肥厚是PV患者AF发生的危险因素之一[19]。他们认为PV患者血液高粘度可能导致心肌负荷增加和组织缺血,而心肌缺血可引起心肌异常复极化导致AF的发生。本研究发现MPN伴AF患者中左房增大比例明显高于无AF组,且左房增大是MPN患者发生AF的独立危险因素;MPN伴AF组AORD≥31 mm及LVEF<60%的比例明显高于不伴AF组;ET组MR、TR及PAH发生率明显高于PV组(P<0.05),且ET组AF发生率略高于PV组。推测MPN血细胞增多、血液高粘稠和血容量增加可升高血管阻力,长期后负荷增加前期可出现左室肥厚、左心扩大,后期可导致左房扩大、主动脉增宽,导致心脏结构改变[19];此外长期高血流动力学不仅会对瓣膜冲击导致损伤,而且慢性炎症、血细胞增多等释放的细胞因子损伤血管内皮,会对心脏瓣膜产生重要影响[20,21];因此MPN造成的左房增大、主动脉增宽、左室收缩功能减退、瓣膜反流及肺动脉高压等可能是导致其发生AF的原因。
本研究试图寻找不同类型MPN患者左房增大的影响因素,但从目前数据中未能发现确切的线索。在左房增大组中,高血压、糖尿病、心肌梗死和ET组的比例略高于对比组,但差异无统计学意义,有待扩大样本量后再次分析。
MPN患者一旦发生AF,抗凝治疗应更加个体化。MPN中血管并发症是其最常见死因,PV患者发生率约34%~38.6%,ET患者约9.7%~29.4%,PMF约13%,60岁以上人群的发生率和死亡率更高[22]。既往对于MPN血管并发症的研究多集中在血细胞计数异常、血液动力改变、炎症、血细胞活化、基因改变等血管事件方面。心脏作为一种“血管腔样器官”,MPN同样影响其结构及功能。随着近年来的研究,MPN导致心脏结构及功能的危害逐渐凸显[12]。而AF是临床最常见的心律失常,心房结构重构亦是AF发生和维持的重要基础[17]。目前已有文献报道AF或MPN是人群中血栓形成率增加的主要因素[4]。对于MPN伴AF来说存在双重血栓形成风险,预防血栓形成和抗凝治疗对于减少不良事件的发生及延缓病情进展具有更广泛的意义。
多篇文献[4,19]发现AF可能导致MPN患者动脉血栓形成的风险增加。经典的MPN治疗主要是预防血栓出血并发症。根据血栓危险分层予抗血小板、静脉放血及降细胞药物治疗。低剂量阿司匹林(LDA)能够降低PV及ET患者血栓发生率[10]。最新指南提出AF抗凝药物的选择取决于AF卒中危险分层评分系统,通常给予维生素K拮抗剂(VKA)或新型口服抗凝药(NOAC)[9],但指南也提出抗凝加抗血小板治疗会增加AF患者出血风险。Sankar等[22]发现接受VKA治疗的MPN患者动静脉血栓形成的复发风险降低2.8倍,且出血风险没有增加。在Mahé等[4]研究中,MPN伴AF患者应用LDA的血栓事件风险是无AF患者的5.2倍。因此MPN患者一旦出现AF,继续低剂量阿司匹林可能不足以预防血栓形成,是否联合或如何联合抗凝剂尚需今后临床进一步观察。
总之,本研究发现MPN患者AF的发生率高于一般人群,左房增大是MPN发生AF的独立危险因素。低剂量阿司匹林对于MPN发生AF的患者控制血栓形成效果不尽人意,LDA和VKA或NOAC联合可能是一个更好的选择。目前关于这一方面的治疗报道很少,有待进一步研究发现更合适的治疗策略。
