HP-HA-肝ECM水凝胶制备及细胞相容性研究
2019-12-05董娇张霓霓姚礼张立刚王明雪王帅黄桂林
董娇 张霓霓 姚礼 张立刚 王明雪 王帅 黄桂林
舍格伦综合症、头颈部恶性肿瘤放射治疗常常导致涎腺分泌功能障碍,严重影响患者的生活质量[1]。组织工程学方法再生涎腺能重建腺泡、导管结构,恢复涎腺受损的分泌功能,是目前较有前景的治疗方法[2]。生物材料[3-4]作为其重要组成部分,成为目前的研究热点。人工合成材料因为缺少生物活性成分,多为“惰性”界面,不能取得良好的再生效果。相比而言,天然组织来源的细胞外基质是优良的组织工程支架材料。涎腺和肝脏同属于外分泌腺体,而且在胚层发育上同属于外胚层来源,具有胚层来源相关性[5],肝脏ECM亦是理想的组织工程天然支架来源。肝素-透明质酸水凝胶是广泛应用于组织工程领域的一种支架载体,具有缓释生长因子[6]、具有生物活性、促进三维培养[7]等诸多优点。大量研究表明,用改良方法制备的肝素-透明质酸-肝脏细胞外基质水凝胶(HP-HA-肝ECM水凝胶)有利于组织再生[8];但是该HP-HA-肝ECM水凝胶在涎腺再生中的作用尚未见报道。目前,组织工程化涎腺类器官研究存在的问题是:缺少具有生物活性成分、具有缓释作用的生物支架材料,因而不能为组织工程化涎腺类器官三维培养提供良好微环境。所以,本研究希望采用与之类似的改良方法制作一种HP-HA-肝ECM水凝胶,寻找到一种具有生物活性、能缓释生长因子、能够自组装和三维培养的生物支架材料,为后续三维构建组织工程化涎腺类器官的研究打下基础。
1 材料与方法
1.1 实验动物
动物来源8周龄20只雌、雄性SD大鼠由第三军医大学动物中心提供,雌鼠平均体重250 g,雄鼠平均体重300 g,动物许可证号:SCXK(渝)2012-0005,成年雌雄性大鼠交配后生产,按医学伦理学中对动物处置的标准进行相关操作。
1.2 试剂和仪器
DMEM/F12(SH30023.01B,Hyclone,美国);胎牛血清 (16000-044,Gibco,美国);表皮生长因子(E5036)、胰岛素(91077C)、氢化可的松(614157)、转化生长因子、胃蛋白酶(P6887)(T9580,Sigma,美国);CK7抗鼠单克隆抗体(Aab181598)、α-淀粉酶抗鼠多克隆抗体(ab125230)、Alexa Fluor®488荧光二抗(ab150077,Abcam,英国);台式冻干机(VirTis,Bench-TopPro,美国),NuncTMLab-TekTMChamber Slide System(177445PK)、酶联免疫检测(1500,Thermo,美国)。
1.3 制备HP-HA-肝ECM水凝胶
无菌条件下切取健康大鼠肝脏,PBS液洗净血液,-80℃冰冻保存48 h。复温解冻,挑选质地匀称的部位,剪成1 cm3小块后用500 ml ddH2O,200 r/min震荡冲洗3 d,每天更换液体3次。再用2%TritonX-100冲洗4 d,每天更换2次液体。最后用ddH2O冲洗2 d,4℃冰箱保存。用HE染色及DAPI染色法鉴定大鼠肝脏ECM脱细胞的效果。冻干处理肝ECM 48 h后,冰冻球磨仪研磨,100 mg肝脏ECM粉末用1%胃蛋白酶溶液消化溶解48 h,3 000 r/min离心15 min,反复离心3次至上清液清澈,将得到的胶状混合物(即肝ECM成分)用0.22μm过滤器过滤,紫外线消毒,4℃保存。在室温下用双蒸水完全溶解Heprasil、Gelin-S、Extralink粉末形成2%、2%、4%溶液,2 h内以2∶2∶1比例充分混合,加入1/10比例的胶状肝ECM成分,充分混匀,30 min内完全成为凝胶状态。
1.4 下颌下腺细胞培养及分组
处死新生1 d的SD大鼠后,无菌条件下切取其下颌下腺腺体组织并保留部分导管,PBS液清洗,剥离周围纤维组织;将腺体剪切成3 mm3小块,PBS液清洗,以50块/瓶接种到用1%明胶包被的T25培养瓶,5%CO2、37℃孵育箱中培养4 h,待组织块完全贴壁后,再加入2 ml完全培养基;3 d后,查看组织块四周有无细胞爬出并贴壁,每2 d换液1次,控制胰酶消化时间法去除成纤维细胞,至贴壁达80%时以1∶2的比例传代,取第2代细胞用于后续步骤的检测。下颌下腺细胞接种于HP-HA-肝ECM水凝胶上为实验组,直接培养于96孔板或48孔板中为对照组。
1.5 免疫学方法鉴定α-淀粉酶及CK7的表达
免疫荧光化学方法鉴定α-淀粉酶的表达,免疫细胞化学方法鉴定CK7表达。以PBS液为阴性对照组。荧光显微镜及倒置相差显微镜保留影像学资料。
1.6 细胞毒性试验
包被组将100μl第2代大鼠下颌下腺细胞悬液滴加至包被胶表面并孵育4 h(37℃,5%CO2),待细胞贴壁后,用PBS液轻轻冲洗3次,洗去未贴壁及死亡的细胞,然后再次在每孔中加入HP-HA-肝ECM水凝胶,室温下交联1 h,在每孔中加入100μl完全培养基覆盖胶体表面,置于37℃的5%CO2培养箱中培养,每2 d换液1次。不包被组为对照组,细胞直接接种于96孔板中。每组设置5个平行孔,分别在培养的第1、3、5、7天时每孔加入20μl的CCK-8溶液,孵育4 h后,于酶标仪上测定A=490 nm时每孔的吸光度值,记录并比较。
1.7 细胞活力实验
同上述方法进行48孔板的包被、细胞的消化、接种、分组及培养。在培养的第1、3、5、7天,利用Live/Dead细胞染色法评估细胞存活情况。简述如下:等量的活、死细胞染色试剂均匀混合获得2×的Live/Dead染色母液,PBS液1∶1比例稀释获得Live/Dead工作液,吸弃原培养基,PBS液冲洗1次,加入染色剂后于室温下孵育15 min,因为胶体较厚,实验组孵育时间可延长至45 min。于荧光显微镜下拍照并比较。共重复3次。每次每组设置3个培养孔,拍照时每个培养孔以同样放大倍数随机选取3个不同视野分别拍照。计算死细胞比率。
1.8 统计学分析
2 结 果
2.1 大鼠肝脏ECM的HE及DAPI染色
脱细胞处理前,HE切片中细胞核蓝紫色、形态圆润,DAPI染色中可见亮蓝色细胞核,表明肝脏脱细胞处理前组织内有大量细胞。脱细胞处理后,HE及DAPI染色中细胞核消失,表明肝脏脱细胞处理后细胞脱除完全(图1)。
2.2 大鼠肝ECM成分的获取及交联获得HP-HA-肝ECM水凝胶

图1 肝脏脱细胞前后的比较 (×100)Fig 1 Comparison of the liver tissue before and after decellularization (×100)
经过脱细胞化、冻干、冰冻研磨、胃蛋白酶溶解后得到的胶状肝ECM成分(图2A)。该成分外观通透,无肉眼可见杂质,无明显异味(图2B)。成品肝素-透明质酸水凝胶,初始为均质白色固态,待完全溶解后为透明状液体。将两者交联得到HP-HA-肝ECM水凝胶,无色无味透明状,稍黏稠,30 min完全成为凝胶状态(图2C),分别包被于96孔板和48孔板中(图2D~E)。
2.3 新生SD大鼠下颌下腺细胞的形态学特征
原代培养第3天可见典型的上皮细胞贴壁,第4天时可见少量成纤维细胞,采用差速贴壁法去除成纤维细胞后可得到形态较为一致的下颌下腺细胞,第5天时于显微镜下观察见细胞呈多角形,边界清晰,排列呈鹅卵石样外观;培养至第14天时,可见细胞排列紧密,呈铺路石状,胞浆丰富,可见分泌颗粒(图3)。培养第14天时第1次传代。

图2 肝ECM成分的获取及交联Fig 2 The preparation of liver decellularized extracellular matrix and crosslink

图3 原代培养的SD大鼠下颌下腺细胞形态(A:×200;B:×400)Fig 3 Primaryly cultured submandibular gland cells of SD rat(A:×200;B:×400)
2.4 体外培养SD大鼠下颌下腺细胞免疫学鉴定
以α-淀粉酶和CK7作为下颌下腺细胞的标记蛋白。α-淀粉酶和CK7阳性表达的表现是下颌下腺细胞胞膜及胞质呈绿色荧光染色和棕色染色。α-淀粉酶免疫荧光染色和CK7免疫细胞化学染色结果PBS液作为阴性对照。第2代SD大鼠下颌下腺细胞阳性表达α-淀粉酶、CK7标记蛋白。对照组结果阴性(图4)。

图4 SD大鼠下颌下腺细胞α-淀粉酶和CK7免疫学鉴定(×400)Fig 4 Immunological identification ofα-amylase and CK7 in SMGCs (×400)
2.5 下颌下腺细胞在HP-HA-肝ECM水凝胶中的增殖情况
随时间延长,实验组和对照组下颌下腺细胞的增殖活性均先增加后降低。实验组在全部检测时间段内的细胞增殖活性高于对照组(P<0.05)。第5天,实验组细胞增殖活性高于对照组(P<0.05)(图5)。
2.6 下颌下腺细胞在HP-HA-肝ECM水凝胶中的存活情况
死细胞比率指某一具体时间点死亡细胞数目占细胞总数目的百分比。图6示实验组和对照组下颌下腺细胞在培养第1、3、5、7天时的存活情况。经Live/Dead细胞染色法染色后,异硫氰酸荧光素染色活细胞,表现为绿色荧光,德克萨斯红染色死细胞,表现为红色荧光。随时间延长,实验组和对照组活细胞数目逐渐增多,相同检测时间点时,实验组活细胞数目多于对照组。统计死细胞比率如图7。在1~7 d内,HPHA-肝ECM水凝胶组的死细胞比率低于对照组,差异有统计学意义。第5天和第7天时,实验组死细胞比率较对照组降低(P<0.05)。

图5 细胞的生长曲线Fig 5 The cell growth curves
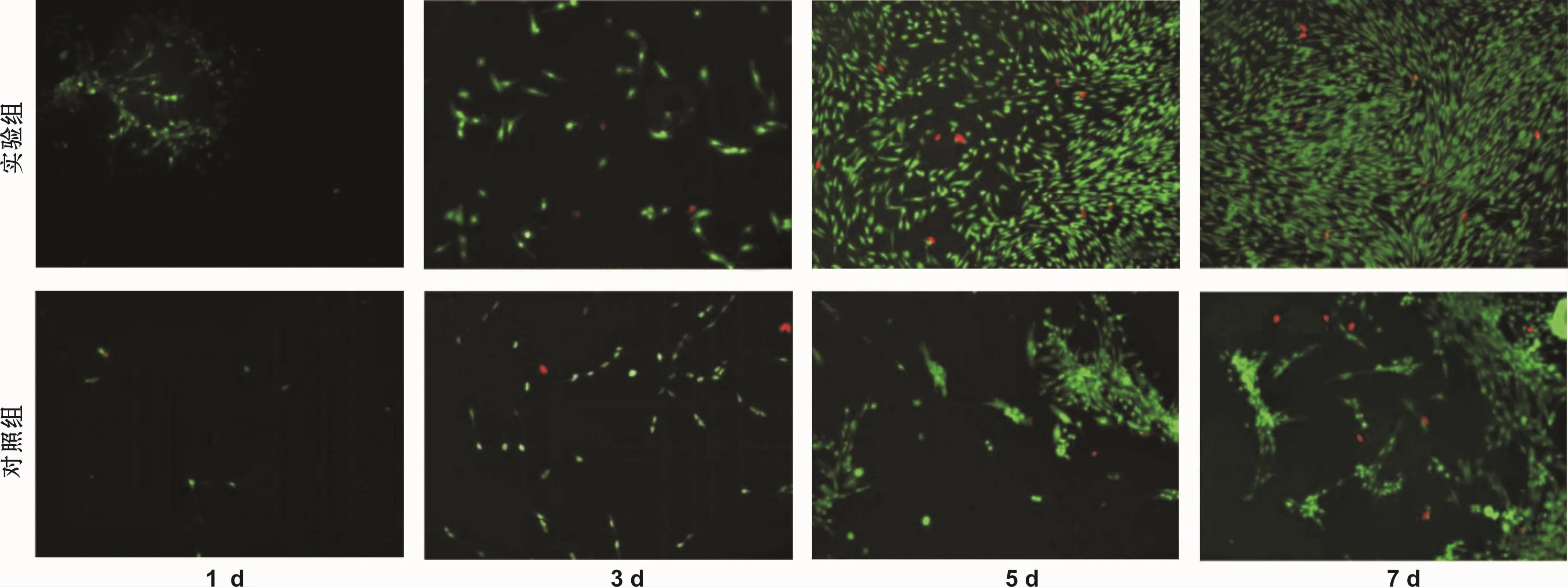
图6 下颌下腺细胞在HP-HA-肝ECM水凝胶材料上的存活情况 (Live/Dead细胞染色法,×100)Fig 6 The survival of SMGCs cultured on the HP-HA-liver ECM-hydrogel(Live/Dead Cell Imaging,×100)

图7 2组细胞的死细胞比率Fig 7 The cell death ratio of the 2 groups
3 讨 论
脱细胞方法是获得组织工程学再造器官天然生物支架的一种重要方法,发挥着不可替代的作用。目前,采用物理、化学和生物制剂等脱细胞技术制取的生物支架已广泛应用于组织工程领域,但是不同脱细胞方法对ECM的结构及其细胞外基质本身含有的生长因子及蛋白保存的影响却不一样。本研究的脱细胞方法采用了对ECM成分、结构影响较小的冷冻复融法[9-11]、TritonX-100[12]和胃蛋白酶[13],避免了SDS[14]等其他方法破坏ECM结构、溶解ECM成分。大量ddH2O辅助冲洗、低温的设置、抗生素的使用等均有利于在保留肝脏原有ECM结构及蛋白成分的同时去除细胞成分。用HE染色及DAPI染色鉴定脱细胞效果,HE及DAPI染色图均表明:处理前肝组织内含有大量细胞,但脱细胞处理后细胞脱除完全,为后期HP-HA-肝ECM水凝胶的制备奠定了基础。
本研究后续步骤采用冻干、冰冻球磨仪低温研磨、胃蛋白酶溶解消化、高速离心方法获得凝胶状肝ECM成分。相比于肝脏ECM粉末,该凝胶状态肝ECM更能充分融合并交联肝素-透明质酸水凝胶,从而有利于充分发挥2种胶体材料的优势。有研究发现,肝素的缓释作用[15-16]和透明质酸水凝胶的载体效应[17-18]在理论上均应有利于该ECM水凝胶材料激活脱细胞化肝脏ECM中的生长因子和蛋白基质成分并发挥其营养作用[7,19]。
通过分析改良脱细胞方法和肝素透明质酸水凝胶作用后,认为HP-HA-肝ECM水凝胶作为三维构建组织工程化涎腺类器官的支架材料具备较多优越性。生物相容性[20]是生物材料研究中始终贯穿的主题。细胞相容性是其中的一个方面,它是指宿主细胞对生物材料产生反应的一种性能。细胞相容性一般要求材料应该具有细胞黏附性、细胞激活性和抗炎症性、无诱变性、无抗原性、无致癌性、无抑制细胞生长性、无致畸性等等。目前检测细胞相容性的研究方法有:过敏实验、细胞毒性实验、显性致死实验、植入实验(皮下植入实验、骨内植入实验)、遗传毒性和致癌实验等等。本实验中CCK8法检测细胞增殖能力,考察的是支架材料是否会抑制细胞生长、有无细胞毒性;Live/Dead细胞染色法检测了细胞的存活情况,考察的是生长于支架材料上的细胞的存活情况。CCK-8结果中,下颌下腺细胞接种于HP-HA-肝ECM水凝胶后,在全部检测时间段内的细胞增殖活性高于对照组(P<0.05),表明HP-HA-肝ECM水凝胶有助于提高细胞增殖活性。Live/Dead细胞染色法结果中,下颌下腺细胞接种于HP-HA-肝ECM水凝胶后,在全部检测时间段内死细胞比率低于对照组(P<0.05),表明HP-HA-肝ECM水凝胶有助于降低死细胞比率。以上2个实验结果均表明:HP-HA-肝ECM水凝胶有助于下颌下腺细胞的存活并提高其增殖活性,降低死细胞比率。这表明HP-HA-肝ECM水凝胶材料具有细胞相容性。所以综上所述,自制的HP-HA-肝ECM水凝胶具有细胞相容性,为涎腺类器官的构建提供了理想的支架材料。
有研究表明Triton X-100灌注法制备大鼠肝脏ECM支架比SDS灌注法更能保留GAGs和胶原成分,体内植入后亦有更好的胶原纤维重塑反应[21];王雷等用细胞外基质Ⅰ型胶原蛋白免疫荧光染色和苦味酸-天狼星红染色证实,大鼠肝脏灌注Triton X-100能在完全脱除细胞的同时有效保留肝脏ECM中的胶原成分[22-23]。所以,下一步本研究将对自制的HP-HA-肝ECM水凝胶中含有的生物活性因子及蛋白质进行检测,如对细胞外基质中的胶原蛋白、GAGs和弹性蛋白进行定量或半定量分析,比较肝脏脱细胞前、后ECM中生物活性成分含量的变化。另外,本研究将对该ECM水凝胶体三维构建组织工程化涎腺类器官的可能性及能力进行评估。希望获得细胞相容性良好、具有生物活性、有利于种子细胞自组装和三维培养的理想细胞外基质支架材料,为组织工程化涎腺类器官三维构建的研究打下基础。
