大黄素对慢性牙周炎模型大鼠牙周膜细胞生物学特性的影响
2019-12-05徐梅牛玉明梁守建陈德森
徐梅 牛玉明 梁守建 陈德森
慢性牙周炎约占牙周炎患者的95%,是由长期存 在的牙龈炎向深部牙周组织扩展而引起的最常见的一类牙周炎,其主要的病理改变为牙周袋和牙槽骨吸收[1]。牙周致病菌滋生是导致牙龈炎的主要病因,而牙龈炎可逐渐、隐匿地过渡成牙周炎,导致牙齿与牙龈分离,严重者造成牙齿松动甚至脱落,降低了患者生活质量,严重威胁患者口腔健康,且近年来其发病率呈现增加趋势[2]。因此,提高患者生活质量,早期发现和诊断,防止牙槽骨吸收十分重要。治疗慢性牙周炎的关键是促进牙周膜细胞增殖、增加细胞活性,抑制牙周膜细胞炎症因子释放。牙周膜细胞即能合成胶原、亦可降解胶原,能够不断分化成成骨细胞而形成新的主纤维和牙骨质,对牙槽骨改建、创伤修复和牙周再生中发挥重要作用,牙周膜细胞是牙周组织中的主要功能细胞[3]。故在对慢性牙周炎治疗中,除应用抗生素、治疗牙周袋、修复遭到破坏的牙槽骨外,还应注重牙周膜细胞的再生功能。大黄素是从掌叶大黄的根茎中提取的生物碱,具有抗炎、抗肿瘤、抗微生物生长、免疫抑制等作用,目前已有研究证实其可通过抑制炎症因子而治疗牙周炎[4]。但大黄素是否对牙周膜细胞的再生功能产生影响却鲜有报道,本研究采用牙周结扎并在牙龈涂布卟啉单胞菌混悬液的方法建立大鼠慢性牙周炎模型,观察大黄素牙周膜细胞的生物学特性的影响,为寻找治疗慢性牙周炎潜在的有效药物提供实验和理论依据。
1 材料与方法
1.1 动物和分组
SPF级SD大鼠30只,雌雄不拘,体质量180~200 g,动物购自北京维通利华实验动物技术有限公司。在进行实验时,所进行的动物实验应符合伦理学原则,按实验动物3R原则,给予SD大鼠人道关怀。本实验在湖北省随州市中心医院动物实验中心标准实验室进行实验,动物使用合格证编号:SCXK(京)2017-019;实验室设施合格证编号:[SYXK(鄂)2018-001]。实验时选取其中20只正常健康大鼠构建慢性牙周炎模型并随机均分为模型组和大黄素组(n=10),另10只正常健康大鼠不造模,设为对照组。
1.2 主要药品及试剂
大黄素标准品(批号:B10249,上海士锋生物科技有限公司);过氧化物酶体增殖物激活受体γ(peroxisome proliferators-activated receptors-γ,PPAR-γ)和牙龈组织核因子 κB(Nuclear factor kappa B,NF-κB)检测试剂盒(批号:H0347和0315,上海超研生物科技有限公司);牙周膜组织中白介素-6(interleukin-6,IL-6)、白介素-8(interleukin-8,IL-8)和白介素-1β(interleukin-1β,IL-1β)酶联免疫吸附试验(ELISA)检测试剂盒(批号:4361、4325和4327,上海信裕生物科技有限公司);流式细胞仪(贝克曼库尔特中国分公司,美国);酶联检测仪(Bio-Rad公司,美国)。
1.3 方法
1.3.1 大鼠慢性牙周炎模型的建立 模型建立采用牙周结扎后手术区域牙龈涂布卟啉单胞菌混悬液的方法。在牙周结扎手术前,大鼠禁食1 d,不禁水。用3%戊巴比妥钠腹腔注射(0.25 ml/kg)全麻大鼠,于上颌第一、二磨牙牙周行8字交叉结扎,术后1周后开始在手术区域牙龈涂布卟啉单胞菌混悬液,间隔2 d涂药1次,共涂菌15~20次(约8~10周)至第一、二磨牙牙间隙增宽、牙根分叉暴露,牙槽出现严重骨吸收为牙周炎模型建模成功标准[5]。然后拆除第一、二磨牙结扎丝,开始进行药物治疗实验。
1.3.2 治疗 治疗前先将大黄素配制成0.5%的溶液,根据人与实验动物用药换算公式计算大鼠大黄素的用药剂量。大黄素组的用药剂量为每日2 ml/kg,采用灌胃给予大黄素的方法治疗,模型组和对照组正常饲养,每鼠灌胃给予0.9%生理盐水(2 ml/kg)对照。所有动物均按上述灌服给药方法治疗2周。
1.3.3 流式细胞术(flow cytometry,FCM)检测牙周膜细胞周期 处死大鼠后摘取上颌第一、二磨牙,小心刮取牙周组织制成组织匀浆,常规胰酶消化法收集匀浆悬液牙周膜细胞细胞,用500μl Buffer A(5 g/LBSA,100 mml/L PBS)重悬,洗涤2次,加300μl细胞染色液(含RNase A 50μg/ml,PI 25μg/ml)吹匀,4℃避光温孵30 min,然后用流式细胞仪检测牙周膜细胞周期,用Cell Quest析软件分析各组G1/G0、G2/M、S、G2+S细胞所占百分率。
1.3.4 Western blotting检测牙周膜组织PPAR-γ和NF-κB表达 取上述牙周组织制成组织匀浆,3 000 r/min离心10 min,取上清,-80℃冰箱冻存备测。按试剂盒说明书操作,先提取总蛋白,经SDS分离后转移至PVDF膜;加入兔抗人PPAR-γ和NF-κB抗体,用封闭缓冲液封闭非特异性结合位点,室温1 h,振摇,4℃过夜。TBST室温洗膜2次,每次10 min;加二抗,在链霉亲和素-偶联物即链霉亲和素-POD中孵育;在大容量的TBST中洗膜4次,每次15 min;在DAB中室温孵育5~15 min;设定酶标仪波长为450 nm,读取样品A值,使用Curve expert 1.3软件绘制标准曲线:以A值为纵坐标、标准品的浓度为横坐标绘出标准曲线,计算PPAR-γ和NF-κB浓度。
1.3.5 ELISA检测牙周膜细胞IL-6、IL-8和IL-1β浓度 取上述牙周组织制成组织匀浆,离心(3 000 r/min)10 min,取上清,-80℃冰箱冻存备测。离心管中加稀释标准、轻轻振荡使之充分混匀。设96孔,每孔准确加入100μl标准品,室温下孵育2 h。准确加入100μl用Assay Dliuent稀释的备测样本。加一抗后吸出标准品稀释液,加入300μl 1×wash buffer,振荡、冲洗3次。加入100μl detection antibody solution。密封孔板后于室温下孵育2 h。然后加链霉亲和素-辣根过氧化物酶的生物素标记过夜,吸出Detection antibody solution,洗板,加100μl稀释的streptavidin-HRP solution室温下孵育,30 min后吸出streptavidin-HRPsolution,然后洗板4次。加100μl底物室温避光孵育30 min至变色,迅速加入终止液100μl,30 min后移至Bio-Rad酶标仪,酶标仪波长设置为540 nm,读取样本吸光度A值,以标准品浓度为横坐标,A值为纵坐标绘制出标准曲线计算出IL-6、IL-8和IL-1β的浓度。
1.4 统计学处理
2 结 果
2.1 大黄素对大鼠牙周膜细胞周期的影响
FCM检测显示模型组牙周膜细胞G1/G0和G2/M较对照组明显升高,而S和G2+S明显降低(P<0.05),提示模型组大鼠牙周膜细胞增殖放缓,细胞活力降低,细胞增殖在S期和G2期分化增殖受阻。大黄素组牙周膜细胞G1/G0和G2/M较模型组明显降低,而S和G2+S明显升高(P<0.05),与模型组比较均有统计学意义。提示大黄素治疗,大鼠牙周膜细胞细胞活力增强,S期和G2期分化增殖速度增快(表1)。
表1 各组大鼠牙周膜细胞周期分布比较 (n=10,%,)Tab 1 Comparison of periodontal ligament cell cycle distribution of the rats among groups(n=10,%,)

表1 各组大鼠牙周膜细胞周期分布比较 (n=10,%,)Tab 1 Comparison of periodontal ligament cell cycle distribution of the rats among groups(n=10,%,)
注:①与对照组比较,P<0.05;②与模型组比较,P<0.05
+S对照组组 别 G1/G0 G2/M S G2 56.02±7.82 7.02±0.91 34.17±8.02 45.14±6.47模 型 组 75.19±8.06① 9.15±1.04① 14.84±1.63① 22.96±2.03①大黄素组 57.24±6.43② 6.87±0.81② 35.17±7.51② 43.64±5.86②
2.2 大黄素对大鼠牙周组织PPAR-γ和NF-κB表达的影响
Western blotting检测检测显示模型组牙周组织且PPAR-γ表达降低、而NF-κB表达增强,与对照组比较(P<0.05);而大黄素组牙周组织PPAR-γ高表达、而NF-κB低表达(P<0.05)(表2)。
2.3 大黄素对大鼠牙周组织IL-6、IL-8和IL-1β浓度的影响
与对照组比较,模型组牙周组织IL-6、IL-8和IL-1β浓度升高(P<0.05);而大黄素组IL-6、IL-8和IL-1β浓度降低(P<0.05),与模型组比较均有统计学意义(表2)。
表2 各组大鼠牙周组织PPAR-γ和NF-κB表达比较及IL-6、IL-8和IL-1β浓度比较(n=10,pg/ml,)Tab 2 Comparison of PPAR-γgamma and NF-κB expression and IL-6,IL-8 and IL-1βconcentrations in periodontal tissues of the rats among the groups (n=10,pg/ml,)
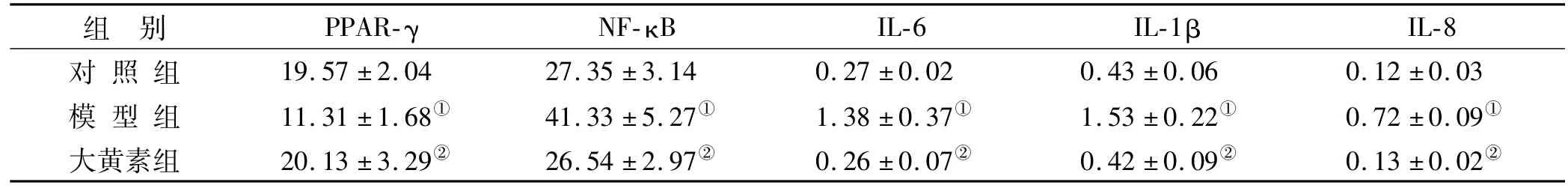
表2 各组大鼠牙周组织PPAR-γ和NF-κB表达比较及IL-6、IL-8和IL-1β浓度比较(n=10,pg/ml,)Tab 2 Comparison of PPAR-γgamma and NF-κB expression and IL-6,IL-8 and IL-1βconcentrations in periodontal tissues of the rats among the groups (n=10,pg/ml,)
注:①与对照组比较,P<0.05;②与模型组比较,P<0.05
组 别 PPAR-γ NF-κB IL-6 IL-1βIL-8对 照 组 19.57±2.04 27.35±3.14 0.27±0.02 0.43±0.06 0.12±0.03模 型 组 11.31±1.68① 41.33±5.27① 1.38±0.37① 1.53±0.22① 0.72±0.09①大黄素组 20.13±3.29② 26.54±2.97② 0.26±0.07② 0.42±0.09② 0.13±0.02②
3 讨 论
慢性牙周炎一类严重威胁类口腔健康的牙周病,因牙周炎可导致牙齿与牙龈分离造成牙齿松动甚至脱落而影响进食,是造成患者营养不良的重要病因,对其治疗的关键是促进患者牙周膜细胞增殖、使牙周组织再生,形成牙周新附着,因此,如何使牙周膜细胞快速增殖和分化并有效的附着在根面是治疗的关键所在[6-7]。
本研究发现,大黄素可促进牙周膜细胞快速增殖和分化,增强牙周膜细胞活力,表现在G1/G0和G2/M较模型组明显降低,而S和G2+S明显升高。牙周膜细胞的增殖是通过细胞周期来实现的,细胞周期是指从一次细胞分裂形成子细胞开始到下一次细胞分裂形成子细胞为止所经历的过程。整个细胞周期分为DNA合成前期(G1期)、DNA合成期(S期)、DNA合成后期(G2期)和M期(细胞分裂期)4个阶段。其中S和G2+S是DNA合成的关键时期,处于此阶段的细胞增殖旺盛,其比例在细胞周期中较高[8]。因此,S和G2+S在细胞周期中可客观地反映细胞增殖能力和活力[9]。有研究表明,大黄素可通过抑制内毒素而促进牙周膜细胞增殖[10]。但目前没有实验证实其是否是通过影响S和G2+S期而增强牙周膜细胞增殖能力和活力。本实验观察到:大黄素组S和G2+S分别为(35.17±7.51)%和(43.64±5.86)%,明显高于模型组的(14.84±1.63)%和(22.96±2.03)%,这一结果提示经大黄素治疗,大鼠牙周膜细胞细胞活力增强,S期和G2期分化增殖速度增快。
本研究还发现,大黄素组牙周组织PPAR-γ高表达、而NF-κB低表达,IL-6、IL-8和IL-1β浓度较模型组明显降低。研究表明,牙周炎患者体内NF-κB长期处于高激活状态,而NF-κB又可促进炎性细胞因子IL-6、IL-8和IL-1β的产生,造成骨与牙周组织破坏增强,故抑制NF-κB活性可减少炎性细胞因子IL-6、IL-8和IL-1β的产生,降低后者对骨与牙周组织的破坏[11]。大黄素可能作用于NF-κB信号通路,抑制NF-κB活性,间接减少炎性细胞因子IL-6、IL-8和IL-1β的产生而发挥保护牙周组织炎症创面的作用[12]。PPAR-γ是核激素受体家族中的配体激活受体,PPAR-γ与配体结合后调节多种核内靶基因转录,参与程序性细胞死亡及细胞分化的发生发展[13]。PPAR-γ还可通过调控NF-κB信号通路而实验现抑制炎性细胞因子(如IL-6、IL-8和IL-1β)的产生,提高PPAR-γ表达能显著抑制炎性细胞因子的基因表达,这对牙周炎的治疗具有重要意义[14]。本实验发现大黄素具有上调PPAR-γ表达的作用,降低NF-κB表达,并通过降低NF-κB表达而抑制子IL-6、IL-8和IL-1β的产生,从而实现调控炎症反应的作用。
总之,大黄素可能通过促进大鼠牙周膜细胞S期和G2期分化和增殖速度,增加细胞活性,并通过提高PPAR-γ信号通路下调NF-κB表达,进而抑制牙周膜细胞炎症因子IL-6、IL-8和IL-1β的表达而降低牙周组织炎症反应,发挥对慢性牙周炎的治疗作用。本实验的重要发现是观察到大黄素可促进牙周膜细胞的再生功能,这对临床治疗慢性牙周炎具有后果要意义,为治疗慢性牙周炎提供了实验和理论依据。
