大黄素对高脂血症斑马鱼脂质代谢的作用研究
2019-12-05代旭阳龚莉虹余琳媛胡乃华李芸霞
王 成,代旭阳,龚莉虹,余琳媛,胡乃华,李芸霞
成都中医药大学药学院 教育部中药材标准化重点实验室 中药资源系统研究与开发利用省部共建国家重点实验室培育基地,成都611137
近年来,随着人们生活水平的提高和饮食习惯的改变,高脂血症(hyperlipidemia,HLP)已逐渐成为危害人类健康的“第一杀手”。在古代,虽没有对“HLP”的明确记载,但早在《黄帝内经》中已有关于“脂”的描述,如“脂者”、“脂膜”、“油脂”等,甚至还用“膏人”、“肥人”等词来形容血脂过高的人[1]。古代中医认为,HLP是脏腑的运输、疏泄、宣发等生理功能失调而引起的,致使体内津液集聚,痰湿化生,流注经脉,渗入血中[2]。现代医学认为,HLP是由于血液中血胆固醇(total cholesterol,TC)和/或甘油三酯(triglyceride,TG)水平异常升高而引起的一种的脂质代谢紊乱[3],主要分为高胆固醇血症、高甘油三酯血症和混合性高脂血症[4]。目前对于HLP的治疗首选他汀类药物,但随着长时间的服用,其以转氨酶升高为特征的肝损害和以肌酸激酶升高为特征的横纹机溶解等副作用也逐渐凸显出来。然而,一些天然产物,特别是我国具有高效低毒的传统降脂中药,因具有多靶点、多途径和多环节的作用而受到了格外的关注。因此,本研究将探讨其毒副作用很小的大黄素对脂质代谢紊乱的改善作用。
大黄素(1,3,8-trihydroxy-6-methylanthraquinone,emodin)是一种天然的橙黄色长针状结晶的游离蒽醌衍生物,广泛存在于何首乌、大黄、虎杖、芦荟等中药材中。目前,大黄素已被证明具有广泛的药理作用,如抗炎[5]、抗癌[6]、抗菌、保肝、抗糖尿病、抗骨质疏松、抗血小板聚集以及神经保护[7]等作用。近年来,随着人们对大黄素的深入研究,越来越多的文献报道,大黄素还具有降脂、抗氧化应激和抗AS等作用,并且大量研究已经证实大黄素可作为治疗HLP和AS的有效物质基础。Fan等[8]通过高脂饮食诱导金黄地鼠来研究大黄素对脂质代谢紊乱的作用。结果表明,给予大黄素治疗28天后,血中TC、TG、LDL-c水平显著降低,通过绘制脂蛋白谱和核磁共振代谢组学研究,成功发现大黄素可调节血清脂蛋白亚型的分布、调节高密度脂蛋白脂质运载能力和改善血浆内源性分子的代谢轮廓,提示大黄素具有改善高脂血症金黄地鼠的脂代谢紊乱的作用。

图2 喂养方案的实验大纲Fig.2 Experimental outline of the feeding protocol.
HLP的预防和治疗已成为亟待解决的难题之一,而对于研发高效低毒的降脂中药是需要一个合适的模型来进行研究。目前国内外常用于研究与脂质代谢相关的动物主要有大鼠、小鼠、家兔、豚鼠和金黄地鼠等[9],但近年来,随着一种新型模式生物—斑马鱼的兴起,用它作为药物筛选的模型被人们广为接受。斑马鱼是一种原产于南亚地区的热带硬骨鱼,因其基因组序列与人类有着87%的高度相似性[10],体积小,胚胎透明,易于大规模饲养,繁殖能力强和实验周期短,被广泛作为高通量筛选药物的经典模型[11]。又因其血脂构成、脂质吸收、脂质代谢、器官和组织与人类基本一致,近年来被大量应用在与脂质代谢和脂质异常相关的疾病研究中,如HLP、动脉粥样硬化(atherosclerosis,AS)、脂肪肝(fatty liver disease,FLD)、糖尿病(diabetes mellitus,DM)等,是研究单体中药降血脂作用的理想模式生物[12]。根据课题组前期对大黄素最大耐受浓度(maximum tolerated concentration,MTC)的摸索[13],发现大黄素在斑马鱼幼鱼上的MTC为0.73 μg/mL,随后以0.1 μg/mL的等梯度浓度进行预实验,发现大黄素浓度在0.1~0.5 μg/mL对斑马鱼脂代谢紊乱有改善作用,所以最终选择了0.125、0.25、0.5 μg/mL的大黄素作为后续实验的低、中、高浓度。因此,本文通过复制HLP的斑马鱼为模型生物,研究大黄素对HLP斑马鱼脂质代谢的作用,以期为HLP的相关机制研究和大黄素的开发利用提供新的思路。
1 实验材料和仪器
1.1 实验动物
野生型AB品系斑马鱼由成都中医药大学药学院斑马鱼实验室提供,转基因血管荧光斑马鱼Tg(fli1:eGFP)购于国家斑马鱼资源中心。所有成年斑马鱼在北京爱生公司斑马鱼养殖系统中养殖,水温28 ℃,pH值7.4,电导率400~600 μs/cm。每日喂养两次,日光灯照射14 h,黑暗环境10 h。其余饲养和繁殖条件参照Zebrafish Book。斑马鱼的实验遵循成都中医药大学动物保护协会和使用委员会的要求。欲得实验所需的斑马鱼仔鱼,于实验开始前1天下午,选用健康性成熟的雌雄斑马鱼,按照♀∶♂=1∶1~2的数量移入产卵盒,并用透明隔板将雌雄斑马鱼隔开,于次日9时移去隔板,待雄鱼追逐雌鱼1 h后收集胚胎。收集到的胚胎用培养液清洗干净后移入无菌培养皿,放置于28 ℃恒温培养箱中,每天更换清洁水。待受精卵孵育至5 dpf(days post fertilization),挑选出健康的个体进行后续实验。
1.2 实验试药
大黄素购于成都曼思特生物科技有限公司,批号为MUST-18110810,纯度为98.73%。
1.3 实验试剂
斑马鱼幼鱼饲料(邰港科技股份有限公司,批号为20171115);胆固醇(美国Amresco公司,批号为57-88-5);Cholesteryl BODIPY®542/563 C11(美国Thermo scientific公司,批号为2000227);TC、TG、LDL-c、HDL-c测定试剂盒(南京建成生物工程研究所,批号分别为20190322、20190322、20190321、20190321);无水乙醚(成都市科龙化工试剂厂,批号为20110117);二甲基亚砜(广州赛国生物科技公司,批号为EZ1609C224);无水乙醇(四川西陇科学有限公司,批号为180904)等。
1.4 实验仪器
Olympus激光共聚焦显微镜(FV-OSR型,日本奥林巴斯公司);酶标仪(Multiskan Mk3型,美国Thermo scientific公司);电子分析托盘天平(Sartorius 11D型,德国Sartorius公司);离心机(ALLEGER X-12型,美国BECKMAN Coulter公司);涡旋震荡器(BP-2 Vortex-Genie 2型,美国Scientific Industries公司)等。
2 实验方法
2.1 饲料配制
2.1.1 高胆固醇饲料的配制
将普通斑马鱼幼鱼饲料浸没于溶解有一定量胆固醇的无水乙醚中,充分搅拌至乙醚完全挥发,使胆固醇附于普通饲料上,制备成含4%(w/w)的高胆固醇饲料[14]。
2.1.2 荧光探针饲料的配制
将荧光探针(荧光标记的胆固醇乙脂类似物:Cholesteryl BODIPY®542/563 C11)溶解于无水乙醚中,按照10 μg/g的比例,分别添加到普通饲料和高胆固醇饲料中即可。由于荧光标针对光比较敏感,所以此饲料的配制应尽可能在黑暗的环境中操作。
2.2 斑马鱼分组及给药方案
为了获得斑马鱼幼鱼的活体成像图片,待胚胎发育至20 hpf时以及之后的整个实验周期中,在饲养用水中添加0.03 g/L的1-苯基-2-硫脲(1-phenyl-2-thiourea,PTU),以抑制斑马鱼胚胎中黑色素的生成。每日定时更换新鲜的PTU培养水,并及时将死卵和卵壳清除。待Tg(fli1:eGFP)受精卵孵育至5 dpf时,挑选出健康的个体,随机分为普通饲料组(normal cholesterol diet,NCD),高胆固醇饲料组(high cholesterol diet,HCD),大黄素低、中、高剂量组(Emo-L、Emo-M、Emo-H组),于6孔板中饲养,每孔50尾仔鱼,每组设置3个复孔。正常对照组饲喂添加有荧光探针的普通饲料,高胆固醇模型组饲喂添加有荧光探针的高胆固醇饲料,给药组饲喂添加有荧光探针的高胆固醇饲料且在每天早上分别加入不同浓度的大黄素,即Emo-L、Emo-M和Emo-H组分别添加0.125、0.25、0.5 μg/mL的大黄素。各组斑马鱼每天定时定量投喂饲料2次,定时换水1次,连续喂养10天。
2.3 存活率观测
分别于造模给药后10天内,观察并记录各组斑马鱼的存活尾数,计算其百分率。
2.4 体重、体长和体质量指数(body mass index,BMI)测量
用三卡因溶液将幼鱼麻醉,用吸水纸将幼鱼表面水吸干,在分析天平中称量各组斑马鱼的体重并记录。用游标卡尺测量幼鱼头部最前端到鱼尾最末端距离,这段长度代表幼鱼体长,BMI为体质量(mg)除以体长(cm)的平方所得的数值。
2.5 斑马鱼幼鱼血管胆固醇含量测定
实验结束后,从每组中随机取8尾幼鱼,置于激光共聚焦显微镜下观察胆固醇在斑马鱼幼鱼血管中的积累情况并拍照。为了保证斑马鱼在拍摄过程中是存活的,需要将斑马鱼幼鱼麻醉并固定在含有0.02%三卡因的0.5%低熔点琼脂糖中。显微拍摄时,以斑马鱼幼鱼血管处的的泄殖腔为左侧边界,放大100倍。拍摄的所有照片均设置相同的参数,以便后续对荧光的强度进行定量分析。
2.6 斑马鱼幼鱼脂质代谢生化指标测定
在实验终止阶段,将每组30尾斑马鱼长时间暴露在高浓度的三卡因溶液中至安乐死,并将动物腹中未消化的食物清除。将斑马鱼幼鱼按体质量(g)∶体积(mL)=1∶9的比例,加入9倍量体积的无水乙醇,在冰水浴条件下机械匀浆,2 500 rpm,离心10 min,吸取上清液,按照TC、TG、LDL-c和HDL-c试剂盒说明书,测量幼鱼体内总胆固醇、甘油三酯、低密度脂蛋白胆固醇和高密度脂蛋白胆固醇的浓度。
2.7 斑马鱼幼鱼动脉粥样硬化指数的测定
根据每组计算出来的幼鱼体内的总胆固醇浓度和高密度脂蛋白胆固醇浓度,利用以下公式,计算出各组斑马鱼幼鱼的动脉粥样硬化指数。
动脉粥样硬化指数(AI)=(TC-HDL-c)/HDL-c
2.8 图像分析
各组斑马鱼幼鱼均在Olympus激光共聚焦显微镜下成像。红色通道:559 nm,绿色通道:488 nm,并利用奥林巴斯自带的图像分析软件对斑马鱼幼鱼尾动脉的平均荧光密度(mean fluorescence intensity,MFI)进行分析。
2.9 数据统计与分析

3 实验结果
3.1 存活率观测
对不同组别斑马鱼幼鱼生长和死亡情况进行分析,可以看出NCD组生长正常,体表色素正常,基本无死亡。HCD组,因连续饲喂10天高胆固醇饲料,致使该组死亡率上升。给药组死亡率明显低于HCD组,活动度增强。各组存活率如图3所示,与NCD组相比,HCD组幼鱼存活率极显著性降低(P<0.001);与HCD组相比,Emo-L组幼鱼存活率显著性升高(P<0.01);Emo-M组、Emo-H组幼鱼存活率均极显著性升高(P<0.001)。

图3 不同浓度的大黄素对高胆固醇血症斑马 鱼存活率的影响Fig.3 Effects of different concentrations of emodin on survival rate in hypercholesterolemic zebrafish 注:与NCD组比较,###P<0.001;与HCD组比较,**P<0.05,**P<0.01,***P<0.001。Note: Compared with the NCD group,###P<0.001; Compared with the HCD group,*P< 0.05,**P<0.01,***P<0.001.
3.2 体重、体长和BMI测定
如表1所示,与NCD组相比,HCD组幼鱼体重、体长极显著性增加(P<0.01);与HCD组相比,Emo-L组、Emo-M组、Emo-H组幼鱼的体重、体长均极显著性降低(P<0.01),且Emo-H组幼鱼的BMI与NCD组有极显著性差异(P<0.01)。

表1 各组斑马鱼幼鱼喂养10天后体重、体长、BMI变化Table 1 Changes in body weight,body length and BMI of zebrafish larvae after 10 days of feeding in each
注:与NCD组比较,##P<0.01,###P<0.001;与HCD组比较,**P<0.01,***P<0.001。
Note: Compared with the NCD group,##P<0.01,###P<0.001; Compared with the HCD group,**P<0.01,***P<0.001.
3.3 大黄素对斑马鱼幼鱼血管胆固醇积累的影响
如图4、图5和表2所示,利用高胆固醇-荧光探针饲料连续喂食斑马鱼幼鱼10 d后,与NCD组相比,HCD组幼鱼血管中胆固醇水平升高7.46倍(P<0.001)。结果表明可以利用高胆固醇-荧光探针饲料饲喂斑马鱼幼鱼来进一步研究体内胆固醇的积累情况。不同浓度大黄素处理10天后,与HCD组相比,Emo-L组,Emo-M组和Emo-H组分别降低血管胆固醇18.57%(P<0.01),49.21%(P<0.001),73.53%(P<0.001)。结果表明大黄素对高胆固醇诱导的高胆固醇血症斑马鱼幼鱼血管胆固醇含量有一定的改善作用。

图4 大黄素对高胆固醇血症斑马鱼血管胆固醇累积的影响(×100)Fig.4 Effects of emodin on vascular cholesterol accumulation in hypercholesterolemic zebrafish(×100) 注:A:Fli1:eGFP斑马鱼幼鱼荧光图。箭头:尾动脉,三角:泄殖腔。荧光密度测量从泄殖腔开始,也就是矩形所标记的位置。绿色荧光为血管,红色荧光为磷脂标记的胆固醇,绿色通道:488 nm,红色通道:559 nm。B:各组斑马鱼幼鱼血管脂质堆积情况。斑马鱼幼鱼尾动脉荧光密度图,侧面视图,背部朝上。红色荧光为磷脂标记的胆固醇,红色通道:559 nm。Note: A: Fluorescent image of Tg (fli1:eGFP) zebrafish larvae.Arrow: caudal artery; triangle: cloaca.Fluorescence intensity was measured from the cloacal,the position marked by the rectangle.Blood vessel is shown green fluorescence and while lipid (cholesterol) is in red.Green channel: 488 nm; Red: 559 nm.B: Lipid accumulation in blood vessels of zebrafish larvae in each group.Fluorescence images of the artery were shown from tested groups in zebrafish larvae.Lateral views,dorsal is up.The red fluorescence is the phospholipid labeled cholesterol.Red: 559 nm.

表2 大黄素对高胆固醇血症斑马鱼血管胆固醇累积的影响Table 2 Effects of emodin on vascular cholesterol accumulation in hypercholesterolemic zebrafish(n=
注:与NCD组比较,###P<0.001;与HCD组比较,*P<0.05,**P<0.01,***P<0.001。
Note: Compared with the NCD group,###P<0.001; Compared with the HCD group,*P<0.05,**P<0.01,***P<0.001.
3.4 大黄素对斑马鱼幼鱼TC、TG、LDL-c和HDL-c的影响
如表3所示,与NCD组相比,HCD组幼鱼TC、TG、LDL-c和HDL-c水平均极显著性升高(P<0.01);与HCD组相比,Emo-L组幼鱼的TC和LDL-c水平分别下调24.28%(P<0.001),44.89%(P<0.01),HDL-c水平上升188.46%(P<0.05),TG水平变化不显著;Emo-M组幼鱼的TC和LDL-c水平分别下调30.76%(P<0.001),51.39%(P<0.01),HDL-c水平上升334.62%(P<0.001),TG水平变化不显著;Emo-H组幼鱼的TC、TG和LDL-c水平分别下调39.90%(P<0.001),56.23%(P<0.01),51.39%(P<0.01),HDL-c水平上升403.85%(P<0.001)。结果表明大黄素具有一定的降血脂和降胆固醇作用。

图5 大黄素对高胆固醇血症斑马鱼血管 胆固醇累积的影响(n= 8)Fig.5 Effects of emodin on vascular cholesterol accumulation in hypercholesterolemic zebrafish(n= 8) 注:与NCD组比较, ###P<0.001;与HCD组比较,**P<0.01,***P<0.001。Note: Compared with the NCD group,###P< 0.001; Compared with the HCD group,**P<0.01,***P<0.001.
3.5 动脉粥样硬化指数
如图4所示,与NCD组相比,HCD组幼鱼AI极显著性升高(P<0.001);与HCD组相比,Emo-L组,Emo-M组和Emo-H组幼鱼的AI均极显著性降低(P<0.001)。结果表明,大黄素能降低高胆固醇血症斑马鱼的动脉粥样硬化指数。

表3 大黄素对高胆固醇血症斑马鱼TC、TG、LDL-c和HDL-c的影响Table 3 Effects of emodin on TC,TG,LDL-c and HDL-c in hypercholesterolemic 30)
注:与NCD组比较,##P<0.01,###P<0.001;与HCD组比较,*P<0.05,**P<0.01,***P<0.001。
Note: Compared with the NCD group,##P<0.01,###P<0.001; Compared with the HCD group,*P<0.05,**P<0.01,***P<0.001.
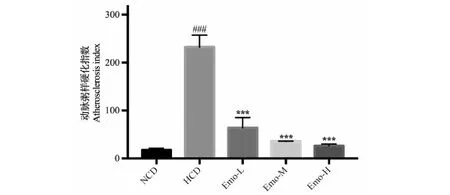
图6 大黄素对高胆固醇血症斑马鱼动脉 粥样硬化指数的影响(n = 30)Fig.6 Effect of emodin on atherosclerosis index in hypercholesterolemic zebrafish(n = 30) 注:与NCD组比较,###P<0.001;与HCD组比较,***P<0.001。Note: Compared with the NCD group,###P<0.001; Compared with the HCD group,***P<0.001.
4 讨论
随着饮食结构和交通方式的转变,HLP的发病率呈逐年上升趋势。长期高脂高胆固醇饮食会打破机体脂质吸收和消化之间的平衡关系,导致脂肪和胆固醇在血管内壁上过度沉积,形成粥样斑块,影响血流速度,进而产生一系列更为严重的心血管疾病。有研究表明,HLP是导致FLD、AS、DM、冠心病、脑梗死等多种疾病的首要病因。因此,及早进行预防和选用有效的降脂药是降低患者心血管事件发生的有效控制手段。开发和研究具有降脂作用的中药需要建立可靠的脂质代谢紊乱动物模型,目前国内外主要用豚鼠和金黄地鼠两种动物来建立HLP模型研究血脂代谢相关疾病[15],因其具有成本低、造模时间短等优点。随着新理论、新技术和新概念的出现,人们对高脂模型的要求随之提高。研究人员在进行研究时必须谨慎,因为某些模型的脂质代谢可能被证明与人类完全不同,因此就可能不适合用于筛选降血脂中药。目前,一种可以高通量筛选药物的生物模型—斑马鱼,因其具有身体透明、器官清晰可见和能够以高分辨率在体内对器官和生物过程进行非侵入性的可视化等优点,被人们广泛关注和使用。
Stoletov等[14]利用其上述特性,对活体高胆固醇血症斑马鱼幼鱼的血管脂质堆积、脂蛋白氧化和脂肪条纹的形成情况进行了实时的研究报道。因此,本研究通过饲喂斑马鱼幼鱼高胆固醇-荧光探针饲料(添加Cholesteryl BODIPY®542/563 C11)来复制HLP模型,在共聚焦显微镜下观察被标记的胆固醇(显微镜下表现为红色荧光)在斑马鱼幼鱼血管处的累积,进而研究大黄素对HLP斑马鱼脂质代谢紊乱的改善作用。研究结果表明,斑马鱼给予高胆固醇饲料10天后,幼鱼血管中胆固醇水平极显著升高,且大量沉积在血管附近,用不同浓度的大黄素处理10天后,幼鱼血管中胆固醇水平均极显著降低,减轻了胆固醇在血管附近的堆积,提示大黄素对高胆固醇血症斑马鱼幼鱼血管胆固醇含量和沉积有一定的改善作用。
目前临床上常用TC、TG、LDL-c和HDL-c作为检测HLP基本的指标。因此,本研究测定了这四种脂质水平,结果显示,斑马鱼给予高胆固醇饲料10天后,幼鱼体内的TC、TG和LDL-c水平均极显著性升高,HDL-c水平极显著性降低,表明通过给予高胆固醇饲料来复制HLP斑马鱼模型是可行的。用不同浓度的大黄素处理10天后,除TG水平变化不显著外,其余指标水平均有显著性差异,且呈剂量依耐性,提示在一定浓度范围内的大黄素对脂质代谢紊乱有较好的改善作用。脂质、胆固醇和复合糖类长期大量的在血管处集聚、沉着,会导致动脉壁增厚变硬、血管腔变窄,致使动脉内膜出现黄色的粥样,进而演变成AS。血清TC和LDL-c水平升高是AS发生的重要危险因素。目前,国际医学界常用动脉粥样硬化指数来衡量动脉硬化的程度,可以通过TC和HDL-c水平计算出动脉粥样硬化指数。虽然现在对正常斑马鱼还没有确定的动脉粥样硬化指数标准,但通过本研究可以发现,当给予高胆固醇饲料10天后,AI较正常组极显著的升高,用不同浓度的大黄素后,其AI均显著性降低,表明大黄素在抗AS方面表现出极好的作用。
综上所述,本研究发现大黄素能显著改善HLP斑马鱼的体脂水平,对HLP有较好的改善作用,以期为HLP的相关机制研究和大黄素的开发利用提供新的思路,后续还应对其发挥良好调脂作用的具体机制进行更深入的研究。
