18F-FDG PET/CT显像及VEGF表达在非小细胞肺癌预后评估中的价值
2019-12-05周晓亮邓豪余吴武林娄明武
周晓亮,邓豪余,吴武林,莫 逸,娄明武
(1.广州中医药大学深圳临床医学院 深圳市龙岗中心医院影像科,广东 深圳 518116;2.中南大学湘雅医院核医学科,湖南 长沙 410008;3.湖南省肿瘤医院PET/CT中心,湖南 长沙 410013)
非小细胞肺癌(Non small cell lung cancer,NSCLC)约占肺癌的80%~85%,手术切除仍是目前治疗NSCLC最有效的手段之一[1]。术后复发和远处转移是导致NSCLC治疗失败的主要原因,因此准确分期和判断原发病灶的复发潜能是实现个体化治疗的关键。近年来以正电子药物18F-FDG作为示踪剂的PET/CT在肺癌的诊治、疗效评价与预后判断等方面发挥着重要作用[2]。研究[3]表明肿瘤对18F-FDG的摄取能力可在一定程度上反映肿瘤的生物学行为,而作为影响肿瘤血管生成的生物学因子之一的血管内皮生长因子(VEGF)在促进肺癌的血管新生、肿瘤细胞转移及播散中起着非常重要的作用。本研究旨在通过分析NSCLC患者18F-FDG PET/CT图像中的最大标准化摄取值(SUVmax)、肿块VEGF表达与肺癌的临床及病理学特征之间的关系,为临床评估NSCLC患者的预后提供参考依据。
1 资料与方法
1.1 一般资料
收集2007年2月—2014年1月于PET/CT中心接受术前检查的NSCLC患者40例,男24例,女16例,年龄35~79岁,平均(59.30±8.96)岁;其中鳞癌20例,腺癌20例,所有入选病例均为首次确诊肺癌患者,术前PET/CT全身显像及其他检查未发现可疑远处转移病灶。术前及18F-FDG PET/CT显像前未进行任何抗肿瘤治疗,术后取肺癌组织作VEGF免疫组化检测。患者的临床分期依据2009年第7版肺癌TNM分期系统[4]进行处理,40例NSCLC患者中Ⅰ期为25例,Ⅱ期为15例。
1.2 显像方法
显像设备为GE PET/CT Discovery ST扫描仪,18F-FDG由GE公司Minitrace医用回旋加速器通过全自动化学合成系统合成,放射化学纯度>95%。患者在显像前禁食4~6 h,检测血糖<7.1 mmol/L,按照3.7~4.1 MBq/kg静脉注射18F-FDG,安静平卧休息60 min后开展全身性PET/CT扫描。具体的范围定为颅顶至股骨中上段,先行CT扫描定位,扫描电压120 kV,电流100 mA,层厚3.25 mm,PET信息采集模式为三维扫描方式,扫描均在6~8个床位,每个床位扫描3 min。所获得的图像数据均通过PET/CT专用软件进行分析处理,利用CT数据对PET图像进行衰减校正并进行图像重建和融合,获得横断面、冠状面、矢状面三个方向的图像。
1.3 图像分析
所有图像均由2名PET/CT诊断经验丰富的高级职称医师采用双盲法判断,肺癌在PET显像中表现为异常放射性浓聚的病灶,CT常表现为成分叶状的肿块等。选择横断位图像上原发病灶放射性摄取增高区域来勾画感兴趣区(ROI),勾画病灶的ROI后由计算机软件自动计算获得病灶的SUVmax。
1.4 VEGF的检测及评分标准
术后获得的肺癌组织标本,经福尔马林固定、石蜡包埋处理后,采取SABC免疫组化测定标本VEGF表达情况。光镜下观察所有染色切片,VEGF表达阳性细胞染色为棕黄色颗粒或团块,细胞中主要在细胞膜和细胞浆着色,表现为棕色或棕褐色(图1),计算每例切片在5个高倍视野中阳性染色反应细胞的百分率。综合染色反应细胞分布范围及染色强度并依据Mattern[5]的半定量分析方法对VEGF表达进行评分。VEGF表达评分标准为:按分布范围来划分,阳性细胞数>50%为3分、>25%~50%为2分、>10%~25%为1分、≤10%为0分。按染色强度来划分,依棕褐色、棕黄色、淡黄色、无着色分别计分:强阳性为3分、阳性为2分、弱阳性为1分、阴性为0分。最后这两方面的评分之和为肺癌肿块组织VEGF表达的总评分。
1.5 随访情况
40例患者均进行术后随访追踪,主要通过定期门诊检查或电话联系,所有患者均至少随访3年以上。根据有无肿瘤复发、转移或死亡计算患者的无病生存时间。
1.6 统计学处理
统计采用SPSS 20.0软件,计量资料组间比较采用多因素方差分析,组内比较采用LSD法;肺癌SUVmax与肿块组织VEGF表达评分的相关性采用Pearson相关分析,肺癌术后复发的发生率采用Kaplan-Meier分析,影响肺癌预后的多重因素采用Cox风险回归模型分析,P<0.05为差异有统计学意义。
2 结果
2.1 肺癌肿块SUVmax、VEGF表达与临床及病理学特征的关系
40例NSCLC病人依次按照性别、年龄、肿块大小、病理类型、分化程度、临床分期进行分组,所有组别之间SUVmax及VEGF表达的具体情况见表1。图1为肺腺癌和肺鳞癌的HE染色及VEGF染色,图2、3分别为40例NSCLC中的2例PET/CT显像结果。多因素方差分析显示:肿瘤SUVmax及VEGF评分均与病人的性别(F=0.178,P>0.05)、年龄(F=1.546,P>0.05)及病理类型(F=2.378,P>0.05)无明显相关性。肿块SUVmax与肿瘤大小之间存在相关性,肿块最大直径≥3 cm的肿瘤SUVmax显著高于肿块最大直径<3 cm者(F=36.267,P<0.05)。肿瘤SUVmax、VEGF评分与肿瘤组织分化程度之间存在密切相关(F=3.182,P<0.05;F=5.478,P<0.05),组内对比结论显示:低分化组SUVmax与VEGF评分均高于高、中分化组,低、高分化组SUVmax与VEGF评分差异有统计学意义(P<0.05),而高、中分化组间SUVmax及VEGF评分差异无统计学意义(P>0.05),VEGF评分与肺癌患者临床分期无显著关系(P>0.05)。
2.2 肺癌肿块组织VEGF评分与SUVmax的相关性
Peason相关分析结果显示,SUVmax与VEGF表达呈正相关(r=0.394,P<0.01)(图4)。
2.3 肺癌患者的生存分析
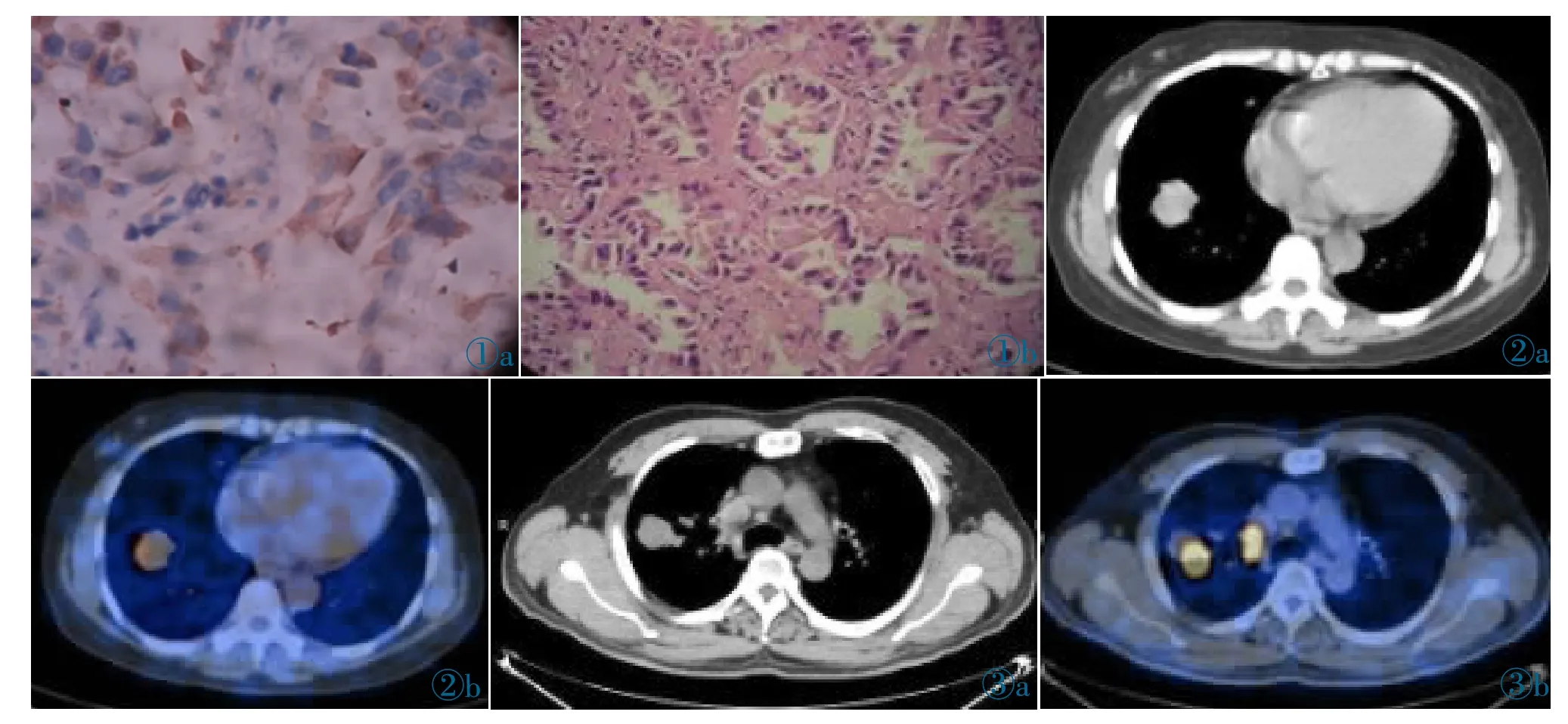
图1a 肺癌的VEGF阳性表达。图1b 肺癌的HE染色,VEGF阳性表达在细胞中主要在细胞膜和细胞浆着色,表现为棕色或棕褐色。图2 男,56岁,右肺中分化鳞癌,T1N0M0(Ⅰ期)。PET/CT图像示右肺下叶结节(图2a,2b),SUVmax为4.3,VEGF评分为2分,随访其无病生存时间为36月。图3 男,65岁,右肺低分化腺癌,T1N2M0(Ⅱ期),右上肺后段团块软组织影,伴右肺门淋巴结肿大(图3a,3b)。肺癌肿块SUVmax为10.2、VEGF表达评分为5分。随访后复查发现肺癌复发并出现全身多处转移灶,患者无病生存时间为12月。Figure 1a.The VEGF positive expression of lung cancer.Figure 1b.HE staining of lung cancer.Cell membrane and cytoplasm are stained as brown in VEGF-positive cells.Figure 2.Male,56 years old,with a differentiated squamous cell carcinoma of the right lung,T1N0M0(stageⅠ).PET/CT images show the right lower lobe nodules.The SUVmax was 4.3 and the VEGF score was 2 points.The followup disease-free survival time was 36 months.Figure 3.Male,65 years old,poorly differentiated adenocarcinoma of the right lung,T1N2M0(stageⅡ).The lesion is a soft tissue shadow of the posterior segment of the right upper lung,with enlargement of the right hilum lymph nodes.SUVmax of lung cancer mass was 10.2,and VEGF expression score was 5 points.After follow-up,the recurrence of lung cancer and multiple systemic metastases were found.The disease-free survival time was 12 months.

图4 肺癌组织SUVmax与肿块VEGF评分的关系(r=0.394,P<0.01)。Figure 4.Relationship between SUVmax and VEGF score in lung cancer(r=0.394,P<0.01).
所有40例肺癌术后患者最后随访时间点均截止为3年,其中5例患者出现术后转移,7例出现局部复发,4例死亡,24例无病生存。以局部复发、转移或死亡的患者数占总研究数的比率定为复发的发生率。40例肺癌患者原发灶SUVmax最大值34.4,最小值2.0,中位数7.3,以SUVmax的中位数7.3为界点将所有患者分为≤7.3及>7.3两组,Kaplan-Meier生存分析表明,SUVmax≤7.3组与SUVmax>7.3组患者术后1年、2年、3年复发的累积发生率分别为0、0.081、0.136和0.056、0.101、0.444,差异具有统计学意义(P=0.031,图5a),表明SUVmax>7.3组的无病生存期短于≤7.3组。以肺癌组织VEGF表达评分的中位数3为界点将患者分为≤3组与>3组,发现VEGF评分≤3组无病生存时间高于VEGF评分>3组,其1年、2年、3年复发的累积发生率分别为0、0、0.160和0.067、0.067、0.467,差异具有统计学意义(P=0.027,图5b)。对可能影响肺癌患者预后的相关因素如性别、年龄、原发灶大小、TNM分期、SUVmax、肿块VEGF评分等纳入Cox多因素分析显示,SUVmax (Wald=8.919,P=0.003)、TNM分 期(Wald=4.140,P=0.042)均为患者总生存的独立预后影响因子,但VEGF评分未能显示为影响预后的独立因素(Wald=0.615,P=0.433)。
3 讨论
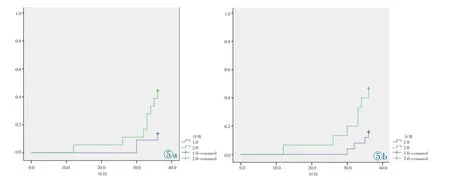
图5 肺癌患者术后3年复发的Kaplan-Meier分析图。图5a中Group1.0为肿块SUV≤7.3;Group2.0为肿块SUV>7.3。Group1.0的1年、2年、3年累积发生率为0、0.081、0.136;Group2.0的1年、2年、3年累积发生率0.056、0.101、0.444,P=0.031。图5b中Group1.0为VEGF评分≤3;Group2.0为VEGF评分>3。Group1.0的1年、2年、3年累积发生率0、0、0.160;Group2.0的1年、2年、3年累积发生率0.067、0.067、0.467,P=0.027。Figure 5.The Kaplan-Meier analysis of recurrence at 3 years after surgery in patients with lung cancer.Figure 5a:Group1.0 for lump SUV≤7.3;Group2.0 for lump SUV>7.3;Group1.0:the cumulative incidence of 1 year,2 years and 3 years of relapse was 0,0.081,and 0.136.Group2.0:the cumulative incidence of 1 year,2 years,and 3 years of relapse was 0.056,0.101 and 0.444.P=0.031.Figure 5b:Group1.0 for VEGF score≤3;Group2.0 for VEGF score>3.Group1.0:the cumulative incidence of 1 year,2 years,and 3 years of relapse was 0,0,0.160.Group2.0:The cumulative incidence of 1 year,2 years and 3 years of relapse was 0.067,0.067,0.467.P=0.027.

表1 40例NSCLC患者临床及病理特征与SUVmax及肿块VEGF表达的关系
PET/CT显像是将PET和CT进行同机融合以达到两者优势互补,在精确界定病灶位置及与周围组织关系的基础上,能更多的提供肿瘤代谢功能等方面的信息,使得诊断信息更加准确、丰富。恶性肿瘤细胞分裂增殖异常活跃,肿瘤细胞所需能量较多,导致糖酵解增强,葡萄糖转运蛋白-1高表达以转运更多的葡萄糖来满足其快速生长的需要,18F-FDG逐渐聚在恶性肿瘤细胞内出现病灶区的异常放射性高浓聚。临床上常用SUVmax作为PET/CT的量化指标来评估肿瘤对葡萄糖的消耗状况,从而获得其在分子水平上的代谢活性信息[6]。正确认识肿瘤原发灶SUVmax与肺癌临床病理因素及预后之间的关系,有助于更好的指导临床工作。Thie等[7]认为SUVmax与肿瘤细胞增殖系数有关,肿瘤早期病灶细胞数量少,增殖速度缓慢,对能量的需求少,对18FFDG摄取较少,SUVmax就越小;随着肿瘤体积的增大,细胞数量增多,能量需求越高,故18F-FDG的摄取增多,SUVmax增高。本研究中SUVmax与肿瘤最大径关系密切,与Zhang等[8]的研究结果相一致,进一步证实了NSCLC原发灶大小是预测SUVmax的重要指标。Stiles等[9]研究探讨非小细胞肺癌患者中SUVmax与原发灶大小的关系,发现二者呈正相关,与本文研究结果一致。
肿瘤组织对18F-FDG的摄取高低一定程度上反映肿瘤的恶性程度,这些与肿瘤的代谢特征、生物学行为等方面存在着某种密切的关系。恶性肿瘤的快速增殖依赖于新生血管为其提供生长所需的营养物质、氧以及排除代谢废物,并为其迅速转移、播散提供最直接的通道,因此血管新生是恶性肿瘤生长、侵袭和播散的基础[10]。恶性肿瘤的增殖与扩散过程复杂,同时也与肿瘤细胞自身分泌并激活的促血管生成因子密切有关[11]。在许多促血管生成的生物因子中,VEGF起着非常重要的正向调节作用,其特异地作用于血管内皮细胞[12]。大部分恶性肿瘤患者的肿瘤组织、血液或尿液中可见VEGF高表达,同时也发现其表达程度与肿瘤病理分级、疾病分期及预后密切相关[13]。国外有研究表明NSCLC组织VEGF及肿瘤血管新生在其生长、转移、治疗和预后中起着重要作用[14]。Ohta等[15]探讨提出肿块组织的VEGF表达可考虑作为肺癌术后是否复发和转移的重要预测指标,本研究中发现VEGF评分与肿瘤组织分化程度关系密切,另外以VEGF表达评分的中位数3作为界点,发现肺癌组织VEGF评分越高,复发的发生率越高,提示肺癌的VEGF表达与肿瘤的恶性程度有关,VEGF表达评分可考虑作为肺癌患者预后和复查的参考指标。
术后复发及转移播散是肺癌患者治疗失败和预后较差的主要原因,准确的诊断及恶性程度的详细评估有助于临床制定准确的治疗方案。既往研究[16]表明NSCLC患者血清VEGF与肿瘤SUV存在相关性。Bille等研究[17]表明SUVmax的高低与NSCLC患者的预后情况显著相关,研究显示SUVmax较高者的NSCLC患者的生存差于SUVmax较低者。本研究中也发现SUVmax>7.3和SUVmax≤7.3的两组患者的术后无病生存的差异有统计学意义,从而进一步表明肿块SUVmax上可提示肺癌患者的预后。本研究中发现临床分期中Ⅰ、Ⅱ期SUVmax存在统计学差异,但VEGF表达评分未见明显差异,从而一定程度上反映了肺癌中的血管内皮生产因子主要作用于肿块本身,而与淋巴结转移相关的分子生物学因素无关。Higashi等[18]研究将单因素生存分析中有意义的影响因子如SUVmax、TNM分期等纳入Cox比例风险模型多因素分析证实只有SUVmax是影响预后的独立因素。本研究中单因素分析显示SUVmax、肿块VEGF评分为影响患者生存的因素,多因素分析显示SUVmax为影响肺癌术后患者生存的独立预后因素,肿块VEGF评分为影响患者生存的非独立预后因素,进一步证实了SUVmax有独立于病理TNM分期之外的预后价值。由于本次入选病例均为临床Ⅰ、Ⅱ期患者,肿块VEGF评分与其他影响预后的因素之间关系有待于进一步研究。
总之,NSCLC原发病灶的SUVmax及VEGF表达与肿瘤分化程度及复发潜能密切相关,某种程度上可评估肺癌术后患者的预后,对于临床制定合理的诊疗方案有一定的指导意义。限于样本量及研究指标较少,本研究需下一步增加样本量、增加研究指标,以期获得肺癌预后更为优质的影像学及检查指标,为诊治肺癌提供更多参考依据。
