雷贝拉唑钠细菌内毒素检验方法的建立
2019-12-04雷小平陈青连
雷小平 陈青连


摘 要 目的:建立控制雷贝拉唑钠中细菌内毒素限度的方法。方法:按照《中国药典》2015年版建立雷贝拉唑钠细菌内毒素凝胶法检验方法。结果:使用灵敏度为0.06 EU/ml的鲎试剂进行试验,得到雷贝拉唑钠最高不干扰浓度为0.24 mg/ml。结论:对雷贝拉唑钠可采用凝胶法进行细菌内毒素检验,其限度定为1 EU/mg,供试品检测浓度为0.06 mg/ml,使用鲎试剂的灵敏度为0.06 EU/ml。
關键词 雷贝拉唑钠 细菌内毒素 凝胶法
中图分类号:R927.12; R975.6 文献标志码:A 文章编号:1006-1533(2019)21-0075-05
Establishment of a method suitable for the bacterial endotoxin test in rabeprazole sodium
LEI Xiaoping*, CHEN Qinglian**
(Hangzhou Ausia Biological Tech Co., Ltd., Hangzhou 310018, China)
ABSTRACT Objective: To establish a method for the control of the limit of bacterial endotoxin in rabeprazole sodium. Methods: The gel-clot method for the bacterial endotoxin test in rabeprazole sodium was established according to Chinese Pharmacopoeia (2015 ed.). Results: The test was carried out with tachypleus amebocyte lysate with sensitivity of 0.06 EU/ml. The maximum non-interference concentration of rabeprazole sodium was 0.24 mg/ml. Conclusion: Gel-clot method can be used to test bacterial endotoxin in rabeprazole sodium. The limit is 1 EU/mg. The detection concentration of the sample is 0.06 mg/ml and the sensitivity of tachypleus amebocyte lysate reagent is 0.06 EU/ml.
KEy WORDS rabeprazole sodium; bacterial endotoxin; gel-clot method
雷贝拉唑钠是一种新型的质子泵抑制剂,可于治疗酸相关性疾病,如消化性溃疡、胃食管反流性疾病、卓-艾氏综合征等,具有选择性强烈抑制幽门螺杆菌(Hp)作用,在临床使用中有显著性优势[1-3]。注射用雷贝拉唑钠在生产中控制热原具有其必要性[4],通常采用加活性炭的方式[5-6]。但《已上市化学仿制药(注射剂)一致性评价技术要求(征求意见稿)》中要求注射剂生产中不建议使用活性炭,为了有效去除热原(细菌内毒素),需加强对原辅包、生产设备等的控制[7-9]。采用的方法有家兔法测定热原或凝胶法[10]和光度测定法测定细菌内毒素。由于家兔法更耗时、检验成本更高,故通常采用制定细菌内毒素限度的方式进行控制。当两种检测方法测定细菌内毒素结果有争议时,以凝胶法结果为准。故为了控制原料雷贝拉唑钠中的细菌内毒素,本研究特制订其凝胶检验方法。
1 材料和方法
1.1 仪器
N10试管恒温仪(杭州奥盛仪器有限公司);XH-D涡旋混合器(上海允延仪器有限公司);ML204T天平[梅特勒托利多仪器(上海)有限公司];DHG-9246A电热恒温鼓风干燥箱(上海精宏实验设备有限公司)。
1.2 试药
雷贝拉唑钠(珠海润都制药股份有限公司,批号:88817110102、88814080102);雷贝拉唑钠(Metrochem API Private Limited,批号:RBS/1508298);细菌内毒素工作标准品(湛江安度斯生物有限公司,批号:1708160、180101、1806131,效价:10 EU/支) ;鲎试剂(湛江安度斯生物有限公司,规格:0.1 ml/支,标示灵敏度:0.25 EU/ml,批号:1703013;标示灵敏度:0.125 EU/ml,批号:1804161;标示灵敏度:0.06 EU/ml,批号:1803051); 鲎试剂(福州新北生化工业有限公司,规格:0.1 ml/支,标示灵敏度:0.25 EU/ml,批号:17031712;标示灵敏度:0.125 EU/ml,批号:18041812;标示灵敏度:0.06 EU/ml,批号:17091312);稀释剂Ⅱ(湛江安度斯生物有限公司,批号:1801220;规格:4.0 ml /支);细菌内毒素检查用水(湛江安度斯生物有限公司,批号:1608010、1804280;规格:5 ml /支)。
1.3 方法
取供试品,加细菌内毒素检查用水稀释至浓度为2C的供试品储备液与C的供试品溶液;用细菌内毒素检查用水将细菌内毒素工作标准品溶解稀释制成浓度为4λ的细菌内毒素工作标准品溶液与浓度为2λ的阳性对照溶液(B);取0.5 ml浓度为4λ的细菌内毒素工作标准品溶液和0.5 ml浓度为2C的供试品储备液混匀,作为供试品阳性对照溶液;以细菌内毒素检查用水作为阴性对照溶液。取鲎试剂,用0.1 ml细菌内毒素检查用水复溶后,分别加入0.1 ml供试品溶液、阳性对照溶液、供试品阳性对照溶液、阴性对照溶液,各平行两管,轻轻混匀后,放入(37±1)℃试管恒温仪中,保温(60±2)min。
2 结果
2.1 细菌内毒素限值的确定
根据其制剂注射用雷贝拉唑钠原研说明书中的用法用量:按静脉输注给药,注射用雷贝拉唑钠规格为20 mg,使用量为每日1瓶,滴注时间在15~30 min内。计算确定雷贝拉唑钠内毒素的限值(L)为15 EU/mg[11]。
本品为注射用雷贝拉唑钠原料,为保证其制剂的质量及用药安全,该原料细菌内毒素限值须严于其制劑临床用药计算的最大限制(15 EU/mg),考虑该制剂生产工艺、生产用水及其它辅料的带入,故我们将雷贝拉唑钠内毒素限值(L)1 EU/mg定为企业标准。
2.2 最低有效稀释浓度的确定
计算公式为C=λ/L。式中,C为最低有效稀释浓度;λ为在凝胶法中鲎试剂的标示灵敏度;L为供试品的细菌内毒素限值,以EU/mg表示,为1 EU/mg;当λ为 0.25 EU/ml,C=0.25 mg/ml;λ为0.125 EU/ml,C=0.125 mg/ml;λ为0.06 EU/ml,C=0.06 mg/ml。
2.3 鲎试剂灵敏度复核试验
将各灵敏度(λ)的鲎试剂用细菌内毒素检查用水0.1 ml复溶,分别加入2λ、λ、0.5λ和0.25λ四个浓度的细菌内毒素标准溶液0.1 ml,每一个浓度平行做4管,另取2管加入0.1 ml细菌内毒素检查用水作为阴性对照。当最高浓度为2λ管均为阳性,最低浓度0.25λ管均为阴性,阴性对照管均为阴性,试验方为有效。当λc[λc= lg-1(∑X/4)]在0.5λ~2λ之间时,结果均符合企业标准(表1)。
2.4 方法筛选
2.4.1 选择灵敏度0.25 EU/ml的鲎试剂
取雷贝拉唑钠,用细菌内毒素检查用水配制成浓度分别为2、1、0.5和0.25 mg/ml的溶液,并配制含2λ细菌内毒素的各浓度供试品阳性对照溶液(PPC溶液)。取两个厂家灵敏度为0.25 EU/ml复溶后的鲎试剂进行检测。实验结果见表2,其最高不干扰浓度为0.25 mg/ml。由于最高不干扰浓度与其最低有效稀释浓度一致,故以该浓度检测时存在风险。
2.4.2 调节溶液pH
由于细菌内毒素检测时,溶液的pH 在6.0~8.0 的范围内为宜[8]。雷贝拉唑钠用细菌内毒素检查用水配制成浓度0.25~2 mg/ml的溶液时,pH为9.4~10.1,故使用稀释剂Ⅱ稀释至浓度为0.25~2 mg/ml,其相应pH为6.8~7.0,满足pH要求。用细菌内毒素检查用水溶解雷贝拉唑钠后,以稀释剂Ⅱ作为稀释剂,按2.4.1重复试验后发现改变稀释剂后对试验结果无改善,且稀释剂Ⅱ对雷贝拉唑钠溶解性较差,故仍使用细菌内毒素检查用水为宜(表2)。
2.4.3 改变鲎试剂灵敏度
由于使用灵敏度0.25 EU/ml的鲎试剂检验时,其最低有效稀释浓度为0.25 mg/ml,与其最高不干扰浓度一致,检测存在风险。故通过减小所使用的鲎试剂灵敏度,减小其最低有效稀释浓度。为保证所选用鲎试剂的可行性,通过检验各灵敏度鲎试剂对应的最低有效稀释浓度的2倍(2C)浓度下对内毒素是否凝结,选定适宜灵敏度鲎试剂。实验结果表明,使用灵敏度0.25 EU/ml鲎试剂时,浓度0.5 mg/ml对内毒素凝结有干扰;使用灵敏度0.125 EU/ml时,浓度0.25 mg/ml有干扰;使用灵敏度0.06 EU/ml时,浓度0.125 mg/ml无干扰,故选择灵敏度0.06 EU/ml鲎试剂进行方法学验证。
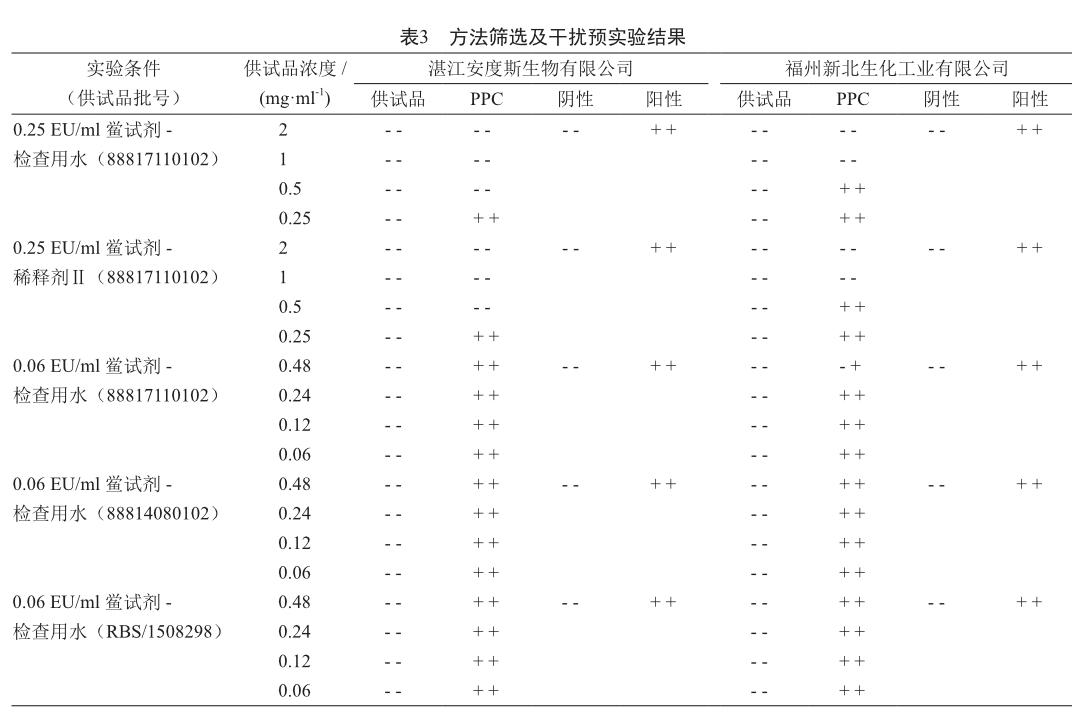
2.5 干扰预实验
取雷贝拉唑钠,用细菌内毒素检查用水配制成浓度分别为0.48、0.24、0.12 和0.06 mg/ml的溶液,并配制各浓度供试品阳性对照溶液(PPC溶液)。取两个厂家复溶后的鲎试剂(灵敏度0.06 EU/ml)进行检测干扰预实验,其最高不干扰浓度为0.24 mg/ml(表3)。
2.6 正式干扰试验
用细菌内毒素检查用水配制0.24 mg/ml的供试品溶液,浓度为2λ、λ、0.5λ和0.25λ的内毒素工作标准品溶液,及含0.24 mg/ml供试品的各浓度供试品阳性对照溶液(PPC溶液)。取两个厂家复溶后的鲎试剂(灵敏度0.06 EU/ml)进行检测,其中供试品阳性对照溶液平行4管,其余各平行2管。供试品溶液及阴性对照平行管为阴性,阳性对照结果符合鲎试剂灵敏度复核试验要求,故实验有效;PPC溶液结果符合鲎试剂灵敏度复核试验要求,故供试品浓度为0.24 mg/ml时,对检测无干扰(表4)。
2.7 雷贝拉唑钠样品中内毒素的检测
取供试品,加细菌内毒素检查用水配制成浓度为0.06 mg/ml的供试品溶液,用标示灵敏度为0.06 EU/ml的鲎试剂检测,结果符合规定(表5)。
3 讨论
方法筛选过程中发现使用灵敏度为0.25 EU/ml的鲎试剂检测时,其最高不干扰浓度为0.25 mg/ml,与其最低有效稀释浓度一致,故采用最低有效稀释浓度检测时,存在PPC管呈阴性的风险。由于其溶液pH不在6.0~8.0这一适宜pH范围内,考虑使用稀释剂Ⅱ作为稀释剂,将pH调节至该范围内,但干扰情况未得到改善,且发现使用该稀释剂雷贝拉唑钠溶解度变差,故仍以细菌内毒素检查用水为溶剂为宜。为减小供试品溶液检测浓度,考虑使用小灵敏度的鲎试剂检验,为保证其2C浓度下无干扰,故选择灵敏度为0.06 EU/ml的鲎试剂。
通过鲎试剂灵敏度复核试验得到两个厂家鲎试剂均符合要求,采用两个厂家鲎试剂进行干扰预实验得到最高不干扰浓度为0.24 mg/ml,并使用该浓度进行正式干扰试验,得到雷贝拉唑钠浓度0.24 mg/ml时,对检测无干扰。
采用凝胶法测定细菌内毒素操作简单,检验周期短,对检验的要求较低。雷贝拉唑钠使用标示灵敏度为0.06 EU/ml的鲎试剂,采用凝胶法检测,供试品浓度不大于0.24 mg/ml时,对检测无干扰。故可采用凝胶法替代家兔法进行细菌内毒素检验。
参考文献
[1] 陆祝选. 雷贝拉唑钠联合用药治疗消化性溃疡43例临床观察[J]. 中医内科学, 2009, 4(3): 372-373.
[2] 张丽. 注射用雷贝拉唑钠治疗非食管胃静脉曲张上消化道出血的临床效果分析[J]. 临床药学, 2017, 12(7): 87-89.
[3] 李兆申, 湛先保, 邹多武. 国产雷贝拉唑钠治疗十二指肠球部溃疡的多中心随机对照临床研究[J]. 上海医药, 2008, 29(2): 83-84.
[4] 邱楓, 何晓静, 孙亚欣. 注射用雷贝拉唑钠在健康人体中的药动学及安全性研究[J]. 华西药学杂志, 2014, 29(2): 176-179.
[5] 谢建康, 梁文权. 注射用雷贝拉唑钠的制备及安全性评价[J]. 中国现代应用药学杂志, 2009, 26(5): 385-387.
[6] 林金海, 陈晓佳, 丁友玲. 对活性炭(供注射用)吸附液体中细菌内毒素能力的研究[J]. 上海医药, 2018, 39(21): 12-15.
[7] 高新贞, 吕文丽, 刘枕. 磷酸氟达拉滨原料药细菌内毒素检查方法的建立[J]. 中国药品标准, 2018, 19(1): 28-31.
[8] 陈群英, 郑马庆. 药用辅料苯甲醇细菌内毒素检查方法学研究[J]. 山东化工, 2018, 47(7): 68-72.
[9] 李燕浙. 原料药生产中的细菌内毒素控制[J]. 化工管理, 2017(8): 270.
[10] 沈银忠. 细菌内毒素检测方法及其临床应用[J]. 上海医药, 2018, 39(21): 3-6.
[11] 国家药典委员会. 中华人民共和国药典(2015年版)四部[M]. 北京: 中国医药科技出版社, 2015: 154-157.
