黑色素形成分子机制研究进展∗
2019-12-04王磊刘军
王磊,刘军
(新疆大学生命科学与技术学院新疆生物资源基因工程重点实验室,新疆 乌鲁木齐 830046)
正常的生理情况下,人体的皮肤接触适量紫外线,皮肤表皮基底层的黑色素细胞会产生黑色素以抵御紫外线,避免皮肤晒伤;但过量的紫外线照射不仅会导致表皮细胞的DNA损伤、基因突变、癌变以及免疫系统损伤和衰老等[1],还会引起皮肤黑色素细胞过度增殖、凋亡及色素沉着紊乱等变化,从而引起皮肤色斑[2].在中老年人群中主要为老年斑、雀斑及黄褐斑等,而在青年人群中以雀斑、黄褐斑等色斑为多[3].
除紫外线照射外,女性雌激素水平紊乱也会引起皮肤色斑的形成,而雌激素水平的紊乱则与妇科疾病、化妆品使用、精神状态、遗传等因素密切相关[4,5].随着现代人类对物质条件和幸福感的追求,女性对审美也有了更高的要求,面部皮肤色斑已成为影响女性美观的主要原因之一.目前的研究表明黑色素合成、转运和代谢等紊乱均可造成色素异常沉着[6],因此对其形成机制探寻既有助于深入了解黑色素的发生机制,更有利于研究开发有效治疗皮肤色斑的药物和技术方法.
1 黑色素的种类、分布及合成
黑色素是由黑色素细胞合成的、一种氨基酸衍生的生物色素,属于多元酚类聚合物,主要分棕/黑色的真黑素和红/黄色的褐黑素两种类型,具有保护皮肤的功能[7],真黑素和褐黑素比例不同使皮肤颜色呈现一定差异性[8],黑色素广泛存在于表皮及眼睛等器官中[9].
现有的研究表明,黑色素的分布经历四个阶段:首先是黑色素小体形成,其次是黑色素小体成熟,随后黑色素合成,最后含大量黑色素的黑色素小体被转运[10].当黑色素细胞将黑色素小体转运至邻近的皮肤角质细胞时,将导致角质细胞产生生理生化变化,这时黑色素在皮肤角质细胞内沉积,皮肤就会呈现出颜色[11].黑色素的合成过程复杂(图1),L-酪氨酸氧化是黑色素合成的起始步骤,酪氨酸酶(tyrosinase,TYR)、酪氨酸酶相关蛋白1(tyrosinase-related protein 1,TRP-1)和酪氨酸酶相关蛋白2(tyrosinase-related protein 2,TRP-2)是黑色素合成的重要限速因素[12],TYR作为黑色素合成中的关键限速酶[13],过表达时会造成黑色素异常沉着,形成皮肤色斑;另一方面,这些酪氨酸酶类表达量不足也将造成白化病、白癜风等疾病[14].TYR是一种Ⅰ型膜糖蛋白,以四聚体形式结合两个Cu2+来发挥其生物功能,分子量128±6.4 kDa,亚基分子量32 kDa[15],定位于黑色素小体膜上[16],常常作为研究黑色素异常沉积的分子靶标.TYR可将L-酪氨酸氧化为多巴醌(dopamine quinone,DQ),DQ发生自氧化转变为多巴与多巴色素,多巴色素的产物5,6-二羟基吲哚羧酸(5,6-dihydroxyindole-2-carboxylic acid,DHICA)与5,6-二羟基吲哚(5,6-dihydroxyindole,DHI)进一步被氧化成真黑素.在半胱氨酸或谷胱甘肽的作用下,DQ还可形成半胱氨酰多巴进而合成褐黑素,真黑素和褐色素能够形成混合色素.一般来说不同肤色黑色素细胞中的酪氨酸酶表达量无明显差异[17],对酪氨酸活性进行调节将成为影响黑色素合成的关键所在[18].而皮肤中的黑色素沉着与黑色素小体形成、黑色素稳定合成、黑色素小体转运及各阶段相关基因的转录激活密切相关.
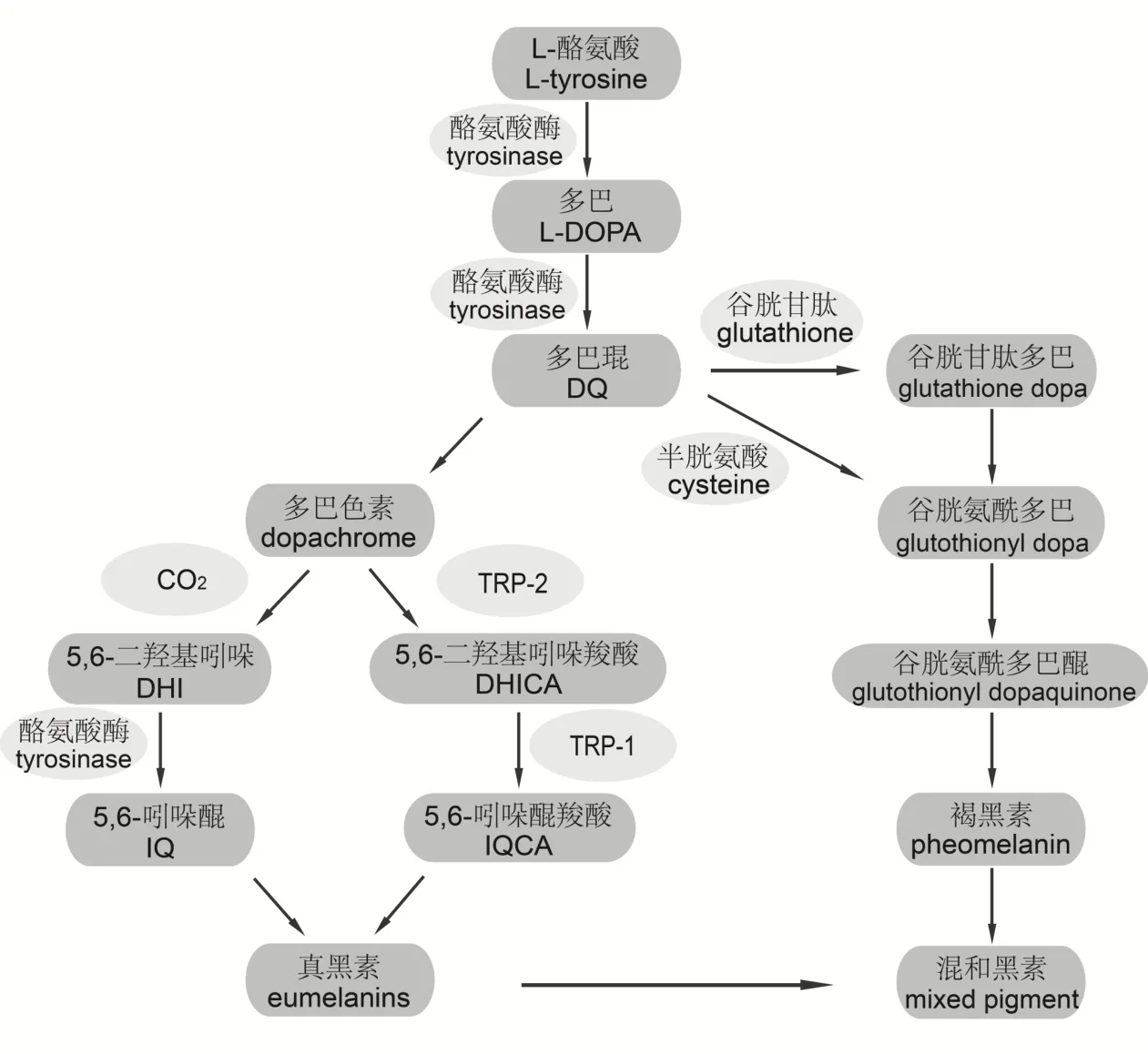
图1 黑色素合成过程Fig 1 The process of melanin synthesis
2 成熟黑色素小体的形成
黑色素小体(melanosome)是黑色素细胞中淀粉样纤维形成的纹状体结构所构成的一种特化的膜结合细胞器,起源于黑色素细胞内的多囊泡内体(multivesicular endosomes/bodies,MVBs).在黑色素小体形成阶段,黑色素小体带有管腔内膜泡(intraluminal vesicles,ILVs)的空泡结构[10],该结构与溶酶体系统分离,并通过内吞作用摄入所需物质.在MVBs中,色素细胞特异性蛋白质前黑色素小体蛋白(premelanosome protein,PMEL)经历水解加工,诱导沉积黑色素的原纤维产生.PMEL的蛋白水解片段经过CD63依赖性的分选至ILVs中,PMEL被加工并聚合,形成淀粉样原纤维基质.研究显示PMEL依赖性原纤维形成是黑色素细胞中黑色素小体生物发生过程中延长所必需的.随着原纤维长度在黑色素小体上扩展和延伸,该过程也促进了未成熟的黑色素小体的延长.前黑色素小体蛋白17(premelanosome protein 17,PMEL 17)是参与黑色素小体纤维形成所必需的分子之一,能够自主组装形成黑色素小体纹状体结构,并能够维持黑色素小体内的环境平衡[19].研究表明PMEL 17会聚集在ILVs上,并随ILVs的伸长而逐渐形成淀粉样纤维,进而将ILVs送至MVBs周围[20],淀粉样纤维大量聚集成片状,最终形成椭圆形的黑色素小体.
在黑色素小体成熟阶段,充满片状淀粉样纤维的黑色素小体停止内吞作用[21],TYR、TRP-1、TRP-2等酶类及溶酶体合成的相关细胞器复合物(biogenesis of lysosome-related organelles complexes-1/2/3,BLOC-1/2/3)、接头蛋白(activator protein-1,AP-1)复合物被选择性地转运至黑色素小体中[22].黑色素瘤T细胞抗原(melanoma antigen recognized by T-cells 1,MART-1 或MLANA)是黑色素小体合成相关的跨膜蛋白,与PMEL 17相互作用形成复合体,影响着黑色素小体的稳定性,并参与各种生理活动[19];眼白化病基因(ocular albinism 1,OA1),其编码的OA1蛋白是一种非典型G-蛋白偶联受体,亦是一种黑色素小体膜蛋白,具有连接溶酶体和黑色素小体的作用[19].OA1基因能够在成熟黑色素小体的膜中表达,能够在前黑色素小体的内吞溶酶体中表达,影响其与PMEL 17的相互作用及黑色素小体的结构,OA1基因突变将会导致巨大畸形黑色素小体的产生,进而影响黑色素的合成[21].小鼠的某些基因,如P(pinyed dilute)基因、Slc24A5(potassium-dependent sodium-calcium exchanger)基因、Slc45A2基因等膜相关转运蛋白基因,编码黑色素小体膜上的离子交换蛋白,主要作用是调控黑色素小体Na+、K+、H+等阳离子浓度并共同维持黑色素小体内环境酸碱平衡[21].膜相关转运蛋白(membraneassociated transporter protein,MATP)也能够影响黑色素小体的成熟,主要会造成黑色素小体形状异常、淀粉样纤维形成紊乱,导致黑色素含量减少[19].以上研究表明,成熟黑色素小体的数量以及进入到黑色素小体的TYR、TRP-1等酪氨酸酶类活性与黑色素合成有着密切的相关性,对黑色素小体合成基因进行沉默或阻断是减少黑色素合成的关键.
3 黑色素生物合成的信号通路
成熟的黑色素小体为黑色素合成代谢提供了必要场所,同时还受到诸多因素的影响.黑色素合成过程中,TYR是关键的限速酶,TRP-1和TRP-2则参与催化过程,对维持酪氨酸酶在黑色素小体膜上的稳定性以及抑制未成熟黑色素细胞的死亡起着重要作用[20].
α-黑色素细胞刺激激素(α-melanocyte stimulating hormone,α-MSH)是位于黑色素细胞膜上的13肽化合物,活性位点为4∼10位氨基酸,参与黑色素的合成[23,24].α-MSH主要由表皮黑色素细胞和角质细胞通过自分泌和旁分泌方式产生[25].黑皮质激素-1受体(melanocortin-1 receptor,MC-1R)在黑色素细胞和角质细胞的胞浆和细胞膜表达,其与α-MSH结合后,通过G蛋白的作用诱导环磷酸腺苷(cyclic adenosine monophosphate,cAMP)增加,cAMP通过蛋白激酶A(protein kinase A,PKA)发挥其信号分子作用[26],引发小眼畸形相关转录因子(microphthalmia-associated transcription factor,MITF)以及TYR、TRP-1和TRP-2的表达上调,刺激黑色素合成[27].
Du等人报道α-MSH/MC-1R信号通路可促进真黑素的生成[28];而刺鼠信号蛋白(agouti signal protein,ASIP)可诱导褐黑素的生成,并能将α-MSH诱导的MITF表达量下调,抑制MITF与TYR基因启动子区M-box的结合,进而使TYR、TRP-1和TRP-2在这个过程的表达量减少,导致真黑素合成量减少[29].通过对α-MSH/MC-1R和ASIP两者的调控,最终通过真黑素/褐黑素的比例,决定皮肤的总体色泽[30].
MITF是黑色素合成相关最重要的转录因子,其产物主要参与调控TYR、TRP-1和TRP-2的转录[31],MITF自身表达也受多种信号分子调控,MITF启动子区含有PAX3(paired box 3)、SOX 10(sex determining region Y box 10)、LEF1(lymphoid enhancer binding factor 1)和CRE(cAMP response element)等转录调控因子结合区[32].MITF还具有螺旋-转角-螺旋(helix-turn-helix,HTH)亮氨酸拉链结构DNA结合域,能够调控黑色素细胞增殖、存活和色素的沉着,且磷酸化的MITF与M-box 结合可调节酪氨酸酶及其相关基因表达.PI3K/AKT(phosphatidylinositol 3-kinase/akt protein kinase B)途径中磷酸化的GSK 3β(glycogen synthase kinase 3 beta)蛋白作用于MITF并磷酸化MITF,这有利于MITF与靶位点的结合,从而调控下游相关蛋白的表达[33].研究表明,PKA活化并激活相关cAMP响应元件结合蛋白(CRE-binding protein,CREB),从而进一步活化MITF并诱导黑色素相关基因TYR、TRP-1 和TRP-2的表达,催化L-酪氨酸形成黑色素[12,34].同时p38(p38 MAP kinase)可作用于上游刺激因子-1(upstream transcription factor-1,USF-1)影响CREB蛋白的磷酸化,磷酸化的CREB促进MITF的转录.其次,丝裂原活化蛋白激酶家族(mitogen-activated protein kinases,MAPKs)的ERK(extracellular signal-regulated kinases)和JNK/SAPK(jun amino-terminal kinases/stress-activated protein kinases)也能通过调节CREB蛋白磷酸化来调控MITF的转录[35,36],MAPKs/ERK信号通路可调节MITF的磷酸化作用,活化的ERK信号分子以间接或直接的方式抑制MITF磷酸化;且MAPKs/ERK的磷酸化可增加MITF的降解并封闭酪氨酸酶启动子结合位点MITF M-box,有效抑制MITF 转录导致的黑色素合成减少[37,38].提示MAPKs家族蛋白的磷酸化激活对黑色素的合成具有双向调节作用.
分泌型糖蛋白Wnt能够通过经典和非经典途径发挥黑色素合成的调控作用.经典的Wnt途径引起黑色素细胞质中β-连锁蛋白(β-catenin)的积累并进入细胞核内,进入细胞核的β-连锁蛋白与LEF1相结合并作用于MITF启动子位置,增强其转录表达水平,从而影响黑色素的合成[39].Wnt1和Wnt3A是参与调控经典Wnt通路中的重要分子,也是极大影响黑色素细胞行使功能的调控因子.对内皮素具有依赖性的Wnt1和Wnt3A参与黑色素细胞的发育,可促进黑色素细胞数量的増加,Wnt3A对成熟后的黑色素细胞的増殖有抑制作用.Wnt5A基因的过表达可以启动非经典通路Wnt5A/ROR2,并激活在黑色素细胞树突形成中起重要作用的Rho家族的GTP(guanosine-5’-triphosphate)酶,诱导黑色素细胞树突形成,促进黑色素合成和转运过程,从而增加色斑性疾病的发生概率.黑色素生物合成相关的信号途径如图2所示.
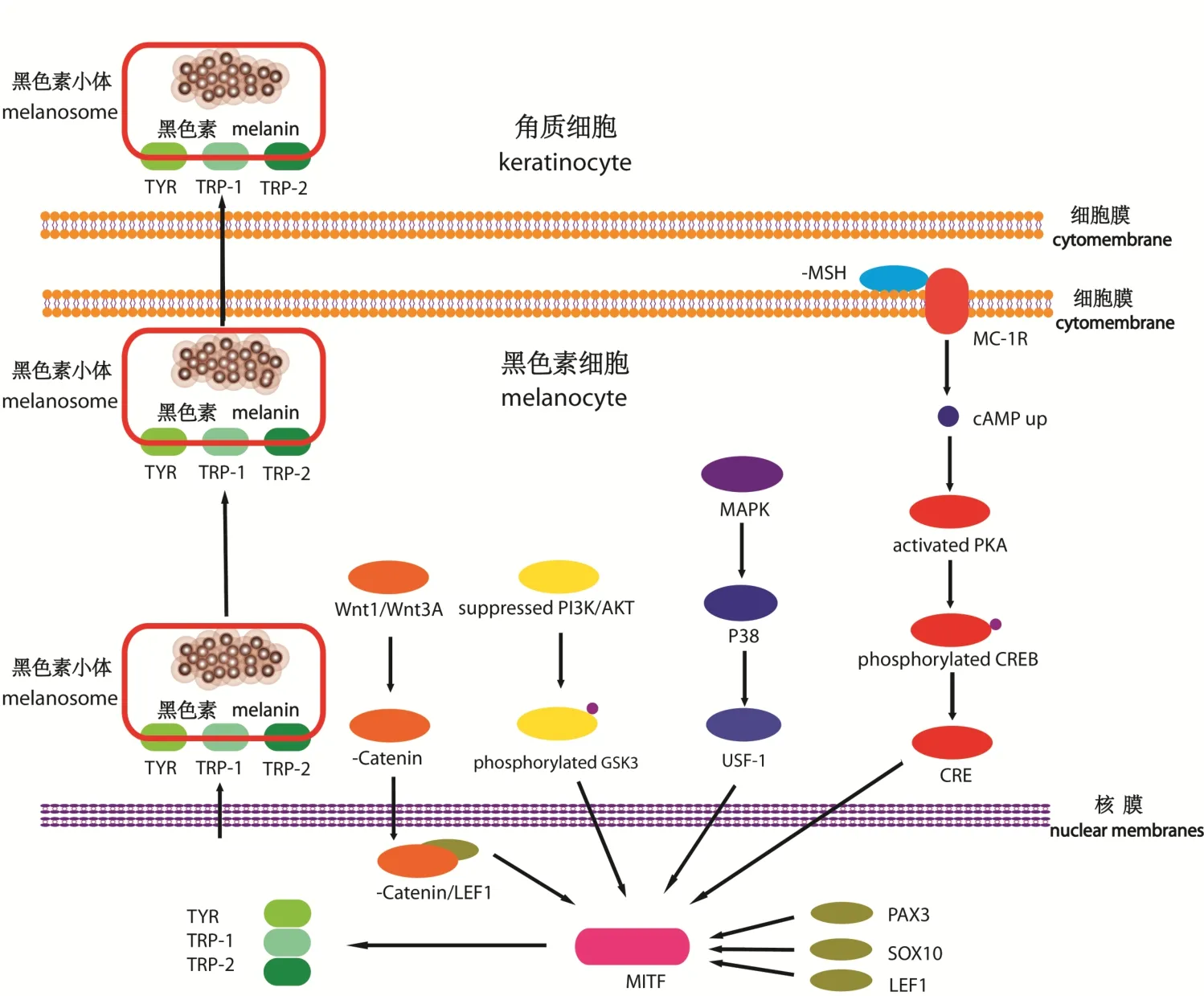
图2 黑色素生物合成信号通路Fig 2 The signal pathway of melanin biosynthesis
4 黑色素转运代谢机制
黑色素在黑色素小体中合成后,含黑色素的黑色素小体从黑色素细胞转运至角质细胞中沉着.黑色素-黑色素小体转运到角质细胞的模式主要有4种:细胞吞噬模式是角质细胞吞噬富含黑色素小体的黑色素细胞中的树突结构;膜融合模式是黑色素细胞形成膜管状通道与角质细胞接近并发生融合,黑色素小体由管状通道转移到角质细胞;脱落吞噬模式是含黑色素小体的封闭囊泡脱落后被角质细胞识别并吞噬;胞外分泌模式则是黑色素细胞以分泌的方式释放黑色素小体到胞外,角质细胞直接吞噬黑色素小体[21,40].不同转运机制可能基于外界不同的刺激(激素药物、紫外线辐射)和遗传因素等.
正常生理活动情况下,黑色素细胞通常采用细胞吞噬模式,成熟的黑色素-黑色素小体依靠细胞骨架移动和定位系统利用微管运输,转移到黑色素细胞周质后,从微管上释放并转运至邻近的角质细胞[41].在此过程中两类细胞表面树突结构分子间的相互作用成为黑色素转运的关键,分子间的相互作用可促使GTPase家族蛋白RAB27A以及效应因子黑色素亲和素SLAC2A和肌动蛋白相关的肌球蛋白Va(114∼116)形成三聚体的复合物.研究表明MITF能够促进RAB27A的表达,从而影响黑色素在黑色素细胞的转运[42].GTPase RAB27A、SLAC2A和Va形成的三聚体复合物还参与黑色素小体早期微管的运输;因此黑色素正常转运过程中,上述三聚体复合物不可替代.另外,黑色素小体转运到黑色素细胞周质时OA1也起着至关重要的作用,OA1可调节微管依赖性黑色素小体的运动[43].当成熟的黑色素-黑色素小体通过黑色素细胞的树状突起被输送至周围的角质细胞时,每个黑色素细胞及周围的角质细胞即构成一个结构和功能单位——表皮黑色素单位,它们共同作用完成黑色素的转运和代谢.
黑色素分布到表皮各层细胞,是决定皮肤色泽的主要因素,大部分黑色素随表皮角质层细胞的脱落而排出体外;也有部分黑色素受角质细胞内溶酶体作用而被降解[44];另有部分黑色素移向真皮浅层,或被嗜黑色素细胞吞噬降解,由淋巴液输送至淋巴结,或被运至血液循环中,经肾脏排泄至体外.以上研究结果表明,黑色素细胞形成的黑色素-黑色素小体的合成率,与其被摄取和转运后的清除率,在正常生理活动中保持同步,处于动态平衡之中,从而维系着人类肤色的相对稳定.
5 小结与展望
诸多因素引起的人类皮肤色素沉着过度并造成色斑,进而影响美观,究其关键是黑色素合成、转运和代谢过程紊乱,因此致力于黑色素合成、转运和代谢相关分子机制的研究十分必要.通过对黑色素合成过程的分子调控机制的综上研究表明:
(1)TYR、TRP-1和TRP-2的活性与黑色素合成密切相关.MITF作为黑色素合成中最重要的转录因子,主要参与调控TYR、TRP-1和TRP-2的转录,同时α-MSH/MC-1R和ASIP、MEK/ERK、PI3K/AKT、cAMP/PKA、P38、Wnt等均可影响MITF对黑色素合成进行的调控,因此干扰或阻断MITF的表达来减少色素沉着将成为焦点.然而针对色斑,多以TYR为直接靶标的抑制剂,或基于酪氨酸酶活性位点Cu2+、酪氨酸酶底物类似物灭活剂等手段来进行治疗,如熊果甘、曲酸、对苯二酚和壬二酸等[45,46],但这类抑制剂常存在致突变、致癌或其他毒副作用的风险,在医疗使用上受到很大的限制.
(2)黑色素小体的成熟为黑色素合成和转运提供了必要条件.PMEL的正常表达及功能发挥是成熟黑色素小体形成的关键,MLANA与PMEL的互作对形成的黑色素小体的稳定性至关重要,离子泵交换蛋白SLC45A2、SLC24A5的作用是维持黑色素小体内环境稳态,因此PMEL已经成为干扰黑色素小体形成的关键靶点.
(3)黑色素转运过程中,由GTPase家族蛋白RAB27A、SLAC2A以及Va(114∼116)构成的三聚体复合物是目前研究黑色素细胞转运的关键分子,需要对该三聚体复合物的作用机制进行深入的研究.
由于对黑色素代谢机制的研究尚欠,且代谢阶段对于色斑的恢复也至关重要.通过对黑色素异常合成机制的探讨可知,TYR活性只是影响黑色素合成的一个环节,而在黑色素小体成熟、黑色素合成、黑色素转运以及黑色素代谢的各个途径中均会存在对黑色素异常沉着影响的关键因素.目前发现多种植物源天然产物表现出了靶向不同信号通路来抑制黑色素合成的功能,一种褐藻属(Phaeophyceae)的红藻醇提物乙酸乙酯相提取物,能够通过抑制cAMP/PKA/CREB信号通路有效地抑制黑色素沉着,有望成为治疗色素沉着障碍的潜在药物[47].从决明子(Catsia tora)中分离得到的蒽酮二聚体糖苷通过抑制MITF表达进而抑制TYR、TRP-1和TRP-2来抑制B16细胞中黑色素的生成[48].这些天然产物集中在查尔酮和黄酮类、香豆素类衍生物、白藜芦醇类似物等[49−51].此外,还有一些化合物也具有良好的应用前景,如离子通道活性剂CyPPA抑制黑色素生成是通过调节GSK 3β/β-catenin信号通路[52].新型合成酪氨酸酶抑制剂(Z)-3-(3-溴-4-羟基苄基)-噻吩-4-1(MHY1498)可在体内、体外表现出良好的褪黑作用[53].若从以上各方面着手研究降低黑色素异常沉着的靶点药物将会大大增加治疗色斑的可能性.
探寻黑色素合成、转运、代谢的上游信号分子通路可揭示相关调控机理、全面深入了解色斑的形成机制,不仅能够为研究新的靶标抑制剂提供有针对性的信息,也能为更好掌握各类色斑的预防和治疗提供解决方案,同时也可以为寻找天然、低毒、有效抑制黑色素沉着的植物源活性物质提供新的方向.
