12株奶牛乳房炎链球菌的分离、鉴定和耐药性分析
2019-12-03王海燕李碧春陈琳
王海燕 李碧春 陈琳
摘要:为了解扬州、泰州地区引起奶牛乳房炎的主要病原体,于2015年11月至2017年6月期间对扬州、泰州地区奶牛场送检的乳房炎奶牛的乳样进行病原体分离,共分离鉴定出11株无乳链球菌菌株,1株乳房链球菌菌株。使用卡那霉素、庆大霉素、环丙沙星、氨苄西林、头孢氨苄、头孢西丁、多黏菌素B、红霉素、四环素、万古霉素、氧氟沙星、阿奇霉素等药物进行了耐药性试验,结果表明,分离菌对卡那霉素、庆大霉素、氨苄西林和多黏菌素B等药物有一定的耐药性,对其他几种药物敏感。
关键词:奶牛;乳房炎;病原菌;药敏试验
中图分类号:S858.23 文献标识码:A 文章编号:1007-273X(2019)10-0005-03
奶牛乳房炎是指病原微生物侵入奶牛乳腺组织或外伤、化学刺激乳腺组织所引起的奶牛乳房炎症[1]。乳房炎是奶牛最常见的疾病,不仅会影响产奶量和牛奶品质,也因治疗时间长、大量使用多种抗生素,造成药物残留和细菌耐药性的产生。我国关于奶牛乳房炎发病率的报道在46%~70%[2,3]。
引起奶牛乳房炎病原菌种类较多,有时为多重感染,最常见的是金黄色葡萄球菌、无乳链球菌、乳房链球菌、停乳链球菌和大肠杆菌[4]。链球菌属致病菌,感染奶牛乳房后所引起的临床症状不明显,从而不易被牛场察觉,危害极大,最直观的经济损失是奶牛乳产量下降,牛奶品质变差。链球菌是革兰氏阳性菌,有荚膜[5],荚膜及其M蛋白在致病过程中起到重要作用[6]。无乳链球菌属于B群链球菌,荚膜多糖、神经氨酸酶等是其重要的毒力因子[7],一些菌株具有溶血特性。部分β型溶血型链球菌致病力强,可引起多种化脓性疾病,产生溶血素、CAMP因子、透明质酸酶和神经氨酸酶等毒性因子[8]。停乳链球菌(GCS)为溶血链球菌,能分泌透明质酸、O型溶血素和纤维蛋白溶解酶[9]。这些毒力因子在致病过程中起到关键作用。
为了解扬州、泰州地区奶牛乳房炎的主要病原体,对送检的牛乳样本进行了病原分离和鉴定,并进行了耐药性试验。
1 方法
1.1 细菌分离
将送检乳样无菌接种于绵羊血琼脂平板,37 ℃培养24 h,观察是否有菌落生成并进行3次传代纯化,最终记录菌落结果。
1.2 染色镜检
对分离得到的菌株进行革兰氏染色,镜检。
1.3 生化试验
利用细菌微量生化反应管(购于杭州微生物试剂有限公司,操作方法与判定标准参照说明书)对分离所得菌株进行生化指标测定。在37 ℃条件下培养24 h,与对照管比对,观察反应结果并记录。
1.4 PCR扩增与测序、分析
使用TaKaRa 16s rDNA Bacterial Identification PCR Kit试剂盒对分离株的16s rRNA基因进行扩增。PCR按照试剂盒说明书进行,体系见表1。PCR反应参照试剂盒提供的条件:94 ℃预变性5 min,变性1 min,退火温度53 ℃ 1 min,72 ℃延伸1 min,再延伸5 min,共30个循环。对扩增产物进行序列测定、BLAST,根据同源性高低确定细菌种属。
1.5 药敏试验
使用卡那霉素、庆大霉素、环丙沙星、氨苄西林、头孢氨苄、头孢西丁、多黏菌素B、红霉素、四环素、万古霉素、氧氟沙星、阿奇霉素等药物进行分离菌株的耐药性试验。
2 结果与分析
2.1 细菌分离结果和菌落形态
牛乳样本接种血平板,37 ℃培养24 h后长出菌落,挑取菌落进一步鉴定。分离出12株菌落的形态和特征见表2和图1。
2.2 染色镜检
12株菌株均呈短链状,革兰氏染色均有不同程度的蓝色,为革兰氏阳性菌,符合链球菌的特征。
2.3 生化结果
对分离的12株链球菌菌株进行了生化特性试验,符合链球菌的生化特性,结果见表3。
2.4 测序结果
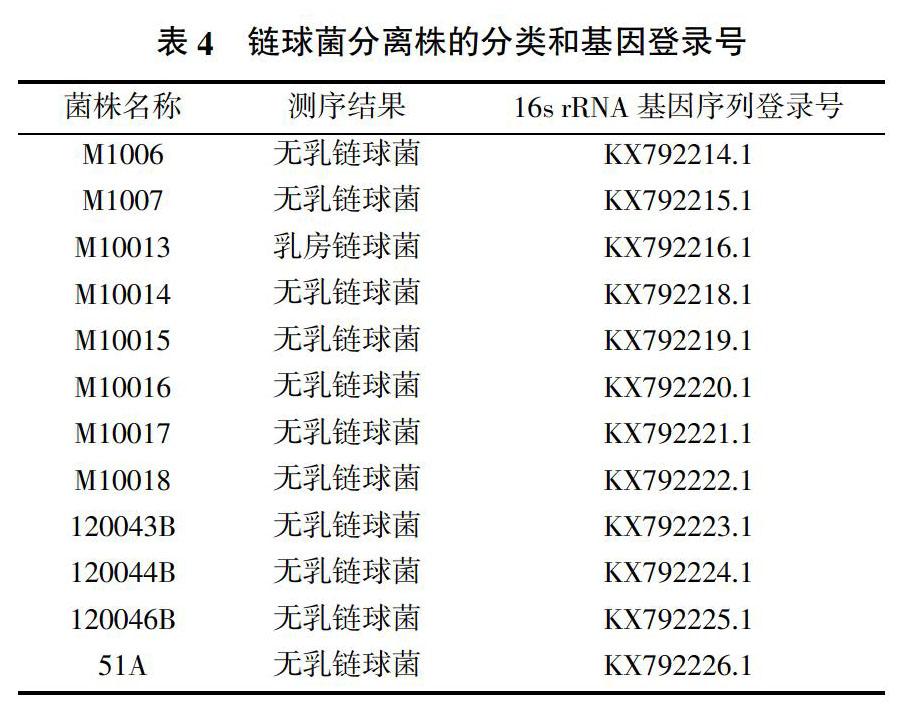
16s rRNA基因序列进行了BLAST分析,均为链球菌,其中无乳链球菌11株,乳房链球菌1株,序列提交GenBank,登录号见表4。
2.5 药敏试验结果
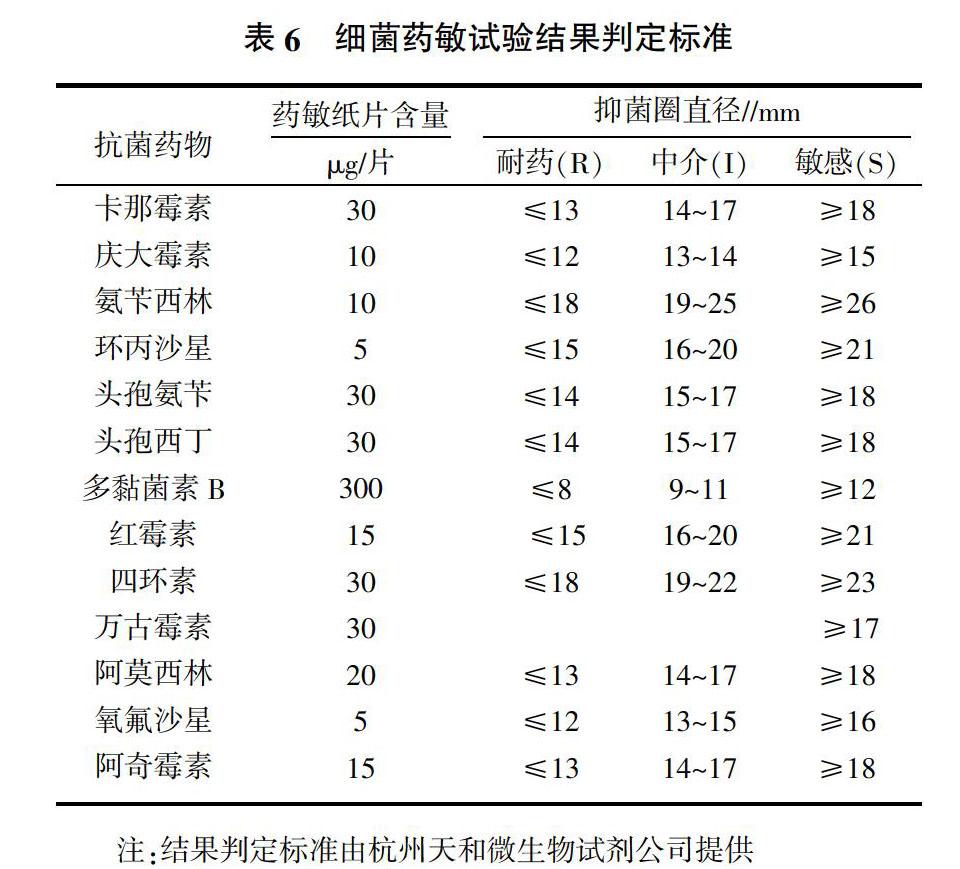
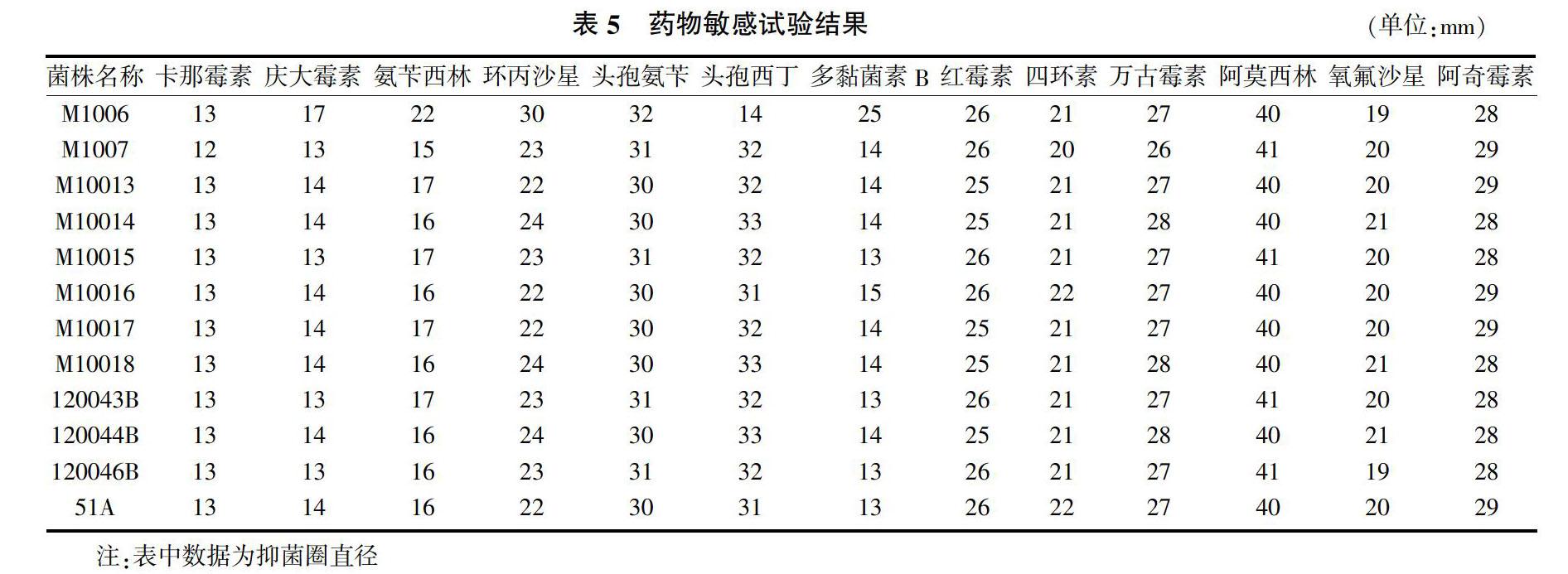
分离菌对卡那霉素、庆大霉素、氨苄西林和多黏菌素B等药物有一定的耐药性,对其他几种药物敏感(表5),判定标准见表6。
3 讨论
3.1 奶牛乳房炎病原菌
试验分离得到的12株链球菌菌株,其中无乳链球菌11株,乳房链球菌1株,说明该地区的奶牛乳房炎病例中无乳链球菌较多。乳房炎病例中,金黄色葡萄球菌是最多的病原菌[10],链球菌分离率仅次于金黄色葡萄球菌,链球菌性乳房炎引起的临床症状不明显,不易被察觉,但造成的危害极大,使奶牛乳产量明显下降,品质变差,它们不仅感染乳房腺体,也会对奶牛乳腺组织造成不可逆的损伤与破坏,导致乳腺泌乳功能受损甚至完全丧失[11]。无乳链球菌专性寄生于奶牛乳腺、乳头和生殖道,可引起婴幼儿的败血症、脑膜炎、肺炎[12],对青霉素、氯霉素、庆大霉素、红霉素等较为敏感。根据本试验得到的结果可以看出,受试药物中有部分药物,如红霉素在奶牛的使用上还有一定的空间。氯霉素在兽医上已经是禁用药物,对庆大霉素有一定的抗药性,分离菌对阿莫西林、万古霉素和阿奇霉素等药物敏感,可用于临床上的感染控制。
3.2 奶牛乳房炎的防治
雖然抗生素能有效治疗奶牛乳房炎,但药物残留危害人类健康,同时又产生耐药性,因此不能依赖抗生素。近年来,中草药治疗乳房炎的研究越来越多,中草药通过提高非特异性免疫和抗菌作用实现对奶牛乳房炎的治疗[13-15]。奶牛乳房炎发生时很多是隐形感染的,挤奶时交叉感染会造成大规模乳房炎,奶牛场本身的管理因素,通风不良、卫生问题等也为病原菌传播提供了一定条件,因此,及时对奶牛进行体检、保证奶牛场环境也非常重要。
参考文献:
[1] CLSI M100 S24 Ed.Performance Standards For Antimicrobial Susceptibility Testing[S].2014.
[2] 孙福先.奶牛乳房炎综合防治技术的试验[J].中国奶牛,1996(1):36-37.
[3] 卜仕金.奶牛乳房炎的抗菌药物治疗[J].兽药与饲料添加剂,1999,4(3):14-16.
[4] RUEGG P L. Investigation of mastitis problems on farms[J].Vet Clin North Am Food Anim Rract,2003,19(1):47-73.
[5] GONZALEZ-OUTEIRINO J,KADIRVELRAJ R,WOODSR J. Structural elucidation of type ΙΙΙ group B Streptococcus capsular polysaccharide using molecular dynamics simulations:The role of sialic acid[J].Carbohydr Res,2005,340(5):1007-1018.
[6] ARAN A,WEINER K,LIN L,et al. Post-streptococcal auto-antibodies inhibit protein disulfide isomerase and are associated with insulin resistance[J].PLoS One,2010,5(9):e12875.
[7] YEUNG M K,MATTINGLY S J. Biosynthetic capacity for type-specific antigen synthesis determines the virulence of serotype ΙΙΙ strains of group B streptococci[J].Infect Immun,1984,44(2):217-221.
[8] DURHAM D L,MATTINGLY S J,DORAN T I,et al. Correlation between the production of extracellular substances by type ΙΙΙ group B streptococcal strains and virulence in a mouse model[J].Infect Immun,1981,34(2):448-454.
[9] EDWARDS M S,NICHOLSON-WELLER A,BAKER C J,et al. The role of specific antibody in alternative complement pathway-mediated phagocytosis of type ΙΙΙ,group B strptococcus[J].J ExpMed,1980,151(5):1275-1287.
[10] 陸承平.兽医微生物学(第五版)[M].北京:中国农业出版社,2014.
[11] 贺 婷.奶牛链球菌性乳房炎可视化LAMP检测方法的建立及应用[D].南宁:广西大学,2014.
[12] 沈定树,周雪艳.无乳链球菌的研究进展[J].中国微生态学杂志,2008,20(5):518-519.
[13] 何 斌,陈 洁,金尔光,等.中草药防治奶牛乳房炎的研究进展[J]. 中国兽药杂志,2016,50(5):60-64.
[14] 贾丽萍,郝卫芳.蒲公英散与抗生素治疗奶牛乳房炎的比较试验[J].中国奶牛,2013(13):28-30.
[15] 白东东,李新圃,杨 峰,等.中药治疗奶牛乳房炎临床效果及作用机制研究进展[J].动物医学进展,2018,39(10):91-95.
