水生动物抗菌肽的研究进展
2019-12-03胡丰晓吴苗苗张伟妮
胡丰晓,吴苗苗,张伟妮
( 福建农林大学 海洋研究院,福建 福州 350002 )
受到外界病原入侵时,大多数生物的防御系统合成并分泌抵抗病原的重要功能物质——抗菌肽。抗菌肽是一类小分子多肽类物质,对病毒、细菌和寄生虫等均有明显的抵御作用。它通常由20~60个带正电或负电的氨基酸按不同比例组成,分子量为2~10 ku。当前抗菌肽数据库(http:∥aps.unmc.edu/AP/main.php)收录的已知的编码抗菌肽或抗菌肽的预测基因序列已达3000余种。截至目前,已从水生动物中分离出多种抗菌肽,如Tachyplesin I、Misgurin、Pleurocidin、Hepcidin和Paradaxins等。水生动物抗菌肽具有很高的抗毒素活性、较低的溶血活性和毒性小等优点,有着重要的应用价值[1]。
近年来,我国水产养殖业飞速发展,随着高密度集约化养殖的普及,水环境污染严重、水产动物疾病层出不穷成为制约养殖业发展的主要瓶颈[2]。目前行业内主要采用抗生素和化学药物防治水产养殖动物的疾病。抗生素和药物的大量使用造成了养殖对象药物残留、病原菌耐药性增加及环境污染等严重问题,而抗菌肽不易产生耐药性,可替代抗生素的抑菌杀菌作用[3],还可改善动物肠道环境、提高生产性能,已成为国内外学者研究的热点。笔者总结了抗菌肽的分类、作用机制,综述了近年来水产动物养殖中抗菌肽的应用,以期为抗菌肽在水产养殖中的深入研究和产业化应用提供理论基础。
1 抗菌肽的分类
抗菌肽广泛存在于细菌、植物、昆虫、水生动物、哺乳动物中,动物性抗菌肽的种类最多,也可人工合成。目前已知的抗菌肽中,根据氨基酸结构和功能将其分为杀菌肽、防御素、富含甘氨酸的抗菌肽、富含脯氨酸的抗菌肽等。
1.1 杀菌肽
杀菌肽最早见于天蚕中,又被称为天蚕素[4]。目前研究证实,杀菌肽仅存在于节肢动物门的双翅目和鳞翅目[5-6]。杀菌肽是一类含约35~39个氨基酸的短肽类物质,有较少的半胱氨酸,不能形成分子内二硫键,有强碱性的N端和强疏水性的末端酰胺化的C端。圆二色谱和二维核磁共振发现,其二级结构含有2个α-螺旋,两螺旋间由丙氨酸—甘氨酸—脯氨酸组成“L”型的铰链区连接,这种螺旋—卷曲—螺旋的结构特点对保持高抗菌活性具有特殊的重要性[7]。天蚕素在水产饲料中应用广泛,发展前景广阔[8-9]。
1.2 防御素
1966年,美国科学家Spitznagel等在哺乳动物的嗜中性粒细胞内发现一种强碱性的短肽类物质,随后,由美国Lehere实验室在兔巨噬细胞中分离纯化得到,命名为防御素。防御素有3个或4个分子内二硫键,根据二硫键的位置及蛋白结构不同,分为α-防御素、β-防御素和θ-防御素,其中β-防御素的种类最多。防御素广泛分布于哺乳动物和海洋生物中,其中鱼类的β-防御素主要分布于皮肤黏膜和免疫器官中[10]。
1.3 富含甘氨酸的抗菌肽
富含甘氨酸的抗菌肽又称蜂蜜素,其分子量约为8~30 ku,肽内含有约14%~22%的甘氨酸,具有较强的溶血性能。海洋生物含有大量富含甘氨酸的抗菌肽,其中来源于克氏原螯虾(Procambarusclarkii)名为Procambarin的抗菌肽氨基酸数目高达155个,推测Procambarin可能参与克氏原螯虾的宿主抗病毒防御系统,但其调节机制有待探索[11-12]。
1.4 富含脯氨酸的抗菌肽
富含脯氨酸的抗菌肽又称蛙皮素,是一类由动物免疫系统分泌的线性多肽,最初由Zasloff等[13]在非洲爪蟾(Xenopuslaevis)中分离获得。肽内脯氨酸含量最多,精氨酸含量次之[14-15]。
2 抗菌肽的作用机理
抗菌肽的作用机理与其分子结构特点密切相关,但是目前尚未研究透彻。综合目前研究,被公认的抗菌肽抑杀菌机理主要有两种:膜裂解机制和非膜裂解机制。
2.1 膜裂解机制
抗菌肽能够辨别真核生物和原核生物细胞膜组成的差异,与细菌细胞膜结合并产生不可逆孔隙或使膜不稳定的肽[16-17]。抗菌肽与细胞膜的作用模式有地毯模型、桶板模型、环孔模型和聚集体模型(图1)[18]。

图1 抗菌肽与细胞膜作用模型a.地毯模型; b.桶板模型; c.环孔模型; d.聚集体模型.
抗菌肽的正电区与细菌细胞膜的磷脂双分子层通过静电作用,由原来无规则的线状结构变为有规则的二级结构——α-螺旋,增大与细胞膜接触的表面积,改变了细胞表面的离子通透性,影响电势、离子动态平衡和酸碱平衡及酶活性,抑制呼吸,并造成胞内物质流出,最终导致细菌细胞死亡[17,19]。
不同种类抗菌肽中杀菌肽、防御素和富含甘氨酸的抗菌肽的作用机制大致相同,机体在受到病原体侵害时,这些抗菌肽容易与革兰氏阴性菌外膜的脂多糖或者革兰氏阳性菌的肽聚糖相互作用,破坏其细胞膜,使细胞质外泄,从而杀死细菌[20-21]。
2.2 非膜裂解机制
部分抗菌肽不能通过破坏细胞膜结构起到杀死细胞的效果,而是与细胞膜上的特异性受体结合,进入到胞内干扰细胞的正常代谢[22]。这种非膜裂解机制主要有以下作用模式:(1)干扰与阻断DNA和RNA的复制与合成;(2)抑制细胞蛋白质的合成[23];(3)抑制细胞分裂,促进细胞凋亡[24];(4)抑制细胞内酶的生物活性,起到抑菌和杀菌的功能[25-26]。
以这种作用机制类型为主导的是富含脯氨酸的抗菌肽,这类抗菌肽通过在细胞内结合Dank蛋白以抑制细菌的生物学功能,使细菌死亡[27]。
3 水生动物抗菌肽的结构与生物学活性
随着水生动物抗菌肽研究的推进,来源于水生无脊椎动物(水母、贝、虾、蟹等)和脊椎动物[大黄鱼(Pseudosciaenacrocea)、石斑鱼(Epinephelus)等]的抗菌肽新种类不断被发现。基于不同的来源和结构特征,这些抗菌肽的活性特征也不尽相同,大多都具有不同程度的抗革兰氏阳性菌和阴性菌活性,有的还具有抗真菌、抗寄生虫和抗肿瘤活性等(表1)。
3.1 水生无脊椎动物抗菌肽
3.1.1 腔肠动物
腔肠动物最初被称为刺细胞动物,种类可达1万余种,分布于多种水域。有学者从腔肠动物体内提取出了多种抗菌肽,例如Aurelin,一种来自海月水母含40个氨基酸、分子质量约为为4.3 ku的免疫活性蛋白,具有适度的抗革兰氏阳性和阴性细菌活性。
3.1.2 软体动物
目前关于软体动物抗菌肽的报道也较多,研究来源主要有牡蛎、扇贝等常见种类。这些软体动物的免疫机制主要依赖非特异性免疫系统,血淋巴和组织中的各种抗菌肽是重要的组成部分。贝类中已发现了多种抗菌肽,例如牡蛎的β-thymosin和亚洲海蛤的Perinerin,它们是一类含有40~50个氨基酸的抗菌肽,具有抗革兰氏阳性和革兰氏阴性细菌活性。
3.1.3 甲壳动物
截至目前已发现多种来源于甲壳动物血细胞的抗菌肽物质,如Crustin、Sphistin、Arasin 1等。这类抗菌肽多数含约40个氨基酸,且肽中附带二硫键,大部分对革兰氏阳性和革兰氏阴性细菌有抗性,少数也具有抗真菌活性。来源于拟穴青蟹的抗菌肽Sphistin,对革兰氏阳性菌和阴性菌具有抗性,通过吸附发挥其抗微生物活性,最终破坏细菌细胞膜,而对哺乳动物或蟹正常细胞没有表现出毒性[49]。
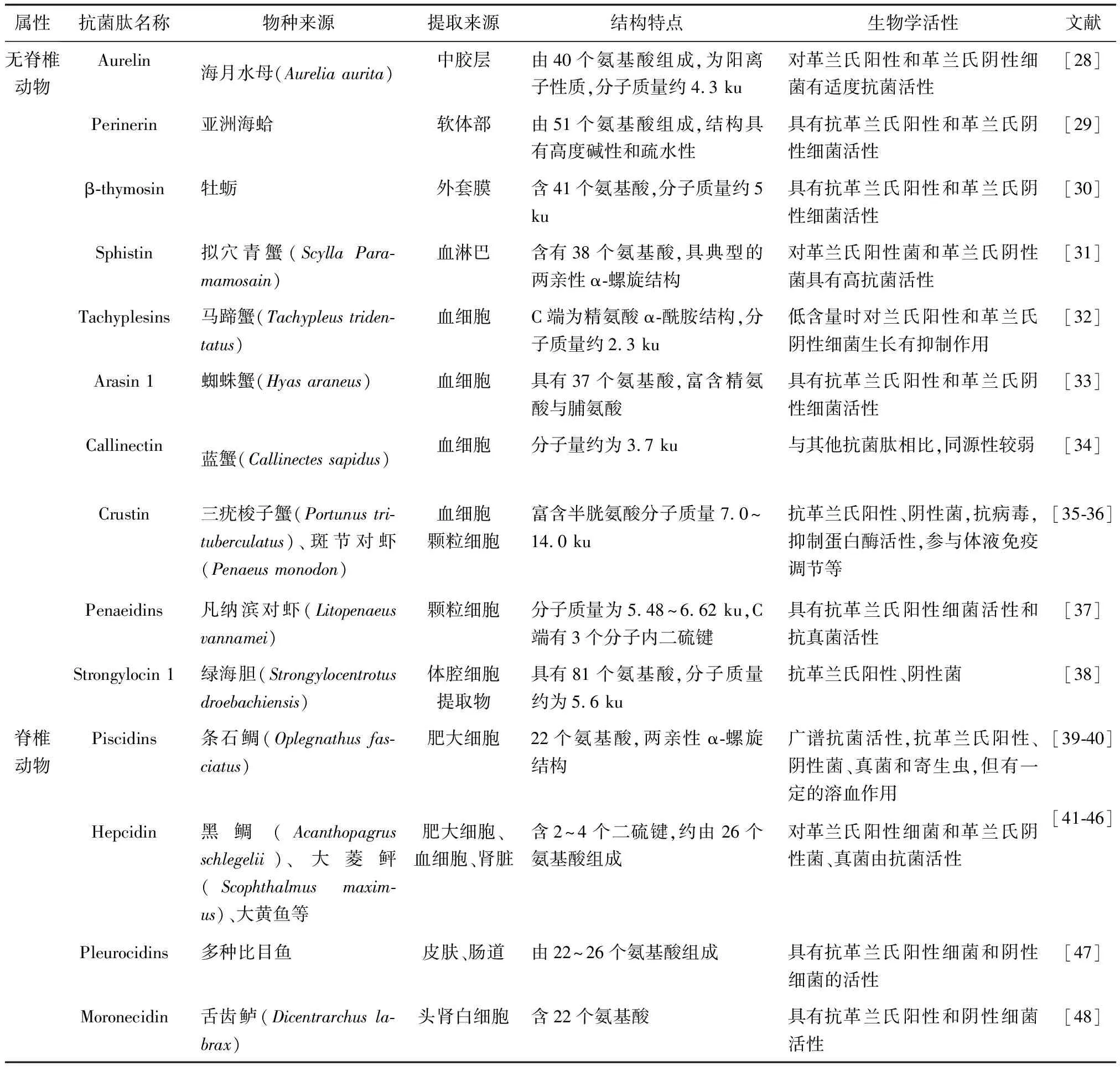
表1 水生动物常见抗菌肽的结构与活性特征
3.1.4 棘皮动物
对棘皮动物中抗菌肽的研究,关于海胆的较多。例如来自绿海胆的Strongylocin 1与Strongylocin 2是一类分别有89和90个氨基酸组成的抗菌肽,具有抗革兰氏阳性、阴性菌活性。
3.2 水生脊椎动物抗菌肽
目前,水生脊椎动物抗菌肽方面的研究关于鱼类的最为丰富。例如Piscidins、Hepcidin、Pleurocidins等,这些抗菌肽大多来源于鱼类皮肤黏液、肠道、血细胞等,具有约24个氨基酸,部分含有α-螺旋结构或二硫键等结构,都具有抗革兰氏阳性、阴性菌活性,少数还可抵抗真菌和寄生虫等。
近期研究发现,某些鱼类的机体含有多种类型功能相似或不同的抗菌肽。Peng等[50]报道了尼罗罗非鱼(Oreochromisniloticus)5种Piscidin类抗菌肽(TP1~5),其中TP3和TP4具有强大的抗菌活性。溶血性试验表明,TP4可诱导人红细胞溶血,两种抗菌肽都显示出对革兰氏阳性菌和阴性菌的抗菌活性,TP3对肿瘤细胞的选择性高于正常细胞,TP3和TP4都具有抗革兰氏阳性和阴性菌活性。Mu等[51]将大黄鱼的lchampl、lchamp2-1/4、lchamp2-2等5种成熟肽纯化合成,发现合成肽对革兰氏阳性和革兰氏阳性有抗菌活性。从不同鱼类体内获得的同种类型的抗菌肽也可能具有不同的活性特征。Shin等[52]通过比较发现,从南极鱼(Nototheniacoriiceps)分离出的两种抗菌肽moronecidin样肽,显示出比2002年首次从杂交条纹鲈(Moronechrysops×M.saxatilis)中分离出来的抗菌肽moronecidin具有更窄的活性光谱和更高的耐盐性。
4 抗菌肽的应用
4.1 提高水产动物的生长性能
抗菌肽可以调理水产动物肠道性能,清除肠道内有害物质,保证胃肠黏膜结构和功能的完整性,提高动物对饲料的消化吸收而促生长[53]。陈奕彬等[54]提出,水产动物食用抗菌肽一段时间后,不仅能提高水产动物生长性能与水产品质量,还可解决抗生素在体内蓄积的问题。适宜蛋白水平下的抗菌肽浓度可降低赤点石斑鱼(E.akaara)组织中部分氧化酶活力,增强肠道消化能力,促进石斑鱼的生长[55]。郑宗林等[56]发现,饲料中添加0.3~0.5 g/kg的抗菌肽显著促进了红姑鱼(Sciaenopsocellatus)的生长。在饲料中添加适量Surfactin,可改善中华鳖(Pelodiscussinensis)稚鳖血液生化指标、提高生长性能[57];在饲料中添加50、100 mg/kg和150 mg/kg的抗菌肽后,促进罗非鱼生长性能的效果与高剂量的黄霉素相似[58]。由此可见,抗菌肽在作为饲料添加剂方向有很大的发展潜力。综上所述,抗菌肽可作为饲料添加剂促进水产动物生长,提高质量增加率和特定生长率,降低饲料系数。但是,水产动物种类多样,抗菌肽对水产动物应用的最适剂量也不尽相同,抗菌肽对水产动物的促生长机制及合理使用亟待深入研究。
4.2 抑制水体病原菌活性
现阶段水产行业迅速发展,水体中普遍存在的病原菌严重影响行业的生产效益。研究发现,水生生物分泌以及人工合成的抗菌肽可有效抑制病原菌的活性。学者从大口黑鲈(Micropterussalmonides)的皮肤、脾脏、肝脏、卵、黏液中提取抗菌肽,对这些抗菌肽进行抑菌性检测,对比检测结果发现,经肝脏与皮肤提取出的抗菌肽对大肠杆菌(Escherichiacoli)和嗜水气单胞菌(Aeromonashydrophila)有抑菌活性,而其他3种提取物则无抑菌效果[59-60]。刘权伟等[61]发现,人工合成鲇鱼(Silurusasotus)黏液的抗菌肽可严重破坏腐败希瓦氏菌(Shewanellaputrefacines)和大肠杆菌的细胞结构,对这两种菌体活性产生有效的抑制。郭子好等[62]将来源锯缘青蟹(S.serrata)的抗菌肽Scygonadin成功转化到毕赤酵母(Pichia)中,并进行抑菌试验,结果发现,Scygonadin的表达产物在长达62 h内可有效抑制溶壁微球菌(Micrococcuslysodeikticus)的生长,相比较而言,此产物对嗜水气单胞菌的抑菌能力较低。将石斑鱼β-防御素的酵母表达载体转化到毕赤酵母中,结果显示,重组抗菌肽可有效抑制大肠杆菌和嗜水气单胞菌的繁殖[63]。人工合成拟穴青蟹抗菌肽Sphistin对嗜水气单胞菌、荧光假单胞菌(Pseudomonasfluorescens)和施氏假单胞菌(P.stutzeri)有极高的抑菌活性,并可破坏大肠杆菌和金黄色葡萄球菌(Staphylococcusaureus)的细胞膜[31]。以上研究表明,抗菌肽可有效抑制水域中多种常见病原菌的活性,如大肠杆菌、嗜水气单胞菌和金黄色葡萄球菌等,从而有效提高养殖动物的成活率。
4.3 增强水产动物的免疫功能
面对着养殖水体中种类繁多的病原微生物,如细菌、病毒和寄生虫等,水产动物的非特异性免疫机制非常重要,是机体基础的防御机制。诸多研究表明,在饲料中添加抗菌肽能够有效提高水生动物的免疫功能。例如在饲料中添加适量抗菌肽S200养殖一段时间后,对凡纳滨对虾进行攻毒试验结果表明,抗菌肽可提高凡纳滨对虾的成活率、溶菌酶活性以及超氧化物歧化酶活性,以此提高机体免疫功能[64]。据彭开松等[65]报道,将鸡的抗菌肽鸡β-防御素13按40 mg/kg的剂量添加到尼罗罗非鱼饲料中,能提高尼罗罗非鱼抗维氏气单胞菌(A.veronii)BJCP-9感染的能力。用抗菌肽Chelonianin处理后,罗非鱼的死亡率大大降低,抗病力显著增强[66]。斜带石斑鱼(E.coioides)经100 mg/kg的Surfactin处理后,肝脏抗氧化能力有所提高[67]。花鳗鲡(Anguillamarmorata)僵苗在饲养过程中因生理代谢功能低下产生机体抗氧化能力降低,继而引起饲养成本增高,对僵苗施以适量的Surfactin后,鱼体肠道的抗氧化能力显著提高[68]。在中华绒螯蟹(Eriocheirsinensis)的饲料中添加0.4%的抗菌肽,饲喂两个月后,中华绒螯蟹的血清溶菌酶活性和一氧化氮含量与对照组相比有增加的趋势(P>0.05),显著提高肝脏、肌肉组织超氧化物歧化酶和总抗氧化水平(P<0.05)[69]。综上所述,添加适量的抗菌肽可有效地提高水产动物免疫相关酶活性和抗氧化能力,进而增强水产动物抗病力。
5 展 望
抗菌肽为一种内源性防御成分,具有广谱性、无残留、不损害正常细胞的优点,在水产养殖业和生物健康免疫领域可替代抗生素,显著提高水产动物的生长性能和免疫功能。但是抗菌肽在成为未来的“绿色药物”道路上仍面临诸多问题,生物体内的抗菌肽含量极微,制成药物时,程序复杂、成本较高,难以大规模生产。在今后的研究中要探明以下几点:(1)抗菌肽种类繁多,结构多样,具体的抗菌抑菌机制还未完全清楚,结构与功能的相关性还需进一步阐明;(2)目前抗菌肽利用的主要方式还是作为饲料添加剂,但是抗菌肽易被蛋白酶水解,如何高效利用抗菌肽仍需进一步探讨;(3)目前抗菌肽主要以发酵生产为主,成本高昂,研究抗菌肽的高效提取及人工合成方法非常必要。未来,随着技术手段的不断创新,新发现的天然抗菌肽及人工合成的抗菌肽种类会越来越多,经济、高效、广谱的抗菌肽无疑具有巨大的应用潜力和广阔的发展前景。
