外源抗坏血酸对鼠尾藻镉胁迫的缓解效应
2019-12-03辛美丽吴海一
吕 芳,辛美丽,丁 刚,吴海一,3
( 1.山东省海洋生物研究院,山东省大型海藻资源保护与应用工程技术研究中心,山东 青岛 266104; 2.青岛市大型海藻工程技术研究中心, 山东 青岛 266104; 3.山东省海水养殖病害防治重点实验室,山东 青岛 266104 )
随着重金属在农业、工业以及化学上的广泛应用,重金属污染日益加剧,产生了严重的环境问题。镉是重金属中毒性较强的元素之一,是植物非必需元素,具有蓄积性,难以去除,且能沿着食物链转移富集,对生物造成毒害[1]。大型海藻作为海洋生态系统的初级生产者, 对海水中的重金属具有高效的富集能力[2-5],在近海污染修复方面显示出广阔的应用前景,具有显著而独特的环境生态效益。
抗坏血酸是植物体内广泛存在的一种小分子物质,在植物抗氧化清除自由基、光合作用、细胞生长和分裂等植物生长发育过程中有着非常重要的生物功能[6-8]。研究表明,一定量的抗坏血酸对逆境胁迫下植物的生长发育、生理代谢、抗氧化系统、超微结构等有明显的改善作用[9-10],从而增强其对环境胁迫的耐受性。有关植物受重金属镉毒害及植物体内缓解镉胁迫的机理已有一些相关报道[11-12],结果显示,抗坏血酸能有效缓解镉对植物的毒害,但关于抗坏血酸缓解大型海藻重金属胁迫的研究则较少。
鼠尾藻(Sargassumthunbergii),属褐藻门、马尾藻科,是我国沿海常见的经济海藻,不仅可以作为海参、鲍鱼等水产动物的优质饵料,还可以作为工业原料用于提取褐藻胶及其他生物活性物质。前期研究表明,鼠尾藻对重金属镉具有较强的富集能力,是海洋生态环境修复的理想生物材料[2],但镉含量较高时会对鼠尾藻的生长和生理产生明显的抑制效应,大大降低其修复镉污染的效率[13]。笔者在前期研究的基础上,探讨外源抗坏血酸对镉胁迫下鼠尾藻的生长和抗氧化指标的影响,旨在为进一步探明大型海藻对重金属耐受的生理机制和在重金属胁迫下外源抗坏血酸对海藻的解毒机理提供理论依据。
1 材料与方法
1.1 试验材料
鼠尾藻于2017年4月6日采自山东省青岛市太平湾潮间带(N 36°05′, E 120°35′)。用低温箱运回实验室,经海水反复清洗去除泥沙及杂质后,置于温度15 ℃、光照度2000 lx、光周期12L∶12D的循环水箱中充气暂养,5 d后用于试验。选取生长健壮、形态和规格较一致[长度(5.0±0.5) cm、质量(1.0±0.1) g]的个体作为试验材料。
1.2 试验方法
试验在容积为1000 mL的三角瓶中进行,每个三角瓶放置3株藻体及800 mL培养液,培养液为过滤海水,添加5.0 mg/L CdCl2·2.5H2O (镉质量浓度由预备试验得到)和不同质量浓度的抗坏血酸进行处理。参照文献[13]及预试验的结果,试验分组如下:
空白对照组;镉胁迫组:5.0 mg/L CdCl2·2.5H2O;20 mg/L抗坏血酸缓解组:5.0 mg/L CdCl2·2.5H2O+20 mg/L抗坏血酸;40 mg/L抗坏血酸缓解组:5.0 mg/L CdCl2·2.5H2O+40 mg/L抗坏血酸;60 mg/L抗坏血酸缓解组:5.0 mg/L CdCl2·2.5H2O+60 mg/L抗坏血酸;80 mg/L抗坏血酸缓解组:5.0 mg/L CdCl2·2.5H2O+80 mg/L抗坏血酸;100 mg/L抗坏血酸缓解组:5.0 mg/L CdCl2·2.5H2O+100 mg/L抗坏血酸。
每个处理3个平行,培养条件同暂养条件,每日更换培养液,培养5 d后进行如下指标测定。
1.3 生物量的测定
生物量的测定以比生长速率[14]表示,取出各处理组的藻体,用滤纸吸干藻体表面的水分,称得鲜质量,计算公式如下:
比生长速率/%·d-1=[(mt/m0)1/t-1]×100%
式中,mt为试验结束时藻体鲜质量(g),m0为试验开始时藻体鲜质量(g),t为培养时间(d)。
1.4 镉含量的测定
鼠尾藻用双蒸水充分清洗后,用滤纸吸干藻体表面的水分,取2 g研磨成匀浆状,采用微波消解后,用原子吸收光谱仪(Thermo Scientific iCE 3500)测定。
1.5 光合色素(叶绿素a和类胡萝卜素)、可溶性糖和可溶性蛋白的测定
光合色素参照文献[15]的方法测定,取0.1 g新鲜藻体研磨成匀浆状,加入8 mL 80%丙酮置于4 ℃黑暗处抽提24 h。4000 r/min、4 ℃离心10 min弃沉淀,上清液用80%丙酮定容至10 mL。以80%丙酮作为空白对照,测定665、652、510、480 nm波长处的吸光值(OD)。重复3次以上,计算平均值。按下式计算叶绿素a含量及类胡萝卜素含量:
叶绿素a含量/mg·g-1=(16.29OD665-8.54OD652)×V/m/1000
类胡萝卜素含量/mg·g-1=7.6×(OD480-1.49×OD510)×V/m/1000
式中,V为浸提丙酮的体积(mL),m为藻体质量(g)。
可溶性糖采用南京建成植物可溶性糖检测试剂盒蒽酮比色法测定,取0.2 g新鲜藻体在液氮中研磨成匀浆状,加8 mL蒸馏水后于80 ℃水浴30 min,冷却后离心定容至10 mL,作为待测溶液。
可溶性蛋白采用南京建成蛋白检测试剂盒考马斯亮蓝法测定,取1 g藻体在液氮中研磨成匀浆状,加蒸馏水后离心定容到10 mL,作为待测溶液。
1.6 抗氧化系统的测定
超氧化物歧化酶、过氧化氢酶的活性和丙二醛含量的测定均用南京建成生物工程研究所试剂盒测定。取1 g新鲜藻体用液氮研磨成匀浆状,加入4 mL提取液(50 mmol/L磷酸缓冲液,pH 7.0;0.1% Triton X-100;1% PVP)[16], 离心取上清液作为待测溶液。
1.7 数据分析
所得数值以平均值±标准差表示。显著性差异用单因素方差分析,分析软件为SPSS 13.0,当P<0.05时为显著性差异。
2 结果与分析
2.1 外源抗坏血酸对镉胁迫下鼠尾藻生长的影响
不同质量浓度抗坏血酸处理对镉胁迫下鼠尾藻生长的影响见图1。5.0 mg/L镉处理严重影响了鼠尾藻的生长,与空白对照组相比,比生长速率下降了58.01%;加入不同浓度的抗坏血酸后,藻体的比生长速率均有了显著提高,并且比生长速率随着抗坏血酸质量浓度的增加呈现先增后略降的趋势,以80 mg/L抗坏血酸处理下的比生长速率最高。

图1 外源抗坏血酸对镉胁迫下鼠尾藻生长的影响 图中线上不同字母表示有显著性差异(P<0.05).下同.
2.2 外源抗坏血酸对镉胁迫下鼠尾藻镉含量的影响
5.0 mg/L 镉处理5 d 后,鼠尾藻体内的镉含量达到了68 μg/g,而加入20 mg/L抗坏血酸后,鼠尾藻体内镉含量降至52 μg/g,且随着加入抗坏血酸质量浓度的增大,鼠尾藻体内镉含量逐渐降低,当加入80 mg/L 抗坏血酸时,降至最低值37 μg/g,比单一镉处理降低了45.59% (P<0.05),而加入100 mg/L抗坏血酸时,藻体内镉含量又略有升高,为43 μg/g(图2)。

图2 外源抗坏血酸对镉胁迫下鼠尾藻镉含量的影响
2.3 外源抗坏血酸对镉胁迫下鼠尾藻叶绿素a、类胡萝卜素、可溶性糖和可溶性蛋白含量的影响
5.0 mg/L镉胁迫下,鼠尾藻藻体颜色变浅,经测定叶绿素a和类胡萝卜素的含量与对照相比分别降低24.90%和23.43%,抗坏血酸加入后,除抗坏血酸质量浓度为20 mg/L的试验组类胡萝卜素的含量略有下降外,其余均显著升高,而且随着加入抗坏血酸质量浓度的增加,均呈先增后略降的趋势,抗坏血酸质量浓度为80 mg/L时达到峰值,叶绿素a和类胡萝卜素的含量较单一镉处理分别增加24.46%和15.89%(图3a, 3b)。
可溶性糖的含量在5.0 mg/L镉胁迫5 d时显著升高,20 mg/L抗坏血酸加入后,变化不明显(P>0.05);40、60 mg/L抗坏血酸加入后,藻体可溶性糖含量显著下降,但两组之间差异不显著(P>0.05);抗坏血酸质量浓度80、100 mg/L处理组可溶性糖的含量进一步下降,两组之间差异不显著(P>0.05) (图3c)。
可溶性蛋白含量在5.0 mg/L镉胁迫下显著下降,仅为对照组的40.65%,而外源抗坏血酸处理显著缓解了这种下降趋势,可溶性蛋白的含量均显著升高,抗坏血酸质量浓度为20~60 mg/L的试验组间差异不显著(P>0.05),抗坏血酸质量浓度为80 mg/L的试验组缓解作用最显著(图3d)。
2.4 外源抗坏血酸对镉胁迫下鼠尾藻超氧化物歧化酶、过氧化氢酶活性和丙二醛含量的影响
镉胁迫导致鼠尾藻超氧化物歧化酶、过氧化氢酶的活性和丙二醛含量显著增加,外加抗坏血酸后,超氧化物歧化酶活性在抗坏血酸质量浓度≥60 mg/L时开始显著下降,且80 mg/L时最低(图4a);过氧化氢酶活性在低质量浓度抗坏血酸(≤40 mg/L)试验组中显著升高,≥60 mg/L时又逐渐下降(P<0.05) (图4b);丙二醛含量在抗坏血酸质量浓度为20~60 mg/L的组间没有显著变化,≥80 mg/L的试验组中才显著下降(P<0.05) (图4c)。



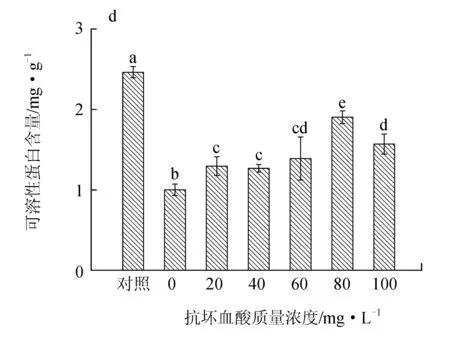
图3 外源抗坏血酸对镉胁迫下鼠尾藻叶绿素a、类胡萝卜素、可溶性糖、可溶性蛋白含量的影响

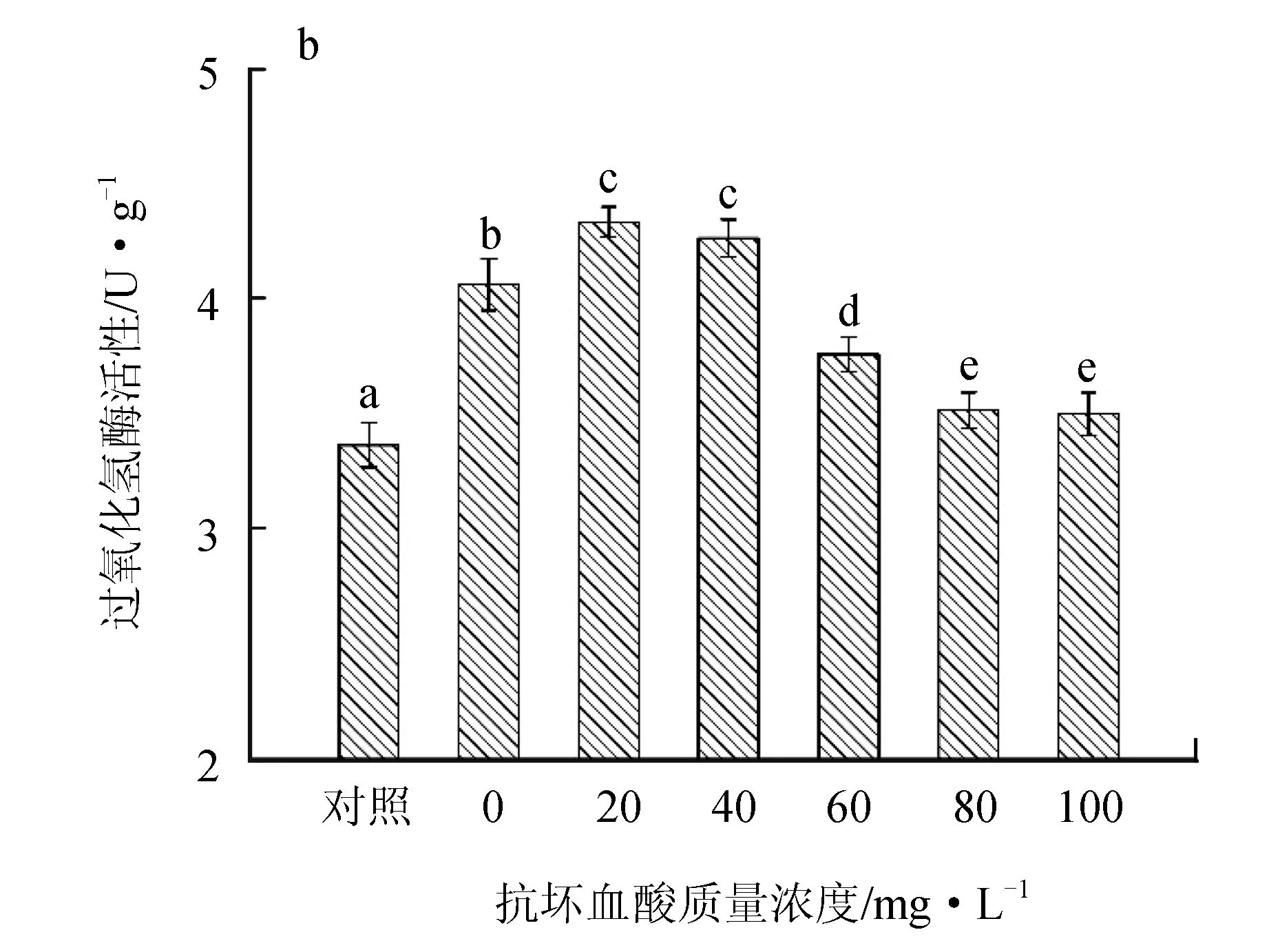
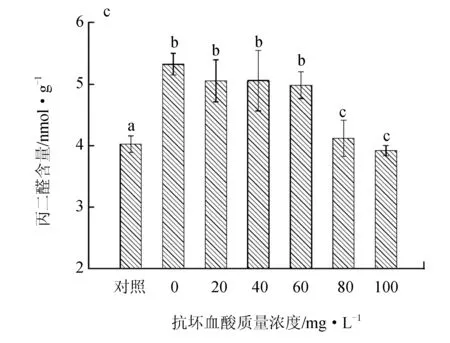
图4 外源抗坏血酸对镉胁迫下鼠尾藻抗氧化系统的影响
3 讨 论
3.1 外源抗坏血酸对镉胁迫下鼠尾藻生长的影响
利用生物监测水体的重金属污染,可用于评估海洋环境中重金属对该地域或生物的污染状况[17]。吴海一等[2]研究发现,鼠尾藻对重金属镉具有较强的富集能力,而且藻体积累金属离子的量与外界环境的金属离子质量浓度正相关,因此可以作为一种指示生物,用于监测海洋环境重金属污染状况。镉是植物非营养元素,高含量下严重阻碍大型海藻的生长,给藻体带来了一系列生理效应[17-20]。本试验结果也显示,5.0 mg/L 镉处理下,鼠尾藻体内镉的含量显著升高,藻体生长受到显著抑制,其生物量、可溶性蛋白的含量显著低于对照组,可溶性糖含量显著升高,诱导组织产生大量的活性氧,藻体的抗氧化酶(超氧化物歧化酶和过氧化氢酶)活性升高,膜脂过氧化产物丙二醛大量生成。
3.2 外源抗坏血酸对镉胁迫下鼠尾藻藻体生化特性的影响
光合生理特征的变化是衡量大型海藻生长状况的首要指标,对光合作用的抑制也是镉对藻体产生的主要毒害作用之一[18,21]。本研究发现,鼠尾藻在镉胁迫下,叶绿素a和类胡萝卜素的含量均显著下降,这可能是色素合成系统对重金属毒害的一种应激反应,也可能是色素体被破坏降解。叶绿素a是大型海藻最重要的光合色素, 因此光合作用的强弱与藻体中叶绿素a的含量息息相关,因此叶绿素a含量的降低将直接导致光合速率的下降。而类胡萝卜素不仅作为辅助色素参与吸收传递光能的过程,而且是植物体内非酶促抗氧化系统,能够有效地清除活性氧,防止膜脂的过氧化,维持膜结构的稳定性,进而起到保护作用[22]。因此,推测类胡萝卜素含量的减少不仅是合成受到了抑制,而且与其参与抗氧化反应有关。加入适当质量浓度的抗坏血酸后,叶绿素a和类胡萝卜素的含量均显著增加,表明抗坏血酸可以缓解镉对叶绿体的破坏作用,有助于提高叶绿体结构的稳定性,对光合色素具有保护效应,从而维持藻体的光合能力。
可溶性蛋白和可溶性糖是植物体内重要的基础物质,在植物体的各种生理活动和功能中起着重要作用,其含量的变化是衡量植物代谢水平的重要指标[23]。本研究中,镉胁迫下,鼠尾藻可溶性蛋白的含量较对照显著减少,而可溶性糖大量累积,说明鼠尾藻对镉有一定的耐受性,在一定范围内可以通过主动积累可溶性糖来降低镉的毒害,但该质量浓度下却影响了蛋白质的合成,或者重金属与巯基结合而导致蛋白质变性失活。而加入适当质量浓度的抗坏血酸后,可溶性蛋白的含量有所回升,可溶性糖含量上升的幅度有所减弱,这也从另一个角度说明适宜质量浓度的外源抗坏血酸在一定程度上减轻了镉对鼠尾藻藻体的胁迫强度。
3.3 外源抗坏血酸对镉胁迫下鼠尾藻抗氧化系统的影响
植物在逆境下,细胞内会产生大量的活性氧,进而通过提高相关抗氧化酶的活性来清除过多的活性氧,从而使植物细胞免受毒害[24]。超氧化物歧化酶是植物抗氧化的第一道防线,对于清除活性氧具有重要的作用[25]。而过氧化氢酶的主要功能是清除细胞质中产生的过氧化氢,从而有效防止过氧化氢在植物体内的积累。超氧化物歧化酶和过氧化氢酶协同作用, 可排除这些氧化产物对植物细胞膜结构的潜在伤害。5.0 mg/L 镉胁迫下,藻体超氧化物歧化酶和过氧化氢酶活性显著升高,以抵抗藻细胞内产生的过多氧自由基,进而适应逆境。而加入一定质量浓度抗坏血酸(≤40 mg/L)后,藻体超氧化物歧化酶和过氧化氢酶的活性仍维持在较高的水平,加入抗坏血酸的质量浓度≥60 mg/L时,超氧化物歧化酶和过氧化氢酶的活性有所下降,原因可能是适宜含量的抗坏血酸缓解了藻体的胁迫,使藻细胞内产生的氧自由基减少,进而诱导产生的超氧化物歧化酶和过氧化氢酶减少。另一方面,抗坏血酸也是一种抗氧化剂,可直接同活性氧反应, 将其还原或者作为酶的底物在活性氧清除中发挥重要作用[26]。
Singh等[27]研究指出,植物细胞膜是重金属毒害作用的主要位点,即发生膜脂过氧化。丙二醛是发生膜脂过氧化的产物之一,其含量的高低可用于衡量植物细胞膜脂过氧化程度和对逆境条件耐受的强弱[28-29]。本试验中,鼠尾藻在镉胁迫下,由于藻体内的自由基累积量增加, 直接导致了膜脂过氧化, 从而使膜脂过氧化产物丙二醛含量也随之增加,说明此质量浓度镉对鼠尾藻造成明显的氧化损伤。随着适当质量浓度抗坏血酸的加入,鼠尾藻对镉的吸收显著降低,同时藻体内抗氧化酶的活性升高(图4),因此抑制了脂质过氧化和膜系统伤害程度, 从而降低了丙二醛的含量,这与在一些高等植物上的研究结果是一致的[30-31]。
4 结 论
综上所述,加入适当质量浓度的抗坏血酸使5.0 mg/L 镉胁迫下鼠尾藻的比生长速率增加,体内富集镉的含量显著降低,提高了叶绿素a、类胡萝卜素及可溶性蛋白的含量和抗氧化酶(超氧化物歧化酶和过氧化氢酶)活性,同时降低细胞内可溶性糖大量累积和膜脂过氧化产物丙二醛的含量,能在一定程度上缓解重金属镉胁迫对藻体的毒害,从而增强了鼠尾藻对重金属镉胁迫的耐受性,且以80 mg/L 抗坏血酸的缓解效果最好。
