温度对海月水母横裂生殖的影响研究
2019-12-03付志璐王一兵
付志璐,王一兵
( 1.广西民族大学,海洋生物资源保护与利用重点实验室,广西 南宁 530008; 2.广西高校微生物与植物资源利用重点实验室,广西 南宁 530008 )
海月水母(Aureliaaurita)是一种广泛分布于世界海域的常见灾害水母,主要分布于N 40°~S 70°的沿岸水域[1-3]。近年来这种水母在东亚水域大规模暴发,对渔业和沿岸发电厂造成严重灾害[4-5]。海月水母主要以浮游动物、鱼卵和仔鱼为食,是鱼类的直接捕食者和食物竞争者,其暴发对渔业资源可捕捞量形成威胁[6-7]。此外,海月水母的大量出现会对沿岸工业设施造成不良影响,因为海月水母经常堵塞核电站、火力发电厂等以海水作为冷却水的冷却水系统管道。因此,阐明海月水母暴发机制,探寻预防及缓解灾害的方法已迫在眉睫。
海月水母的生活史包括底栖无性繁殖的螅状体和浮游有性繁殖的碟状体两个阶段。海月水母浮游生活的第一个阶段称为“碟状幼体”阶段,碟状幼体通过螅状体“横裂生殖”也就是变态发育而产生。在这个过程中,螅状体茎部变长,体表收缩出现裂节,随后裂节逐渐加深,每一个裂节都变成一个带有缺刻的小圆盘,最后每个小圆盘都发育成一个新的碟状幼体。这个过程有助于成体水母种群的扩增,因为一只海月水母的螅状体释放出的碟状幼体可以多达20~30只[8]。有研究表明,海月水母螅状体横裂生殖的引发通常归因于几个环境因子的变化,这些环境因子包括温度、光照、食物[9-20]以及水体的生物化学成分[21](特别是水体中含碘甲状腺素的含量)。在这些因素中,温度对海月水母横裂生殖的发生有着决定性的影响,因为横裂生殖的主要季节与年度最低温度时期相吻合[22-24],但不同地区的海月水母螅状体对温度的响应因地理位置的不同而有差异。如温带地区海月水母的横裂生殖主要发生在季节性降温之后[22-24];然而在亚热带地区的台湾,季节性温暖水温(19~32 ℃)反而会加速海月水母的横裂生殖[16]。虽然国内外已有诸多对海月水母横裂生殖的研究,但目前对濑户内海海月水母横裂生殖的研究尚未见报道。笔者在前人研究基础上,通过室内试验详细观察了来自日本濑户内海海月水母横裂生殖过程中的形态变化,横裂生殖开始时间、持续时间、裂节的数量以及每只螅状体横裂生殖所产生的碟状体数量,以便检验温度对诱导濑户内海海月水母横裂生殖的作用,并对照已有研究结果进行比较分析,另外检验濑户内海地区的海月水母对温度的响应是否会因为生态习性的差异而与其他地区有所不同,以期阐明海月水母暴发机制,探寻预防及缓解海月水母灾害的方法。
1 材料与方法
2010年夏季在濑户内海捕捉成熟海月水母,从其口腕上收集浮浪幼虫,将浮浪幼虫放入直径15 cm、深6.5 cm的透明塑料容器中,容器中装有1 L盐度为32的过滤海水(滤孔直径0.2 μm),容器放置在25 ℃黑暗条件下,以使浮浪幼虫附着在容器的底面和侧壁。当浮浪幼虫附着并变态发育成螅状体后,每周投喂足量的卤虫(Artemia)无节幼体1~2次,投喂1 h后更换新鲜的过滤海水。
试验开始前,将100~200个体型规格相似(柄径长约 1 mm)、发育完全的16触手螅状体用解剖针轻轻从培养容器的底面和侧壁移除,然后将每个螅状体单独放置在1个一次性灭菌培养皿中(直径3.5 cm、深1 cm)。将放有螅状体的小培养皿放入大的透明培养容器中(直径15 cm、深6.5 cm),容器中装有1 L盐度为32的过滤海水。一周后,大部分螅状体均附着在一次性灭菌培养皿的底面。将100只成功附着的螅状体自25 ℃直接转移至9、12、14、16、18 ℃温度下,每个温度下20只螅状体。将各温度下的20只螅状体进行编号(将编号写在每个螅状体所附着的培养皿底面)。每个温度设3个平行,每个平行6~7只螅状体。螅状体培养在0.5 L透明容器中,容器内装有0.5 L过滤海水。试验进行90 d,试验期间螅状体保持饥饿状态,以消除食物的影响,同时每20 d更换1次过滤海水。所有螅状体每日在解剖镜下观察1次,并详细记录各温度下1~20号螅状体形态变化、第1个裂节出现的时间、出现的裂节数量、第1只碟状幼体的释放时间、释放的碟状幼体数量以及最后1只碟状幼体的释放时间。
采用SPSS 13.0软件对各处理组的均值进行单因素方差分析,以P<0.05为差异显著,P<0.01为差异极显著。当方差分析的结果为差异显著时,采用Tukey′s检验进行两两比较,以确定各处理之间的差异。
2 结 果
2.1 横裂生殖期间的形态变化
横裂生殖期间螅状体形态变化的一般特征如下:螅状体的茎上首先出现1个裂节,在随后的几日内,裂节的数量逐渐增多。随后螅状体的触手开始收缩,同时身体渐渐变成红色。当触手完全收缩后,缘瓣上的肌肉开始形成。螅状体茎部的裂节加深,形成多层小圆盘,小圆盘的边缘逐渐形成8个缘叶。当每个小圆盘发育成接近碟状幼体的形态后,就开始搏动。然后发育好的碟状幼体从横裂体的后端一个接一个分离出来。横裂体的基部会再次形成1个小而发育完全的螅状体。
2.2 横裂生殖开始时间、持续时间以及横裂率
试验期间内无任何螅状体死亡。横裂生殖开始时间(或称为预横裂时间)定义为自螅状体转移到试验温度下至其茎部出现第1个裂节的时间。由图1可知,第1只螅状体出现横裂的时间为转移到14 ℃下的第17 d。到第40 d,发生横裂的螅状体增加到8只。直至试验结束,没有螅状体再出现横裂现象。12 ℃下,第1只螅状体发生横裂现象出现在第31 d,随后发生横裂的螅状体数量快速并显著增加。到第42 d为止,共有13只螅状体发生横裂。在9 ℃下,第1只螅状体出现横裂的时间为第41 d,到第70 d,发生横裂的螅状体数量增至13只。在16 ℃下,第1只螅状体发生横裂的时间为第39 d,共有5只螅状体出现横裂现象。在18 ℃下,仅有1只螅状体在第83 d发生了横裂。在90 d的试验期间内,所有的螅状体仅发生过1次横裂生殖,无螅状体出现2次横裂生殖现象。

图1 不同温度下海月水母螅状体横裂生殖的累积数量
横裂生殖开始所需要的平均时间在9、12、14、16、18 ℃下分别为(51.0±1.7)、(38.6±6.5)、(31.1±7.9)、(49.7±6.1)d和83 d(图2)。由于16、18 ℃下的数据不足,只能对剩余温度下的数据进行统计分析。统计结果显示,不同温度下海月水母螅状体的横裂生殖开始所需的平均时间差异显著(单因素方差分析,P<0.05),14 ℃下横裂生殖开始所需要的时间要明显短于9 ℃下的时间(Tukey′s多重比较,P<0.05)。

图 2 不同温度下海月水母的预横裂时间和横裂时间误差线:标准差.图中不同字母表示显著差异(P<0.05).下同.
自螅状体第1个裂节出现的时间到最后1个碟状幼体释放结束的时间被定义为横裂生殖持续时间。平均横裂持续时间在9、12、14、16、18 ℃下分别为(22.7±2.9)、(10.9±1.2)、(9.2±1.0)、(5.3±1.8)和5 d(图2),各温度间横裂持续时间差异极显著(单因素方差分析,P<0.01)。横裂持续时间在12、14 ℃下显著低于9 ℃(Tukey′s多重比较,P<0.05)。在9、12、14、16、18 ℃下分别有13、13、8、5、1只螅状体出现了横裂生殖现象,相当于各温度下横裂率分别为64.3%、65.1%、39.7%、26.2%和4.8%(图3)。平均横裂率在各温度下差异显著(P<0.05)。18 ℃下的横裂率要显著低于9 ℃和12 ℃(P<0.05)。

图3 不同温度下海月水母螅状体的平均横裂率
2.3 碟状幼体的释放
碟状幼体释放量随时间的变化趋势(图4)与横裂生殖发生模式(图1)类似。9 ℃下,横裂体所释放的碟状幼体数量最多,为36个。14 ℃下,横裂体所释放的碟状幼体的数量与9 ℃相近,为34个。其余温度下碟状幼体的释放数量依次为12 ℃>16 ℃>18 ℃(图4)。9、12、14、16、18 ℃下,每只横裂体释放的碟状幼体平均数量分别为(2.8±0.4)、(2.3±0.3)、(4.1±0.1)、(2.1±0.6)个和4个(图5),水温对释放的碟状幼体数量影响极显著(P<0.01)。14 ℃下每只横裂体所释放的平均碟状幼体数量极显著高于其他温度(P<0.01)。
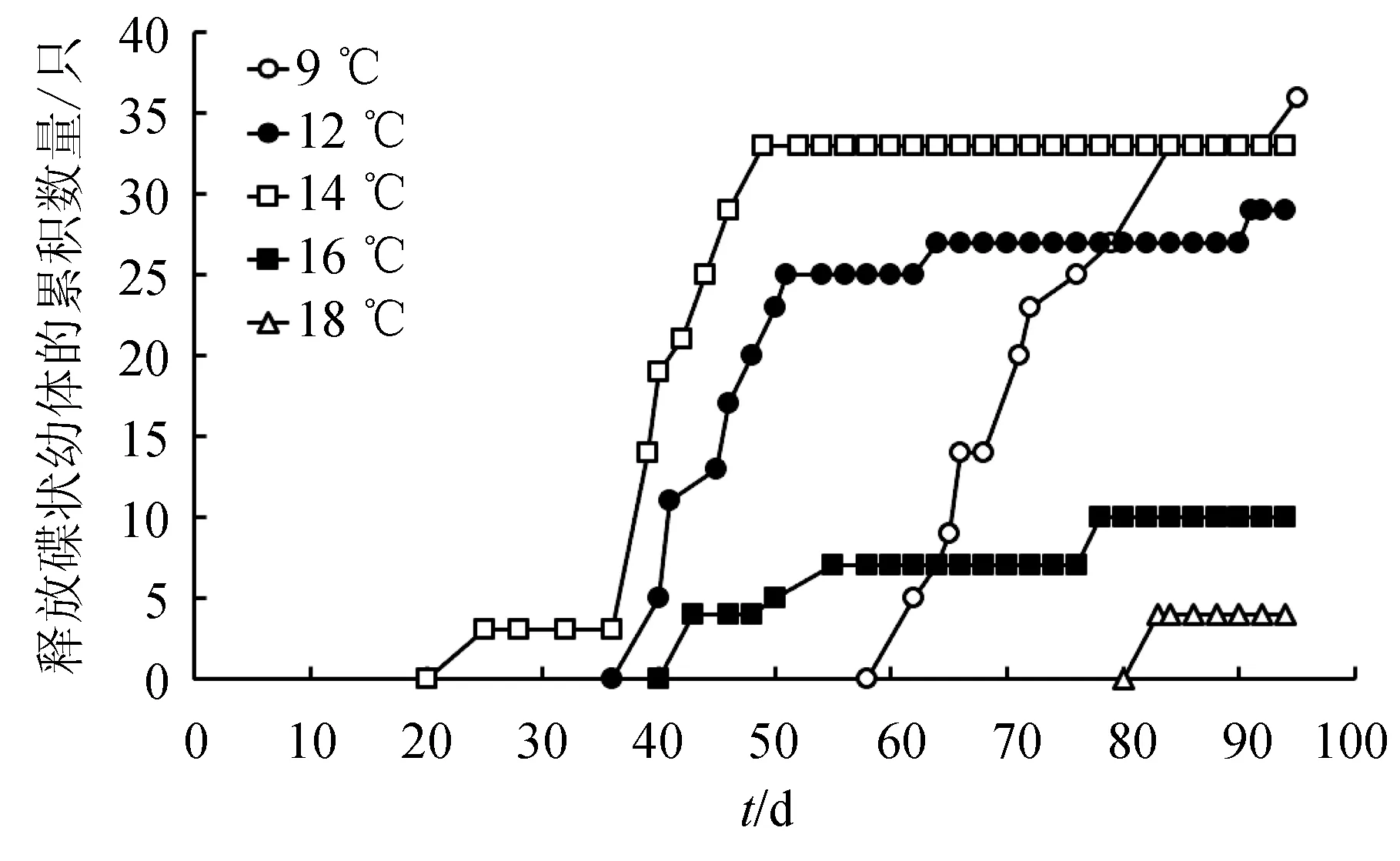
图4 不同温度下每月水母螅状释放的碟状幼体的累积数量

图5 不同温度下平均每只海月水母螅状体所释放的碟状幼体数量柱内数字为用于计算的螅状体数量,菱形为所释放的碟状幼体的最大数量.
3 讨 论
与以往在整个群体水平上进行的大多数国内研究不同,本试验对海月水母横裂生殖的研究在个体水平上进行。每个水温下的20只螅状体均单独附着在各自的培养皿中,且每个培养皿均有编号。这种方法优点是既可保证试验数据的精确性,各螅状体之间不会混淆,又可分清不同螅状体所释放的碟状幼体。
3.1 水温对海月水母横裂生殖发育的影响
试验证实,降温可以诱导海月水母螅状体发生横裂生殖现象,这一结果与已有的研究结果基本一致。诸多研究表明,降温能够诱导海月水母发生横裂生殖,Kroiher等[25]报道,降温会导致法国北海地区的海月水母螅状体发生横裂生殖。Holst[26]表明,德国黑尔戈兰岛地区的海月水母螅状体在10 ℃下的横裂率要高于15 ℃下的螅状体。Wang等[17]报道,中国胶州湾地区的海月水母在水温降至17 ℃以下时会发生横裂生殖。与其他温带地区相似,日本地区的海月水母螅状体横裂生殖的主要时间同样出现在季节性降温之后[22-24],但日本不同地区海月水母螅状体发生横裂生殖的水温略有不同。据Kakinuma[27]报道,当温度降至18 ℃以下时,日本北部奥陆湾的海月水母螅状体会发生横裂生殖。Han等[28]报道,日本西南部本庄地区的海月水母螅状体在转移至低于14 ℃的温度后,停止摄食,随之出现了横裂生殖现象,但在18 ℃下螅状体并未出现横裂生殖。本研究所用海月水母螅状体(来自日本濑户内海)在9 ℃和18 ℃之间出现了横裂生殖现象。尽管与其他较低的温度相比,18 ℃下发生横裂生殖的速度相当缓慢,但在此温度下螅状体仍然出现了横裂生殖现象,据此推断,18 ℃可能是诱导濑户内海海月水母螅状体发生横裂生殖的温度上限。
3.2 水温对海月水母预横裂时间的影响
研究证实,温度会影响海月水母螅状体横裂生殖开始的时间。14 ℃下最先开始出现横裂生殖现象,12 ℃或16 ℃下,横裂生殖的开始时间延迟了1~3周。已有诸多研究报道过海月水母横裂生殖在不同水温下的开始时间,但不同螅状体在相同或相似的水温下横裂生殖的反应却并不相同。在台湾南部,在20~30 ℃内,温度越高海月水母螅状体横裂生殖现象出现越早[16]。中国胶州湾地区,在4~16 ℃内,海月水母螅状体也呈现温度越高横裂生殖现象开始越早的趋势[17-18]。海月水母的同属种A.labiata也与此相似。太平洋东北部华盛顿地区的A.labiata在7~20 ℃内,同样也是较高温度时横裂生殖现象出现更早[15]。与此相反,Kroiher等[23]报道,温度降低幅度越大,横裂生殖开始的时间越早。Han等[28]也报道,横裂生殖在10 ℃下比14 ℃下出现的更早。本试验结果显示,中等寒冷的温度下横裂生殖开始得最早,这与一些研究所报道的在发生横裂生殖的温度范围内,温度越高横裂生殖开始得越早,或降温幅度越大横裂生殖开始得越早不一致。此外,本试验所使用的海月水母螅状体与Han等[28]所用的螅状体均来自日本,并且螅状体来源地的地理距离并不远,然而螅状体对降温的反应却并不相同。本试验结果与其他研究结果的不同,是由于螅状体对各自栖息地环境条件的适应所造成的生理条件不同所致。
3.3 饥饿对海月水母释放碟状幼体数量的影响
为了消除食物引起的影响,螅状体在转移到试验温度后保持饥饿状态,所以在90 d的试验中,所有的螅状体仅横裂生殖1次,每只螅状体所释放的碟状幼体的数量也较少,仅2~4个。有研究曾指出[17,29-30],在适宜的饵料丰度范围内,饵料丰度越高,螅状体所释放的碟状幼体数量就越多。此外,还有研究观察到,海月水母螅状体在摄食充分的食物后会发生多次横裂生殖现象[12,31]。对A.labiata横裂生殖的观察也是同样的发现[15],在每周充分投喂2次卤虫的条件下,多数A.labiata螅状体在120 d的试验中发生了2~3次横裂生殖。因此本试验中,如果螅状体在横裂生殖过程中摄食了充足的食物,它们可能会发生多次横裂生殖以及释放出更多的碟状幼体。
3.4 暖冬对海月水母暴发的影响
尽管本试验结果显示9 ℃和12 ℃下海月水母的横裂率几乎相同,但是12 ℃下的横裂时间仅为9 ℃的1/2。同时,12 ℃下横裂生殖开始时间(预横裂时间)比9 ℃下缩短了12.4 d。此外,已有的研究报道,海月水母螅状体在较高的温度下身体生长的速度更快[17,28-30]。因此,若食物充足,海月水母螅状体在较高的水温下会比在低温条件下发生更多次横裂生殖,从而释放出更多的碟状幼体。海月水母碟状幼体在濑户内海的释放时间通常为冬季及早春(水温9~15 ℃),而此时水温每升高1 ℃,海月水母横裂生殖开始时间就会缩短4.1 d,同时横裂持续时间会缩短3.9 d。因此,根据研究可以推断,如果濑户内海冬季水温偏高,则下一年度海月水母种群数量可能会大幅度增加。
对于海月水母螅状体的所有试验结果表明,12~14 ℃是最适合海月水母横裂生殖的温度,因为在此温度范围内横裂生殖开始的最快,并且发生横裂生殖的螅状体比例更大。对其他温带地区海月水母进行的类似试验结果与日本濑户内海海月水母有相同的趋势:中等寒冷的温度下有更高的横裂率[25]。本研究的结果表明,暖冬可能会导致日本濑户内海海月水母在下一年度暴发。
4 结 论
试验结果表明,温度对诱导日本濑户内海海月水母的横裂生殖有显著影响。18 ℃是诱导螅状体发生横裂生殖的温度上限。横裂开始时间受温度影响显著,14 ℃时平均预横裂时间最短,±2 ℃横裂生殖开始时间会延迟1~3周。横裂率同样受温度的影响,在9 ℃和12 ℃下最高(约65%)。横裂持续时间随温度升高而下降。每个螅状体释放的碟状幼体平均数量在各温度下差异显著,14 ℃时最高。综上所述,12~14 ℃内横裂生殖开始时间最短,横裂生殖的螅状体比例更大,是海月水母横裂生殖的最佳温度。由此可以推出,暖冬可能会导致日本濑户内海海月水母在下一年度暴发。
