氮源和氮磷比对威氏海链藻生长与光合指标的影响
2019-12-03任虹烨闫永芳陈家宇周文礼
窦 勇,任虹烨,吴 琳,闫永芳,陈家宇,周文礼
( 天津农学院 水产学院,天津市水产生态及养殖重点实验室,天津 300384 )
威氏海链藻(Thalassiosiraweissflogii)是一种典型的中心纲浮游硅藻,其细胞壁由无定型二氧化硅构成,具有精致的纳米分级结构,而且细胞壳体多孔,比表面积大,光学和机械加工性能良好,在制备新型纳米原料与器件(如微型传感器、微过滤器、生物载体等)时具有独特优势[1-3],此外威氏海链藻还可以应用到水产养殖领域,作为鱼虾的开口饵料[4],而且威氏海链藻生长速度快、易于培养、遗传性状稳定,因此被看做一种非常有开发应用前景的资源微藻。
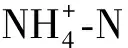
本研究综合考察了不同氮源与氮磷比条件下威氏海链藻的生长速率、叶绿素a含量以及PSⅡ光化学活性,探讨了氮源和氮磷比对威氏海链藻生命活动的影响作用,以期为威氏海链藻的集约化、规模化培养提供依据。
1 材料与方法
1.1 藻种来源与培养条件
试验所用威氏海链藻由卫星海洋动力学国家重点实验室提供,采用f/2培养基,盐度30,培养温度22 ℃,光暗比12 h∶12 h,光照度3300 lx。培养期间每日定时摇瓶6次,防止微藻细胞附壁、下沉。选取处于对数生长期的威氏海链藻进行试验。
1.2 试验设计
1.2.1 氮源作用试验
以f/2培养基中的氮、磷浓度为基准(总氮0.8824 mol/L,总磷0.0367 mol/L),以NaH2PO4为磷源,分别以NaNO3、NaNO2、NH4Cl、(NH2)2CO作为外加氮源。按1∶1的接种比例将威氏海链藻(初始密度均为0.6×104个/mL)接种于250 mL三角瓶中,液体总量为150 mL。每个试验组设置3个平行,试验重复3次。在试验的第2、4、6、8 d取样分析。
1.2.2 氮磷比作用试验
以f/2培养基中的氮、磷浓度为基准(总氮0.8824 mol/L,总磷0.0367 mol/L),以NaNO3和NaH2PO4作为氮源和磷源,分别固定培养基中总氮和总磷浓度不变,设置氮磷比4∶1、8∶1、12∶1、16∶1和20∶1的试验组(表1),每个试验组设置3个平行。氮磷比分别通过添加NaNO3和NaH2PO4进行调节。在试验的第2、4、6、8 d取样分析。

表1 不同氮磷比条件下氮、磷初始浓度
1.3 分析指标与测定方法
1.3.1 威氏海链藻细胞密度测定
使用XB-K-25型血球计数板(25×16 mm)在光学显微镜下计数威氏海链藻细胞密度。
1.3.2 叶绿素a含量测定
吸取2 mL藻液置于离心管中,在4 ℃下以12 000 r/min离心5 min,用移液枪吸去上清液,加入80%丙酮对藻泥进行再悬浮,然后用锡箔完全包裹离心管,在暗处置于55 ℃水浴中30 min,再于4 ℃下以12 000 r/min离心5 min,将上清液转移至10 mL离心管中,并用80%丙酮定容至5 mL,使用UV-1240紫外—可见分光光度计测定663 nm吸光度(OD663),然后根据下列公式计算叶绿素(chl-a)质量浓度[12]:
1.3.3 PSⅡ光化学活性测定
使用德国Walz公司生产的IMAGING-PAM调制脉冲荧光仪测定PSⅡ光化学活性。向比色杯中依次加入3 mL蒸馏水和15 μL藻液,混匀,将样品暗适应15 min,读取Fv/Fm和ETR数值。
1.4 数据处理与分析
所有试验数据均以平均值±标准差表示。使用SPSS 17.0软件进行单因素方差分析,并采用Duncan方法进行多重比较,显著性水平α=0.05。处理组间没有相同字母的表示差异显著(P<0.05),有相同字母的表示差异不显著(P>0.05)。
2 结果与分析
2.1 氮源对威氏海链藻的影响
2.1.1 氮源对威氏海链藻细胞密度的影响
试验前4 d 威氏海链藻细胞密度变化缓慢,而且在试验大多数时间不同氮源对威氏海链藻细胞密度没有显著影响(P>0.05),仅在第6 d以(NH2)2CO作为氮源的试验组细胞密度显著高于NaNO3组(P<0.05),此时(NH2)2CO组平均细胞密度为3.67×104个/mL,是细胞密度最低的NaNO3组的3.17倍(图1)。

图1 不同氮源对威氏海链藻细胞密度的影响
2.1.2 氮源对威氏海链藻叶绿素a质量浓度的影响
试验初期不同氮源对威氏海链藻叶绿素a质量浓度的影响并不显著(P>0.05),至第4 d时,(NH2)2CO组叶绿素a质量浓度显著高于NaNO3和NaNO2组(P<0.05),第6 d,(NH2)2CO组微藻细胞叶绿素a质量浓度显著高于其他试验组(P<0.05),此时(NH2)2CO组平均叶绿素a质量浓度为279.25 mg/L,至试验结束时微藻叶绿素a质量浓度呈现(NH2)2CO>NH4Cl>NaNO2>NaNO3的规律(图2)。

图2 不同氮源对威氏海链藻叶绿素a质量浓度的影响
2.1.3 氮源对威氏海链藻PSⅡ光化学活性Fv/Fm的影响
试验早期威氏海链藻Fv/Fm并未受不同氮源的显著影响(P>0.05),至第4 d时,(NH2)2CO组微藻Fv/Fm达到0.58并显著高于其他试验组(P<0.05),至第6 d时,(NH2)2CO组Fv/Fm接近NaNO2组且均显著高于NaNO3组(P<0.05),至试验结束NaNO2组Fv/Fm达最高为0.60且显著高于NaNO3组(P<0.05)(图3)。

图3 不同氮源对威氏海链藻 Fv/Fm的影响
2.1.4 氮源对威氏海链藻PSⅡ光化学活性ETR的影响
试验初期不同氮源对威氏海链藻ETR的影响不显著(P>0.05),至第4 d时,(NH2)2CO组微藻ETR达34.67且显著高于其他试验组(P<0.05),随着试验进行,NaNO3和NH4Cl组微藻ETR变化缓慢,至第6 d时,(NH2)2CO组微藻ETR最高为51.33且显著高于NaNO3和NH4Cl组(P<0.05),而试验结束时NaNO2组ETR最高为32.66且显著高于NaNO3和NH4Cl组(P<0.05)(图4)。
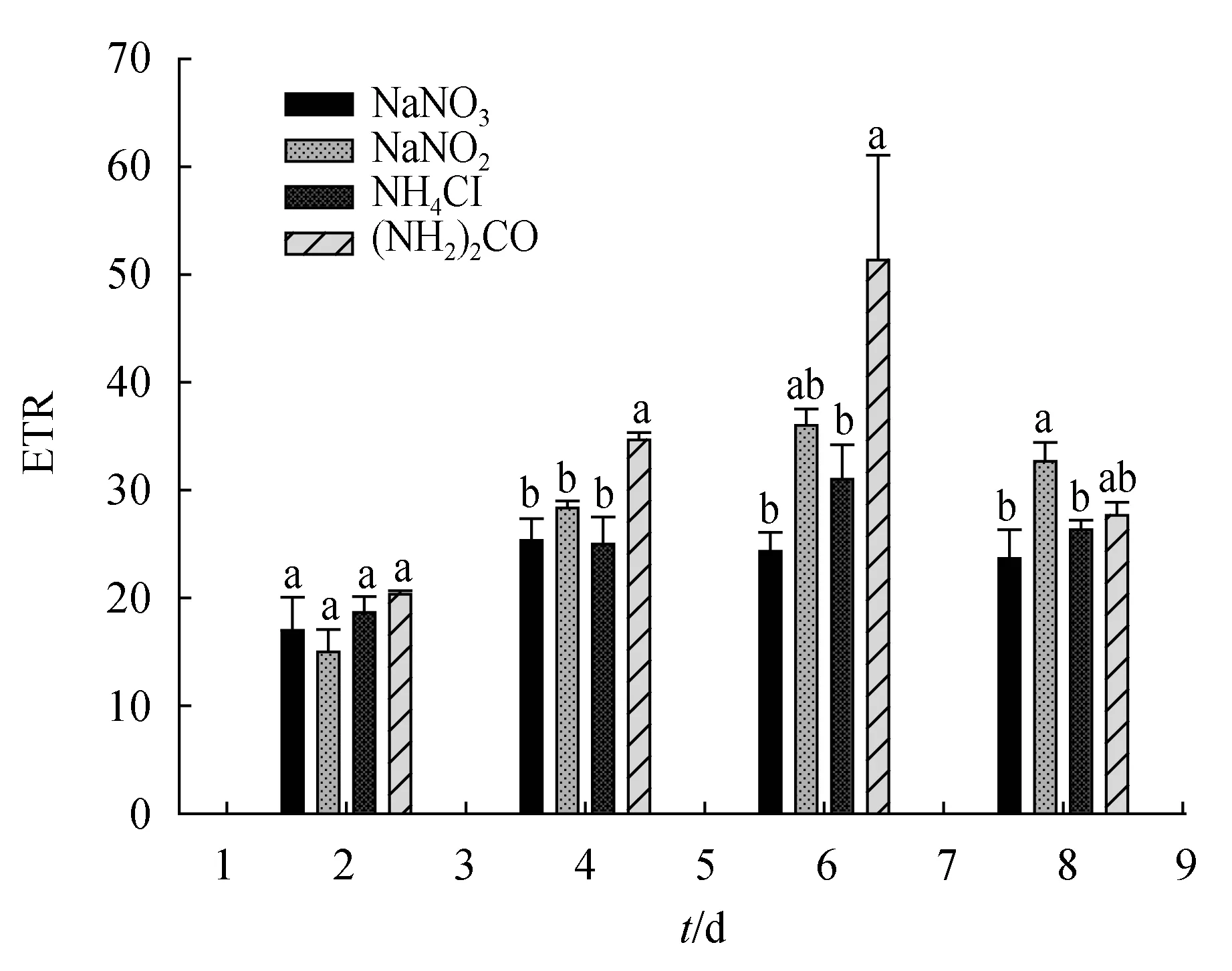
图4 不同氮源对威氏海链藻ETR的影响
2.2 氮磷比对威氏海链藻的影响
2.2.1 氮磷比对威氏海链藻细胞密度的影响
在固定总氮不变的条件下,各试验组的威氏海链藻细胞密度随培养时间延长呈不断上升的趋势(图5a)。试验初期各处理组微藻细胞密度差异不大,但在第4 d氮磷比4∶1组细胞密度增幅最大为5.33×104个/mL,且显著高于其他处理组(P<0.05),此后氮磷比8∶1、12∶1、16∶1组的细胞密度增幅加快,至第6 d氮磷比4∶1组的细胞密度仅显著高于氮磷比20∶1组(P<0.05),至试验结束各处理组威氏海链藻细胞密度无显著差异(P<0.05)。
在固定总磷不变的条件下,培养期间各试验组细胞密度变化幅度较小且维持在较低水平(1.50×104~1.83×104个/mL),而且不同氮磷比对威氏海链藻的细胞密度均无显著影响(P>0.05)(图5b)。
试验期间固定总氮各组威氏海链藻细胞密度和变化幅度均显著高于固定总磷各组,固定总氮各组的平均细胞密度是固定总磷各组的1.51倍。
2.2.2 氮磷比对威氏海链藻叶绿素a质量浓度的影响
在固定总氮不变的条件下,各试验组的威氏海链藻叶绿素a质量浓度随时间延长不断上升(图6a)。试验前4 d氮磷比4∶1组叶绿素a质量浓度均显著高于其他处理组(P<0.05),至第6 d氮磷比4∶1组微藻叶绿素a质量浓度显著高于氮磷比8∶1、12∶1和20∶1组(P<0.05),但与氮磷比16∶1组差异并不显著(P>0.05),至试验结束时氮磷比4∶1组叶绿素a质量浓度达572.34 mg/L且显著高于其他处理组(P<0.05),16∶1组的叶绿素a水平显著高于12∶1和20∶1组(P<0.05),而氮磷比12∶1和20∶1组的叶绿素a质量浓度最低分别为306.23 mg/L和306.73 mg/L,仅为氮磷比4∶1组的53.50%。
在固定总磷不变的条件下,培养期间各试验组威氏海链藻叶绿素a质量浓度变化幅度较小且维持在较低水平(66.25~174.28 mg/L),在大多数时间点各处理组叶绿素a质量浓度差异并不显著(P>0.05),仅在第6 d氮磷比4∶1和8∶1组的微藻叶绿素a质量浓度显著高于氮磷比20∶1组(P<0.05)(图6b)。
试验前4 d时固定总氮各组威氏海链藻叶绿素a水平与固定总磷的各组差别不大,此后随试验延续固定总氮组叶绿素a质量浓度逐渐高于固定总磷组,整个试验期间固定总氮各组的平均叶绿素a质量浓度为固定总磷各组的1.99倍。

图5 氮磷比对威氏海链藻细胞密度的影响a.固定总氮,b.固定总磷.下同.
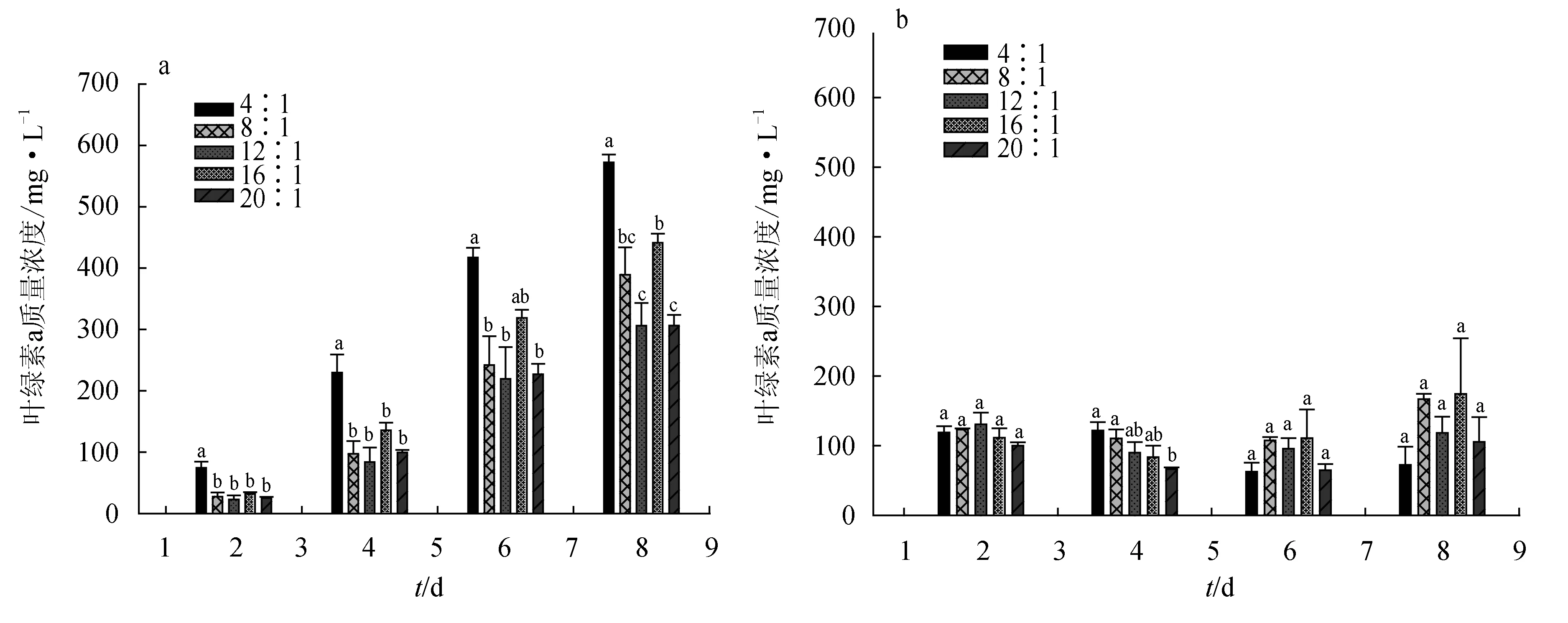
图6 氮磷比对威氏海链藻叶绿素a质量浓度的影响
2.2.3 氮磷比对威氏海链藻PSⅡ光化学活性Fv/Fm的影响
在固定总氮不变的条件下,随着试验延续威氏海链藻的Fv/Fm呈不断下降的趋势,而氮磷比对微藻Fv/Fm的影响并不显著(P>0.05)(图7a)。
在固定总磷不变的条件下,威氏海链藻的Fv/Fm呈逐渐上升的趋势(图7b)。试验初期氮磷比对微藻Fv/Fm的影响并不显著(P>0.05),第4 d氮磷比4∶1组微藻Fv/Fm仅为0.35且显著低于其他试验组(P<0.05),试验第6 d氮磷比12∶1组微藻Fv/Fm最低为0.46且显著低于其他试验组(P<0.05),至试验结束时各处理组Fv/Fm未呈现显著差异(P>0.05)。
试验期间固定总氮各组威氏海链藻Fv/Fm的变化趋势与固定总磷各组恰好相反,但是固定总氮各组的平均Fv/Fm水平与固定总磷各组十分接近,分别为0.48和0.45。

图7 氮磷比对威氏海链藻 Fv/Fm的影响
2.2.4 氮磷比对威氏海链藻PSⅡ光化学活性ETR的影响
在固定总氮不变的条件下,随着试验延续威氏海链藻的ETR呈不断下降的趋势,而氮磷比对各试验组ETR的影响并不显著(P>0.05)(图8a)。
在固定总磷不变的条件下,威氏海链藻的ETR呈逐渐上升的趋势(图8b)。试验初期不同试验组微藻的ETR差异并不显著(P>0.05),第4 d氮磷比4∶1组微藻ETR最低仅为13.67且显著低于氮磷比16∶1组(P<0.05),试验第6 d氮磷比12∶1和16∶1组 ETR接近且显著低于氮磷比8∶1组(P<0.05),至试验结束时氮磷比4∶1组微藻ETR水平最低为22.67且显著低于氮磷比8∶1、16∶1和氮磷比20∶1组(P<0.05)。
试验期间固定总氮各组威氏海链藻ETR的变化趋势与固定总磷各组恰好相反,固定总氮各组的平均ETR水平是固定总磷各组的1.59倍。
图8 氮磷比对威氏海链藻ETR的影响
3 讨 论
3.1 氮源对威氏海链藻生长及生理代谢的影响

3.2 氮磷化学计量比对威氏海链藻生长及生理代谢的影响
Justic等[17]总结前人成果,提出了限制浮游植物生长的氮磷营养盐化学计量比(摩尔比)阈值:氮磷比>16时为磷限制,氮磷比<16时为氮限制。有学者发现[18],在室内培养过程中假微型海链藻(T.pseudonana)吸收氮的速度快于磷,氮限制能强烈抑制细胞分裂和光合潜能(Fv/Fm),而在磷限制时假微型海链藻仍可以进行细胞分裂并能维持与对照组相同水平的Fv/Fm,这暗示氮素对假微型海链藻生长与光合作用的影响强于磷。另有学者指出[19],最适合假微型海链藻生长的氮磷比为16∶1。但也有学者证实磷限制会影响威氏海链藻的大分子合成途径,造成132种蛋白的丰富度发生显著变化。以上结果说明,不同种类微藻生存策略和生理代谢机制的差异会显著影响对氮磷营养盐的吸收利用。有学者调查发现[20],在胶州湾和桑沟湾海域,随着氮磷比上升,海区初级生产力和叶绿素a水平均上升,微藻类群中硅藻比例提高而甲藻比例下降。而有学者通过试验证实[21],在氮、磷限制条件下,东海原甲藻(P.donghaiense)和链状亚历山大藻(Alexandriumcatenella)细胞氮磷储存能力和利用胞内储存氮磷进行生长繁殖的潜力明显高于中肋骨条藻(Skeletonemacostatum)和尖刺拟菱形藻(Pseudo-nitzschiapungens)。本研究发现,在相同氮磷比条件下固定总氮的试验组威氏海链藻的生长指标和光合活性均明显高于固定总磷的处理组,这说明在相同氮磷比条件下提高氮磷营养盐质量浓度有助于促进威氏海链藻的生长性能与光合能力,而氮对威氏海链藻的生长和生理状态的作用强于磷,这与刘皓等[22]的报道相符。有研究发现[23],“总氮=10 mg/L+总磷=0.5 mg/L”的条件最适合水华微囊藻群体形成与发展(形成的群体最大可达900 个),而过高或过低的氮磷含量均不利于微囊藻细胞生长与聚集,另外氮限制和磷限制都可以促进微囊藻胞外多糖合成有利于形成细胞集群。有研究发现[24],氮限制显著抑制了三角褐指藻(Phaeodactylumtricornutum)的生长速率与光合活性,叶绿素a含量较氮充足时降低了73%,细胞PSⅡ光反应中心部分关闭,Fv/Fm下降为初始值的64%~71%,三角褐指藻的光抑制程度加剧且对高光的耐受性降低。本研究中氮磷比为4∶1试验组(固定总氮)的细胞密度和叶绿素a质量浓度相对较高,这与王敏等[10]的结论一致,说明高于基准值浓度的氮磷营养盐可以抵消氮限制对威氏海链藻生长的影响,而氮磷比较大的试验组(固定总磷)Fv/Fm和ETR相对较低,暗示低于基准值浓度的氮素不利于缓解氮限制造成的微藻光合效能下降。
本研究仅从现象层面描述了氮源形态和氮磷化学计量比对威氏海链藻生长及生理代谢的影响,但是却引出了海洋微藻所具有的对营养盐的差异化吸收和同化的问题,针对此类问题有学者已经构建了数学模型来描述营养盐对海洋浮游植物生长的影响以及微藻对无机盐类的吸收、同化模式,并对模型中的关键参数进行了测定[25-26]。而随着科技的进步,放射性同位素示踪、核磁共振、膜片钳以及快速荧光动力学等技术纷纷引入,为揭示海洋微藻对无机营养盐的选择性吸收和同化的机理提供了可靠的研究方法[27-28]。
4 结 论
(1)相较于无机氮源,(NH2)2CO更加有利于提高威氏海链藻细胞密度和叶绿素a质量浓度,试验中(NH2)2CO处理组威氏海链藻最大细胞密度和叶绿素a质量浓度分别达3.67×104个/mL和279.25 mg/L。
(2)在分别固定总氮和总磷不变的条件下,不同氮磷比处理组威氏海链藻的细胞密度、叶绿素a质量浓度、Fv/Fm和ETR均呈现相反的变化趋势。
(3)试验期间固定总氮各组威氏海链藻的平均细胞密度、平均叶绿素a质量浓度和平均ETR水平均明显高于固定总磷各组,而固定总氮各组的平均Fv/Fm水平与固定总磷各组十分接近。
