生精障碍患者227例遗传学分析
2019-12-03毕亮亮黄岩杰杨晓青梅晓峰李金刚白梦刻
李 静,毕亮亮,黄岩杰,杨晓青,梅晓峰,李金刚,白梦刻
河南中医药大学第一附属医院儿科实验室 郑州 450000
不孕夫妇中男性不育的占比为30%~40%,其中生精障碍(少精、弱精和无精)是导致男性不育和生育力下降的主要原因[1-2],有10%~15%的男性不育与遗传因素有关,染色体和Y染色体微缺失是主要的遗传因素[3]。本研究回顾性地分析了227例生精障碍患者的染色体核型和Y染色体上精子发生调控基因无精子因子(azoospermia factor,AZF)微缺失检测结果,并结合临床资料,探讨遗传学检查在生精障碍患者诊断中的意义。
1 对象与方法
1.1研究对象2011年1月至2017年1月以不育为主诉来河南中医药大学第一附属医院就诊的男性患者,年龄在21~48岁。经临床和实验室检查排除精道梗阻、泌尿生殖道感染、隐睾、精索静脉曲张等因素引起的生精障碍。其中有227例进行了染色体G显带分析和AZF 8个位点检测。
1.2染色体核型分析用肝素钠管抽取2 mL外周血,进行外周血淋巴细胞培养。常规进行染色体G显带分析,每例计数分析30个核型,疑为嵌合体者加倍分析,必要时增加C显带分析,如:qh+、qh-、inv(9)。核型描述参照《人类细胞遗传学国际命名体制2009》。
1.3AZF微缺失检测试剂购自北京爱普益生物科技有限公司。以AZF的8个序列标志位点(sequence tagged sites,STS)为靶序列。STS位点包括AZFa sY84、sY86,AZFb sY127、sY134,AZFc sY254、sY255,AZFd sY145、sY152。取EDTA抗凝全血200 μL置于灭菌管中,提取DNA后备检。PCR反应体系为25 μL,包括Mix 22 μL、反应酶1 μL、DNA模板2 μL,振荡混匀并放入PCR扩增仪。扩增条件: 95 ℃5 min; 94 ℃20 s,57 ℃ 20 s,72 ℃ 1 min,4个循环; 94 ℃ 15 s,56 ℃ 1 min,33个循环。反应结束后分析图像。Baseline的Start值设在3~10、End值设在10~15。sY127、sY134、sY152、sY254、sY255位点无明显S型扩增曲线或Ct>24判定为缺失,sY84、sY86、sY145位点无明显S型扩增曲线或Ct>28判定为缺失。
2 结果
2.1染色体核型与AZF微缺失检测结果227例生精障碍患者中有49例(21.59%)染色体核型异常,其中Kleinefelter综合征(47,XXY)17例(7.49%),性反转(46,XX)2例(0.88%),Y染色体部分缺失[46,X,del(Y)]2例(0.88%),常染色体易位5例(2.20%);染色体多态性核型23例(10.13%)。相比于少弱精患者,无精患者染色体异常检出率最高,并以Y染色体的数目和结构异常最为突出。
AZF微缺失共检出21例(9.25%)。178例核型为46,XY的生精障碍患者中检出AZF微缺失10例(5.62%);12例核型为46,X,Yqh-的患者中检出AZF微缺失6例(50.00%);17例核型为47,XXY的患者中检出AZF微缺失1例(5.88%);2例核型为46,X,del(Y)和2例核型为46,XX的患者均存在AZF微缺失。具体见表1。

表1 染色体核型与AZF微缺失结果
2.2AZF微缺失STS结果59例少精患者中发生AZF微缺失4例(6.78%),94例弱精患者中发生AZF微缺失8例(8.51%);74例无精患者中发生AZF微缺失9例(12.16%)。缺失区域分布见表2。

表2 AZF微缺失结果
2.3 1例染色体核型异常合并AZF微缺失病例的测序验证结果患者临床表现为身高145 cm,有喉结和胡须,无精症。外周血核型结果为46,X,del(Y)(q11.23)(图1)。AZF微缺失结果为AZFa、AZFb、AZFc、AZFd均无扩增。应用测序技术对该患者的外周血进行染色体拷贝数变异检测,发现Y染色体p11.2→q11区段存在19.1 Mb缺失,del(Y)( p11.2→q11)(9649248→28800000)(图2)。

核型:46,X,del(Y)(q11.23)
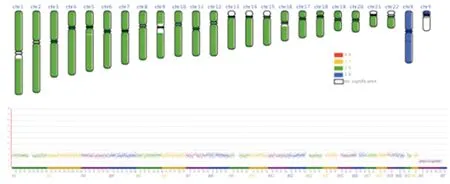
红色表示4倍重复,黄色表示3倍重复,绿色表示2倍正常,蓝色表示1倍缺失
图2染色体拷贝数变异检测图谱
3 讨论
近年来由于生活压力的增加、环境污染等原因,不孕不育夫妇逐年增多,其中男性不育显著增加。约90%的不育男性存在精子发生障碍,临床表现为少精、弱精甚至无精症。精子生成过程受激素、环境、遗传等多种因素的影响[2,4]。据统计,男性不育患者中有2.2%~33.0%存在染色体异常,约10%存在Y染色体微缺失[5-7]。
Y染色体上有负责睾丸发育和精子生成的基因,还存在大量重复序列和回文结构。由于回文结构易于丢失,内部基因的丢失导致精子生成障碍和不育。Y染色体的数目或结构异常是导致男性不育的主要原因。本研究227例生精障碍患者中性染色体异常38例,包括17例47,XXY、2例46,XX、2例46,X,del(Y)、17例Y染色体多态性核型,其中47,XXY是导致无精症最常见的核型。Y染色体缺失也是导致男性生精障碍的原因之一。本研究检出2例46,X,del(Y),对其中1例进行染色体拷贝数变异检测,发现Y染色体存在19.1 Mb缺失,其临床表现为个矮及无精症。常染色体易位也导致严重的生精障碍,可能是由于精子发生的关键基因受到破坏或者在减数分裂期间干扰染色体分离[8-9]。本研究中检出5例常染色体易位,其临床表现为少精和弱精。
有文献[10-11]报道染色体多态性与不良孕产史、精子数目和形态发育异常相关,因影响减数分裂过程而导致男性不育,染色体多态性在男性不育人群中的发生率为12.2%~38.0%,远高于正常人群中的3.96%。本研究227例生精障碍患者中共检出染色体多态性23例(10.13%),与上述文献报道接近。目前染色体多态性与男性不育的相关性存在争议,尽管有文献[12]报道Y染色体多态性与不育无相关性,但Y染色体的长度是对男性生育功能影响最显著的一种多态性,而且具有遗传效应。本研究检出Y染色体多态性17例(7.49%),临床表现为少精、弱精和无精。其中12例核型为Yqh-患者检出AZF微缺失6例(50.00%),因此对于核型为Yqh-的患者,应进一步检测AZF微缺失,必要时应进行染色体拷贝数变异检测。如果存在AZF微缺失,建议通过胚胎植入前遗传学诊断(preimplantation geneticdiagnosis,PGD)选择女性后代,以免与将同样的微缺失遗传给后代。inv(9)检出5例(2.20%),临床表现为少精、弱精和无精,与文献[10]报道的9号染色体多态性会影响精子的生成发育一致。
有研究[8,13]表明,AZF位于Y染色体长臂q11.23,该区域的缺失与男性生精障碍密切相关。AZF微缺失存在明显种族和地域的差异,目前我国不同地区报道的AZF微缺失均有差异:东北地区1 738例不育男性中AZF微缺失检出率为8.57%[14],甘肃地区373例不育男性中AZF微缺失检出率为11.3%[15]。本研究227例生精障碍患者AZF微缺失检出率为9.25%,主要见于47,XXY、46,XX、46,X,del(Y)、46,X,Yqh-的异常核型患者中;但在178例核型正常的男性生精障碍患者中AZF微缺失10例(5.62%),提示染色体核型正常的男性生精障碍患者也应进行AZF微缺失检测。
AZF包括AZFa、AZFb、AZFc、AZFd 4个区域,不同区域的缺失导致精子质量不同程度的降低,甚至无精。AZFa包含USP9Y、DBY和UTY等基因,缺失可导致生精障碍和睾丸发育异常。AZFa缺失概率较低(1%~5%),但临床症状较严重[16]。本研究检出1例AZFa缺失,临床表现为无精。AZFb包含KDM5D、KDM5D、RPS4Y2和CYORF15等基因,与精子的发生过程有关。AZFb缺失导致生精阻滞,停留在精母细胞和精子细胞阶段[16]。本研究AZFb缺失检出2例,临床表现为少精或无精。AZFc是Yq上最活跃的区域,包括DAZ、BPY2和CDY等基因,在男性不育中起重要作用[9,16]。本研究检出AZFc缺失7例,临床表现多为弱精和无精。AZFd位于AZFb和AZFc之间,与AZFc序列重叠,所以AZFd缺失临床表现类似AZFc[9]。本研究检出AZFd缺失4例,临床表现为少精和弱精。多区域同时缺失7例,临床表现为弱精和无精。
综上所述,染色体核型异常和(或)AZF微缺失可影响男性精子质量而导致不育,因此男性生精障碍患者进行染色体核型分析并联合AZF微缺失检查有助于精确诊断和指导治疗。
