小球藻EC04产胞内多糖条件优化及抗氧化活性研究
2019-12-03杨海燕李洁琼刘红全黄小燕许钟涛罗远康禤金彩龙寒
杨海燕, 李洁琼, 刘红全, 黄小燕, 许钟涛, 罗远康, 禤金彩, 龙寒
海洋生物学
小球藻EC04产胞内多糖条件优化及抗氧化活性研究
杨海燕, 李洁琼, 刘红全, 黄小燕, 许钟涛, 罗远康, 禤金彩, 龙寒
广西民族大学海洋与生物技术学院, 微生物与植物资源利用广西高校重点实验室, 广西 南宁 530008;广西民族大学海洋与生物技术学院, 广西多糖材料与改性重点实验室, 广西 南宁 530008
小球藻胞内多糖等活性物质具有多种重要生物活性和生理功能。为提高小球藻EC04胞内多糖的产率, 采用单因素实验和L9(34)正交实验优化对其培养条件进行优化。在暗光比12∶12、温度24±1℃和2000Lux光照条件下, EC04产胞内多糖的最佳条件为: MgSO4·7H2O浓度112.5mg·L–1, K2HPO4浓度60mg·L–1, NaNO3浓度1.2g·L–1, 维生素B1浓度0.5mg·L–1, 维生素B12浓度0.1μg·L–1。在此条件下, EC04产糖率为271.74mg·g–1, 细胞密度为48.027×106cells·mL–1, 与基础培养基相比分别提高了97.49%和34.91%。添加VB1、VB12等也在不同程度上影响小球藻胞内多糖产率。对所提取胞内多糖进行抗氧化活性初探, 结果表明其具有一定的自由基的清除能力, 对DPPH·(1-二苯基-2-三硝基苯肼)和·OH(羟自由基)的最大清除率分别达到了82.32%和64.27%。
小球藻; 多糖; 营养盐; 维生素; 自由基
小球藻(sp)是一类普生性单细胞绿藻, 生态类型多样, 分布广泛, 在海水、淡水中均有分布。小球藻体内含有丰富的高价值生物活性物质, 因此在医药、食品饲料添加剂、化妆品、能源等领域具有广泛的应用价值(黄燕娟等, 2013), 并有“药物藻类”的美称(曹吉祥等, 1997)。
多糖是小球藻活性提取物中重要组成部分之一, 大量研究表明小球藻多糖具有调节机体免疫活性、抗肿瘤(郝宗娣等, 2010)、减轻重金属离子对机体的毒害等作用(Mallick, 2004)。此外小球藻多糖还可以清除各种自由基以保护机体, 起到一定的抗氧化作用。
本实验以小球藻EC04为原料, 研究其产多糖的最佳培养基浓度配比及其对DPPH·、·OH等自由基的清除作用。
1 材料与方法
1.1 材料
藻种: 本实验室从南宁邕江筛选出并进行诱变的藻种EC04, 是一株淡水小球藻。
基本特征: 细胞直径在3~15μm之间, 叶绿体的电镜图呈现杯装。产出的多糖具有多种生物学活性如抗氧化、抑菌等活性。
1.2 实验方法
1.2.1 培养基及培养方法
将EC04培养于BG-11(Reynaud et al, 1986)培养基中(配方如表1), 采用500mL锥形瓶内装250mL的液体培养基, 在超净台中按照10%的接种量接种对数期藻种。人工气候箱的培养条件为光照强度2000Lux, 暗光比为12∶12, 温度为24±1℃, 每组3个平行, 每日摇动3次。培养9d的藻悬液, 6000r·min–1下离心5min, 离心后的藻泥用蒸馏水清洗2次, 加无水乙醇置于4℃冰箱过夜用于初步除脂除色素(孙惠洁, 2008), 4800r·min–1下离心15min, 收集沉淀, 60℃烘干成藻粉。

表1 BG-11培养基配方
1.2.2 培养条件优化
1.2.2.1 营养盐优化
以BG-11基础培养基为对照, 调整营养盐浓度如下。
MgSO4·7H2O浓度分别设置为37.5、75、112.5、150、187.5mg·L–1;
K2HPO4浓度分别设置为20、40、60、80、100mg·L–1;
NaNO3浓度分别设置为0.4、0.8、1.2、1.6、2.0g·L–1。
营养盐的正交实验(陈颖等, 1998)选用最佳单因素优化值以及其邻值进行四因素三水平正交试验优化(表2)。

表2 营养盐优化正交实验表
1.2.2.2 维生素优化
在最佳营养盐条件下设置VB1的浓度值分别为0.2、0.4、0.6、0.8、1.0mg·L–1; VB12的浓度值分别为: 0、0.05、0.1、0.15、0.2μg·L–1。
1.2.3 小球藻生物量测定
采用血球计数板进行统计。
1.2.4 胞内多糖的提取
称取0.1g EC04干藻粉, 按物料比1∶25加入4%的NaOH, 80W超声20min后置于80℃水浴2h, 冷却后以4800r·min–1离心10min, 取上清液, 将细胞破碎后的藻泥用去离子水清洗两次, 离心后收集上清液。向上清液中添加三倍体积无水乙醇, 4℃冰箱过夜, 冷冻离心取沉淀, 沉淀中加入3%的TCA, 充分搅匀, 至沉淀不再溶解, 4℃离心取上清液, 清洗沉淀两次收集上清液。将上清液经0.45μm过滤膜过滤, 再次用三倍体积无水乙醇沉淀, 4℃离心得沉淀, 冷冻干燥得到粗多糖粉末。
1.2.5 多糖含量的测定及葡萄糖标准曲线的绘制
多糖含量测定采用苯酚-硫酸法(Dubois et al, 1956), 单位为mg·g–1(干重)。以葡萄糖为标准品, 得到线性回归方程为=0.0068–0.0408(2=0.9978)。
1.2.6 紫外光谱分析
将多糖样品配置成0.1%浓度的水溶液, 在TU-1901双光束紫外可见分光光度计上对200~ 400nm进行波谱扫描。
1.2.7 红外光谱分析
取1mg干燥多糖样品, 与100mg干燥KBr粉末混合, 红外灯下于玛瑙体中均匀研磨后经压片机压成薄片, 上机测定。
1.2.8 胞内多糖的抗氧化活性初探
1.2.8.1 胞内多糖对DPPH·的清除作用
取2mL不同浓度(0.5、1、1.5、2、2.5、3mg·mL–1)的多糖样品溶液, 加入2mL现配的0.16mmol·L–1的DPPH甲醇溶液中, 振荡混匀, 避光室温下保存30min, 以甲醇溶剂(Duan et al, 2006)做空白对照, 用紫外分光光度计测量其在517nm处吸光度(A), 2mL DPPH甲醇溶液与2mL甲醇混合后在517nm处吸光度(0)以及2mL甲醇溶液与2mL样品溶液在517nm处的吸光度(A)。按下列公式计算DPPH·清除率。
DPPH·清除率%=[1–(A–A)/0]×100
另取去离子水作为阴性对照。
1.2.8.2 胞内多糖对·OH的清除作用
采用邻二氮菲法(来林康等, 2014)进行实验, 吸取7.5mmol·L–1的邻二氮菲0.15mL, 加入pH7.4的磷酸盐缓冲液(phosphate buffered saline, PBS)溶液0.4mL, 去离子水0.25mL以及0.75mmol·L–1硫酸亚铁溶液0.1mL振荡混匀。加入0.1mL不同待测样品和0.1mL 1%的双氧水(现配)的反应管吸光度记作0; 二者均不加记作1; 只加入0.1mL不同待测样品的反应管吸光度记作; 加入0.1mL去离子水和0.1mL 1%双氧水(现配)的反应管吸光度记作2。4组反应管均在37℃恒温箱中保温60min, 去离子水调零, 用紫外分光光度计测定其在536 nm处吸光度, 根据下列公式计算·OH清除率。
·OH清除率=[1–(–0)/(1–2)]×100
另取去离子水作为阴性对照。
1.3 数据处理
实验数据采用SPSS19.0软件包进行数据分析,<0.05为差异性显著,<0.01为差异极显著。
2 结果和分析
2.1 培养条件优化实验结果
2.1.1 营养盐单因素优化实验结果
以基础培养基作为原始对照组, 其中EC04的多糖产率和细胞密度分别为137.6mg·g–1和35.6× 106cells·mL–1。由图1可知, MgSO4·7H2O浓度逐渐加大时, 多糖产率也逐渐增大, 当浓度增大到112.5mg·L–1时, 多糖产率达到最大值; 然后随着MgSO4·7H2O浓度继续升高, EC04多糖产率反而下降。当K2HPO4浓度在20~60mg·L–1时, EC04多糖产率随之增加, 随着K2HPO4浓度的持续增加, 多糖产率迅速降低。改变NaNO3浓度时, EC04多糖产率变化十分显著。当NaNO3浓度低于1.2g·L–1时, 多糖产率呈上升趋势; 在NaNO3浓度为1.2g·L–1时达到最大; 随后NaNO3浓度继续增加, 小球藻多糖产率显著下降。此时EC04胞内多糖产率为原始对照组的1.71倍。
以细胞密度为考察主体时, 增大MgSO4·7H2O浓度, 细胞密度改变不大, 影响不显著。随着K2HPO4和NaNO3浓度的增大, 细胞密度也随之增大。当 K2HPO4和 NaNO3浓度分别为100mg·L–1和2.0g·L–1时, 细胞密度最大。
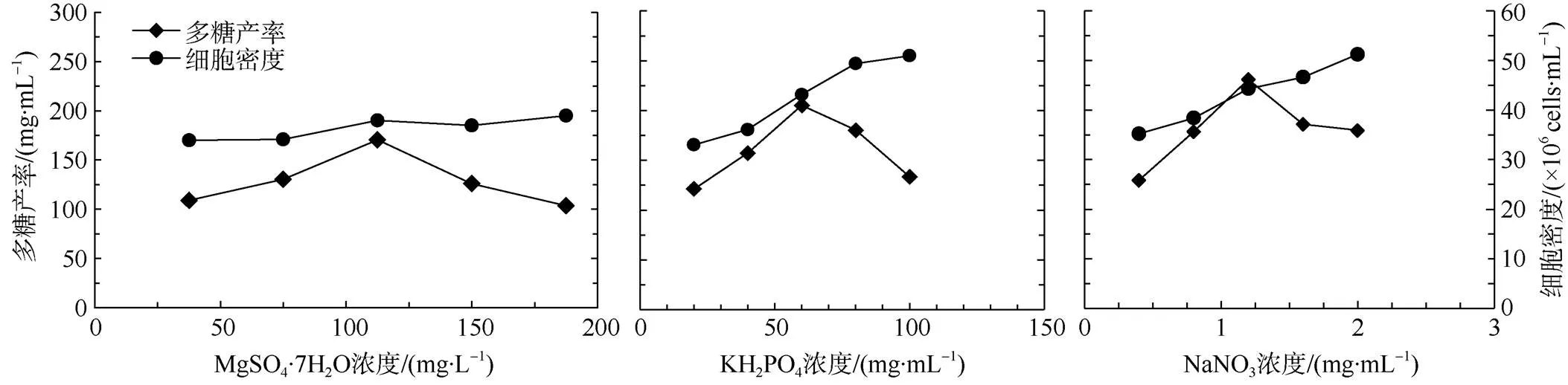
图1 营养盐单因素实验结果
2.1.2 营养盐正交优化实验结果
营养盐单因素优化结果显示单独增加适量的MgSO4·7H2O、K2HPO4都能提高EC04胞内多糖的产率, 相比原始对照组, 产率分别增加了23.82%、48.98%。NaNO3的降低使EC04胞内多糖的产率增多, 当其浓度降为1.2g·L–1时, EC04的胞内多糖产率到达最大, 比原始对照组增加了75.07%。正交实验表(表3)显示影响EC04胞内多糖产率的最主要因素是NaNO3, 其次是MgSO4·7H2O和K2HPO4。表4显示三种营养盐对EC04的胞内多糖产率影响均显著(<0.05), 其中NaNO3影响极显著(<0.01)。EC04胞内多糖产率最高实验组的组合应为MgSO4·7H2O浓度为112.5mg·L–1, K2HPO4浓度为60mg·L–1, NaNO3浓度为1.2g·L–1。经检验, 在此条件下EC04的多糖产率为238.03mg·g–1, 与原始对照组相比提高了81.71%。此时小球藻EC04的细胞密度为47.98×106cells·mL–1。
正交实验中, 小球藻细胞密度也有显著提高, 由极差看出影响小球藻细胞密度的最主要因素是K2HPO4, 其次为NaNO3和MgSO4·7H2O。表5显示NaNO3和 K2HPO4对小球藻细胞密度影响显著(<0.05), 其中K2HPO4的影响极显著(<0.01)。MgSO4·7H20对小球藻EC04细胞密度的影响不显著(>0.05)。

表3 营养盐对多糖产率和生物量的正交实验结果及直观分析

表4 营养盐对EC04的胞内多糖产率的方差分析

表5 营养盐对EC04藻细胞密度的方差分析
2.1.3 维生素单因素优化结果
以营养盐优化后的培养基作为二次对照组, 向培养基中添加VB1和VB12。由图2可知随着VB1、VB12浓度的升高, EC04胞内多糖产率均为先上升而后下降的趋势。达到最高值时VB1和VB12的浓度分别为0.5mg·L–1和0.1μg·L–1, 多糖产率分别为250.93和271.74mg·g–1。EC04细胞密度随VB1和VB12的浓度的改变影响不显著(>0.05)。加入的VB1浓度为0.5mg·L–1, VB12浓度为0.1μg·L–1后, 细胞密度为48.027×106cells·mL–1。

图2 维生素单因素优化结果
2.2 胞内多糖紫外光谱扫描结果
提取胞内多糖进行紫外光谱扫描(图3), 结果显示在260nm和280nm处均无吸收峰, 表明多糖样品中无核酸及蛋白质。
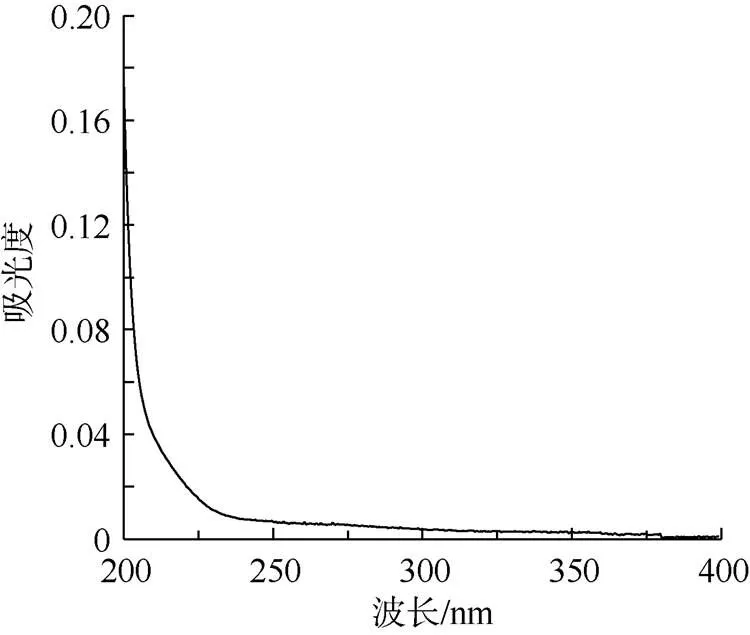
图3 胞内多糖紫外扫描结果
2.3 胞内多糖红外光谱分析结果
多糖红外光谱结果(图4)表明, 多糖在3731.81cm–1和3453.93cm–1处有吸收峰, 此为—OH伸缩振动引起的吸收; 2992.59cm–1处吸收峰为糖类饱和C—H振动吸收; 1693.99cm–1处吸收峰为糖醛酸吸收峰, 说明多糖中具有糖醛酸基团。1454.37cm–1处吸收峰为=CH2的变形吸收峰。1250~950cm–1之间的吸收峰是吡喃糖环的醚键(C—O—C)和羟基的吸收峰。863.95cm–1是吡喃糖环上次甲基的横摇振动, 证明此多糖为吡喃糖。说明小球藻多糖含有带糖醛酸基团的吡喃糖。
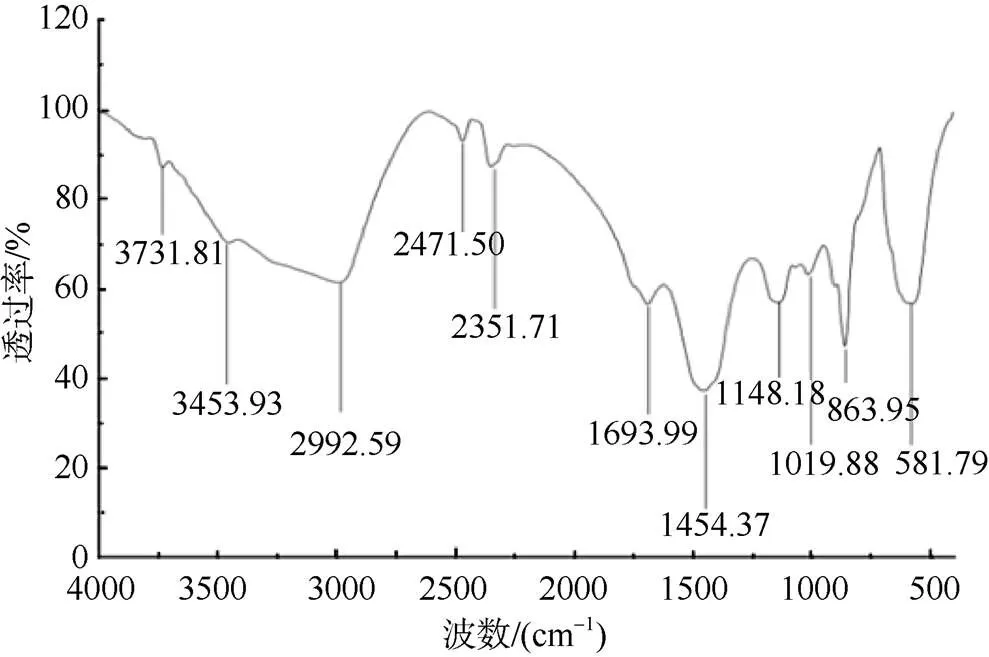
图4 多糖红外光谱分析结果
2.4 胞内多糖的抗氧化活性结果
2.4.1 胞内多糖对DPPH·的清除能力
当有自由基清除剂存在时, DPPH·的单电子会与之配对从而吸收逐渐消失, 且褪色程度取决于抗氧化剂的供氢能力(Shon et al, 2003)。由图5可知, 在0.5~3mg·mL–1内, 多糖对DPPH·清除能力随着浓度的增加而增强, 其IC50为1.445mg·mL–1。当样品浓度为3mg·mL–1时, 对DPPH·的清除率可以达到82.32%。
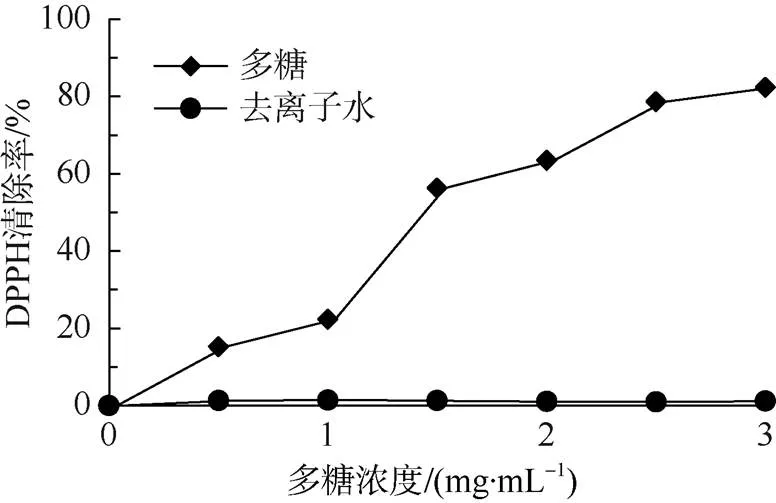
图5 胞内多糖对DPPH·的清除率
2.4.2 胞内多糖对·OH的清除能力
·OH的化学性质特别活泼, 也是毒性最大的自由基, 几乎能与细胞内各类有机物反应(葛霞等, 2011)。实验结果(图6)表明随着多糖浓度的升高, 在浓度达到3mg·mL–1时, ·OH清除率达到64.27%。其IC50为2.152mg·mL–1。

图6 多糖对·OH的清除率
3 讨论
小球藻主要在光合自养条件下培养, 一定条件下所获得的细胞浓度较低, 主要是因为小球藻处于静置培养状态, 随着藻细胞的积累而沉降在培养瓶底部, 为防止此现象发生, 应尽可能多次摇动锥形瓶以提高生物量。国内外研究中小球藻主要培养方式有光合自养、异养和混养方式, 且根据实际需求采用不同规模的培养方式。已有公司实行大批量培养, 如采用生物反应器, 但此方法限于实验室各种条件稳定的情况下, 适合大批量生产。本实验采用光合自养条件下培养, 是为了探究这株藻的产糖量、条件以及活性的研究, 适合实验室科研, 对人力物力都能达到较大的利用化。本实验方法主要是通过调整盐浓度的方法来提高小球藻生物量及其产多糖含量。
营养盐浓度是微藻细胞合成代谢产物的主要限制因素(Sun et al, 2010)。在一定程度上改变N源和P源均影响小球藻EC04细胞内总糖的合成, 浓度过大则会抑制胞内多糖的产生, 这与谭绩业等(2004)的研究结果一致。
SO42–浓度的提高能促进多糖的合成, Mg2+参与叶绿素和菌绿素等光合色素, 同时也是一些酶作用的激活剂或调节剂, 对某些重金属产生的生物细胞毒害还具有一定的拮抗作用(史成颖, 2003)。因此, 适量提高MgSO4·7H2O浓度有利于微藻光合作用以及碳水化合物的积累, 但是浓度过大反而会有抑制效果。
P是遗传物质核酸和生物膜的重要组成部分, 在核酸、蛋白及磷脂等代谢中有重要作用, 微藻进行光合作用的暗反应时需利用ATP和NADPH的化学能将CO2固定并还原成糖或者其他有机物, ATP和NADPH的形成也需要大量P。因此适量的提高P源有利于微藻光合作用暗反应的进行和多糖的积累。
N是蛋白质等大分子物质的重要组成部分, 而蛋白质是生命活动的执行者。N限制时会引起蛋白质含量丰富的色素体的生成减少, 从而影响光合效率。伴随着N胁迫, 微藻内多糖等碳水化合物会快速降解为脂肪酸合成提供代谢物, N浓度过高也会对多糖的合成起抑制作用。本实验结果表明适量降低NaNO3浓度EC04胞内多糖产率增高, 此后随着NaNO3浓度的继续降低, EC04胞内多糖显著降低。
维生素作为生长因子维持微藻的基本生长需求, 在本实验中VB1、VB12也在不同程度上影响小球藻EC04胞内多糖含量, 与张欣华等(2000)研究结果一致。VB1、VB12对小球藻多糖产率有影响的机理可能是它们作为各类辅酶的组成成分, 参与到微藻的代谢中。
微藻多糖具有良好的成膜性能, 可以作为良好的抗氧化剂(王凌等, 2012), 多糖的抗氧化活性一般与其所带硫酸根含量有关。李亚清(2004)报道小球藻多糖含有硫酸根, 而本实验显示小球藻多糖中无硫酸根可能是因为培养基成分不同导致多糖的组成成分及所带基团不同。抗氧化实验表明小球藻胞内多糖仍具有清除DPPH·和·OH的能力, 且效果略低于VC。我们推断, 自由基清除能力也许跟多糖所含糖醛酸含量有关, 且糖醛酸含量越高, 抗自由基能力越强。这与申明月等(2007), 赵雪等(2011)等实验结果一致, 其作用机制可能是由于自由基引起糖醛酸链断裂, 从而达到清除自由基的效果。
曹吉祥, 李德尚, 王金秋, 1997. 10种淡水常见浮游藻类营养组成的研究[J]. 中山大学学报(自然科学版), 36(2): 22–27. CAO JIXIANG, LI DESHANG, WANG JINQIU, 1997. Studies on biochemical composition of 10 species of common freshwater phytoplankton[J]. Acta Scientiarum Naturalium Universitatis Sunyatseni, 36(2): 22–27 (in Chinese with English abstract).
陈颖, 李文彬, 孙勇如, 1998. 小球藻生物技术研究应用现状及展望[J]. 生物工程进展, 18(6): 12–16. CHEN YING, LI WENBING, SUN YONGRU, 1998. Status and prospects of researches and applications ofspp. biotechnology[J]. Progress in Biotechnology, 18(6): 12–16 (in Chinese with English abstract).
葛霞, 陈婷婷, 蔡教英, 等, 2011. 青钱柳多糖抗氧化活性的研究[J]. 中国食品学报, 11(5): 59–64. GE XIA, CHEN TINGTING, CAI JIAOYING, et al, 2011. Studies on the anti-oxidant activity of polysaccharide from(Batal.)[J]. Journal of Chinese Institute of Food Science and Technology, 11(5): 59–64 (in Chinese with English abstract).
郝宗娣, 刘洋洋, 续晓光, 等, 2010. 小球藻()活性成分的研究进展[J]. 食品工业科技, 31(12): 369–372. HAO ZONGDI, LIU YANGYANG, XU XIAOGUANG, et al, 2010. Research progress in active components of[J]. Science and Technology of Food Industry, 31(12): 369–372 (in Chinese with English abstract).
黄燕娟, 王小芬, 陈向凡, 2013. 小球藻的营养及药用价值[J]. 现代生物医学进展, 13(32): 6396–6398. HUANG YANJUAN, WANG XIAOFEN, CHEN XIANGFAN, 2013. Analysis of the nutritional value and pharmacological action of[J]. Progress in Modern Biomedicine, 13(32): 6396–6398 (in Chinese with English abstract).
来林康, 邓尚贵, 2014. 鱼腥草多糖提取工艺及抗氧化活性研究[J]. 安徽农业科学, 42(35): 12646–12649. LAI LINKANG, DENG SHANGGUI, 2014. Study on extraction of polysaccharides fromand antioxidant activity[J]. Journal of Anhui Agricultural Sciences, 42(35): 12646–12649 (in Chinese with English abstract).
李亚清, 2004. 海洋微藻多糖的提取分离纯化和结构特征研究[D]. 大连: 大连理工大学.
申明月, 聂少平, 谢明勇, 等, 2007. 茶叶多糖的糖醛酸含量测定及抗氧化活性研究[J]. 天然产物研究与开发, 19(5): 830–833. SHEN MINGYUE, NIE SHAOPING, XIE MINGYONG, et al, 2007. Studies on the content of uronic acid in tea polysaccharide and its antioxidative activity[J]. Natural Product Research and Development, 19(5): 830–833 (in Chinese with English abstract).
史成颖, 2003. 影响钝顶螺旋藻生长的理化因子的研究[D]. 合肥: 安徽农业大学.
孙惠洁, 2008. 红毛藻多糖的提取纯化及其性质的研究[D]. 厦门: 集美大学. SUN HUIJIE, 2008. Extraction, purification and characterization of Polysaccharides from[D]. Xiamen: Jimei University (in Chinese with English abstract).
谭绩业, 赵连华, 2004. 营养盐对小球藻生长及胞内多糖含量的影响[J]. 化学与生物工程, 21(1): 34–36, 44. TAN JIYE, ZHAO LIANHUA. 2004. Effects of nutritions on the.growth and on the content of saccharide[J]. Chemistry & Bioengineering, 21(1): 34–36, 44 (in Chinese with English abstract).
王凌, 孙利芹, 赵小惠, 2012. 一种微藻多糖的理化性质及抗氧化和保湿活性[J]. 精细化工, 29(1): 20–24. WANG LING, SUN LIQIN, ZHAO XIAOHUI, 2012. Physicochemical property analysis of polysaccharides from marine microalgae and their antioxidation, hygroscopicity and moisture retention activities[J]. Fine Chemicals, 29(1): 20–24 (in Chinese with English abstract).
张欣华, 杨海波, 于媛, 等, 2000. 不同培养条件对海洋微藻多糖含量的影响[J]. 生物学杂志, 17(6): 17–18. ZHANG XINHUA, YANG HAIBO, YU YUAN, et al, 2000. Effects of different culture conditions on the polysaccharide content of marine microalga[J]. Journal of Biology, 17(6): 17–18 (in Chinese with English abstract).
赵雪, 董诗竹, 孙丽萍, 等, 2011. 海带多糖清除氧自由基的活性及机理[J]. 水产学报, 35(4): 531–538. ZHAO XUE, DONG SHIZHU, SUN LIPING, et al, 2011. The scavenging activities and mechanism on oxygen free radicals of polysaccharides from[J]. Journal of Fisheries of China, 35(4): 531–538 (in Chinese with English abstract).
DUAN XIAOJUAN, ZHANG WEIWEI, LI XIAOMING, et al, 2006. Evaluation of antioxidant property of extract and fractions obtained from a red alga,[J]. Food Chemistry, 95(1): 37–43.
DUBOIS M, GILLES K A, HAMILTON J K, et al, 1956. Colorimetric method for determination of sugars and related substances[J]. Analytical Chemistry, 28(3): 350–356.
MALLICK N, 2004. Copper-induced oxidative stress in the chlorophycean microalga: response of the antioxidant system[J]. Journal of Plant Physiology, 161(5): 591–597.
REYNAUD P A, FRANCHE C, 1986. Isolation and characterization of nonheterocystous tropical cyanobacteria growing on nitrogen-free medium[J]. MIRCEN Journal of Applied Microbiology and Biotechnology, 2(4): 427–443.
SHON M Y, KIM T H, SUNG N J, 2003. Antioxidants and free radical scavenging activity of() extracts[J]. Food Chemistry, 82(4): 593–597.
SUN LIQIN, WANG CHANGHAI, MA CUIHUA, et al, 2010. Optimization of renewal regime for improvement of polysaccharides production fromby uniform design[J]. Bioprocess and Biosystems Engineering, 33(3): 309–315.
Study on the optimum conditions for Polysaccharide production ofEC04 and its antioxidant activity analysis
YANG Haiyan, LI Jieqiong, LIU Hongquan, HUANG Xiaoyan, XU Zhongtao, LUO Yuankang, XUAN Jincai, LONG Han
Guangxi Colleges and Universities Key Laboratory of Utilization of Microbial and Botanical Resources, School of Marine Sciences and Biotechnology, Guangxi University for Nationalities, Nanning 530008, China; Guangxi Key Laboratory for Polysaccharide Materials and Modifications, School of Marine Sciences and Biotechnology, Guangxi University for Nationalities, Nanning 530008, China
Polysaccharides inare involved in many important biological activities and physiological functions. To improve the intracellular polysaccharide production of, culture conditions were investigated by single factor experiment and orthogonal experiment. The results showed that the maximum polysaccharide accumulation was obtained at MgSO4·7H2O 112.5 mg·L–1, K2HPO460 mg·L–1, NaNO31.2 g·L–1, VB10.5 mg·L–1, and VB120.1 μg·L–1. Under these conditions, the polysaccharide production and biomass were 271.74 mg·g–1and 48.027×106cells·mL–1, which increased by 97.49% and 34.91%, respectively. Free radical scavenging rate of the polysaccharide was also studied. The results showed maximum scavenging rates of DPPH radical and hydroxyl radical were 82.32% and 64.27%, respectively.
sp; polysaccharide; nutrient; vitamin; radical
10.11978/2019016
http://www.jto.ac.cn
Q946
A
1009-5470(2019)06-0098-07
2019-02-17;
2019-04-24。
林强编辑
广西自然科学基金项目(2018GXNSFAA294032); 广西民族大学研究生教育创新计划项目(Gxun-chxzs 2017117); 广西民族大学大学生创新创业项目(Gxun-chxzs 2017106080); 广西科技基地和人才专项(桂科AD18126005)
杨海燕(1994—), 女, 江西省上饶市人, 硕士研究生, 主要从事微生物生物活性物质研究, E-mail: 1239289766@qq.com
刘红全(1975—), 男, 副教授, 博士, 主要从事植物分子生物学研究。E-mail: lhongquan@163.com.
2019-02-17;
2019-04-24.
Editor: LIN Qiang
Project of Guangxi Natural Science Foundation (2018GXNSFAA294032); Graduate Education Innovation Project of Guangxi University for Nationalities (Gxun-chxzs 2017117); Innovation and Entrepreneurship Project of Guangxi University for Nationalities (Gxun-chxzs 2017106080); Guangxi Science and Technology Base and Talent Project (Guike AD18126005).
LIU Hongquan, E-mail: lhongquan@163.com
