南海北部滨珊瑚骨骼微生物侵蚀*
2019-12-03赵宽张婷陈天然
赵宽, 张婷, 陈天然
海洋生物学
南海北部滨珊瑚骨骼微生物侵蚀*
赵宽1, 2, 张婷1, 2, 陈天然1
1. 中国科学院边缘海与大洋地质重点实验室(南海海洋研究所), 广东 广州 510301;2. 中国科学院大学, 北京 100049
微生物对珊瑚骨骼的侵蚀作用相对肉眼可见的大型生物侵蚀更加隐蔽, 研究也相对稀少, 国内更是空白。本文对采自涠洲岛、大亚湾以及西沙琛航岛的滨珊瑚骨骼切片在扫描电镜下开展微生物侵蚀研究。在涠洲岛和大亚湾的滨珊瑚骨骼切片中存在微生物侵蚀形成的“橘色条带”, 可能与当地水体富营养化有关, 而琛航岛的样品中则没有类似的条带。扫描电镜观察发现, 这些“橘色条带”为内生藻, 是一种热带珊瑚礁区常见的侵蚀微生物。侵蚀的珊瑚骨骼结构被破坏, 其厚度减小, 孔隙率提高了1.54%至6.76%、抗压强度下降了27.1%至51.2%, 使得珊瑚骨骼变得更加“疏松”, 且在整个骨骼次表面形成了一层“骨质疏松层”。该种侵蚀微生物扮演了“先行者”的角色, 使珊瑚更容易被大型生物侵蚀, 而大型生物侵蚀又会进一步促进微生物侵蚀, 该“正反馈效应”正好解释了在富营养化的南海北部发现的珊瑚骨骼内侵蚀加剧的现象。
生物侵蚀; 微生物; 珊瑚礁; 南海北部; 扫描电镜
海水富营养化(Chen et al, 2013)以及珊瑚白化死亡(Holmes et al, 2000)均会进一步加剧珊瑚骨骼内的生物侵蚀。生物侵蚀是侵蚀生物(bio-erosion organisms)对珊瑚碳酸钙骨骼进行机械钻孔、化学腐蚀的过程, 并且会进一步削弱、破坏珊瑚礁的堆积, 以及影响珊瑚礁结构和生态系统的稳定性(Glynn et al, 2015)。按照个体大小, 侵蚀生物可分为大型(macro-bioeroders), 如海绵、贝类、蠕虫等(Chen et al, 2013); 以及微型(micro-bioeroders), 主要是一些藻类、细菌和真菌(Kiene et al, 1994; Risk et al, 1995; Grand et al, 2011; 陈天然等, 2013)。
大型侵蚀生物多为滤食性, 因此富营养化的水体会刺激它们的增长, 导致侵蚀生物的爆发(Risk et al, 1995; Holmes, 2000; Chen et al, 2013), 进一步导致珊瑚骨骼内侵蚀强度的增加。被侵蚀严重的珊瑚骨骼布满大小不一的空腔(钻孔), 使原本致密、结实的珊瑚骨骼变得十分脆弱(Scott et al, 1988; Chen et al, 2013)。南海北部是全球受人类活动影响最密集的区域之一(Halpern et al, 2008)。例如在广西涠洲岛海域, 珊瑚骨骼内发现的大型侵蚀生物是双壳类占主导, 特别是靠近人类活动密集、污染物排放集中、富营养化程度高的海域, 其生物侵蚀强度明显高于远离污染源、水质相对较好的海域(陈天然等, 2013)。侵蚀的加剧使得珊瑚骨骼内布满空洞, 严重削弱珊瑚骨骼强度, 降低抗击外部物理冲击的能力(金昱盺等, 2017)。类似的, 广东大亚湾珊瑚骨骼中的侵蚀生物以双壳类和海绵为主(≥80%), 并且珊瑚更容易在风暴、巨浪等强烈的外力作用下从基底上被剥落下来, 这可能是抑制相对高纬度珊瑚群落进一步形成珊瑚礁的重要因素(Chen et al, 2013)。
相对于大型生物侵蚀, 微生物侵蚀更加隐蔽。其中, 内生藻类(endolithic algae), 也称钻孔藻类(boring algae), 是珊瑚骨骼内最常见的一种侵蚀微生物。内生藻类涉及蓝藻、红藻和绿藻, 其中绿藻是迄今为止在珊瑚骨骼内发现的最丰富的内生藻类(Gutner-Hoch et al, 2011; Verbruggen et al, 2011)。内生藻类虽然微小, 但对珊瑚礁生态系统的影响不可忽视: 一方面, 内生藻类可以分泌化学物质溶解珊瑚CaCO3骨骼, 使礁体在海水中更容易被进一步化学溶解, 特别是在海洋酸化日益加剧的背景下(Verbruggen et al, 2011); 另一方面, 有些内生藻类并非寄居在珊瑚骨骼中, 而是与珊瑚组织共生, 通过转移氮和碳元素的化合物, 将光合同化物部分供给珊瑚组织(Fine et al, 2002; Titlyanov et al, 2008)。在发生珊瑚白化、珊瑚虫损失大量共生虫黄藻时, 内生藻类可以暂时替代虫黄藻为宿主提供养料, 延长珊瑚的存活时间, 降低白化珊瑚的死亡率(Fine et al, 2002)。然而, 相对于大型侵蚀生物, 国际上对微生物侵蚀的研究十分稀少, 特别对于受人类活动影响密集的近岸珊瑚礁, 且大部分研究方法都为计算碳酸钙的变化速率(Mallela, 2018)。在人类活动和气候变化的影响日益加剧的背景下, 珊瑚骨骼内的微生物侵蚀是如何响应以及如何变化的, 至今还不明确。对于国内, 南海北部的岸礁是全球范围内受气候和人类活动影响最显著的珊瑚礁区域之一(Hughes et al, 2012), 但还没有开展有关珊瑚微生物侵蚀的研究。本文通过扫描电镜微观显示的方法, 观察采自南海北部(涠洲岛和大亚湾)珊瑚样品的微生物侵蚀, 并进一步探讨微生物侵蚀加剧对珊瑚生长的影响。
1 材料与方法
1.1 研究地点
本文所用的滨珊瑚骨骼样品采自南海北部, 分别位于广西涠洲岛、广东大亚湾以及西沙永乐环礁的琛航岛(图1)。对于涠洲岛和大亚湾的样品, 其大型生物侵蚀的研究数据已经发表(Chen et al, 2013; 陈天然等, 2013), 本文选择部分样品(每个地点选用3个样品)开展针对微生物侵蚀的微观研究。
涠洲岛(图1)位于北部湾内, 面积约为25km2。20世纪90年代开始出现大片石珊瑚死亡, 并且珊瑚礁群落及其生物多样性整体呈衰退态势, 气候变化加上当地破坏性的人类活动是导致退化的主要因素(黄晖等, 2009; 梁文等, 2010; 陈刚等, 2016)。本文另一个采样地点为广东省大亚湾, 是一个半封闭型海湾(图1), 面积约600km2, 湾内岛屿众多, 石珊瑚群落分布在一些岛屿以及少数沿岸, 水深小于5m的基石上, 未发育成礁, 且从20世纪80年代开始也呈现出显著退化的趋势, 人为破坏可能是主要因素(陈天然等, 2009)。西沙永乐环礁(图1)位于南海中北部, 相对于大陆沿岸, 这里的珊瑚礁受陆源污染的影响较少, 但高温事件加上不合理的捕鱼活动等导致这里的珊瑚礁也多次出现大面积珊瑚死亡事件(Zhao et al, 2016; Shi et al, 2012)。
图1 珊瑚样品采集位置示意图
1.2 微生物侵蚀
将采集的滨珊瑚骨骼样品沿生长轴纵向切片, 切片厚度约为8mm。用10%的H2O2溶液浸泡珊瑚骨骼切片, 24h后用清水在超声波清洗器中清洗切片, 共3遍, 每次10min, 用于去除样品表面的粉末杂质, 最后在烘箱中60℃烘干24h。选择骨骼切片上出现明显橘色条带的部分以及正常部分作为对比, 用微型电钻取下约为3mm×3mm×1mm大小的块体, 然后再次用超声波清洗、烘干。经过表面镀金处理后, 在扫描电镜(日立S-3400N)下观察上述珊瑚骨骼小块体, 并进行微观拍照。
利用图像处理软件对“橘色条带”处的显微照片进行孔隙率的计算, 并根据孔隙率与纵波波速和抗压强度的关系(杨永康等, 2016)推算出微生物侵蚀对珊瑚骨骼强度的影响。其中孔隙率的计算公式为:=(1+2)/3, 其中1为孔洞(SEM图像中阈值色阶大于104)的面积总和,2为微生物侵蚀部分的面积总和,3为图像总面积, 同一样品未被微生物侵蚀的部分2=0。孔隙率、纵波波速、单轴抗压强度的回归方程为:=4.329×10–62–0.039+ 98.012;=7.138×10–2×e0.001V, 其中代表干燥条件下的波速。根据以上方程, 可以通过计算孔隙率推导出微生物侵蚀对比正常部分的珊瑚骨骼抗压强度的变化。利用该物理指标, 定量评估微生物侵蚀对珊瑚骨骼结构的影响。
2 结果
如图2所示, 在涠洲岛与大亚湾滨珊瑚骨骼样品的横切面上, 观察到了明显的“橘色条带”, 而在西沙的样品中则没有出现。这些“橘色条带”均出现在骨骼顶端, 距离表面约1至5cm, 其分布与珊瑚骨骼的年生长层基本一致。根据前人研究结果(Forsterra et al, 2008; Chazottes et al, 2009; Schlichter et al, 1997), 这些“橘色条带”是一种最常见的内生藻类,, 在全球的热带珊瑚礁区均有发现, 可以寄居在超过85%的珊瑚属种中, 并形成多种颜色的条带。

图2 珊瑚切片以及“橘色条带”(微生物侵蚀)在扫描电镜下的特征
a、b、c为涠洲岛采集样品及扫描电镜图像; d、e为大亚湾采集样品及扫描电镜图像; f、g为琛航岛采集样品及扫描电镜图像
Fig. 2 “Orange Bands” (micro-bioerosion) on coral slices and skeletal micro-structures revealed by scanning electron microscopy. a, b and c are samples and SEM images of Weizhou Island; d, e and f are samples and SEM images of Daya Bay; f and g are samples and SEM images of Chenhang Island
对“橘色条带”处进行扫描电镜显微观察(图2), 发现该处骨骼有明显被侵蚀的痕迹。被侵蚀的骨骼结构被破坏且壁出现不同程度的减薄。有些被侵蚀的位置还可以观察到部分薄片状的残留的侵蚀物, 其表面凹凸不平, 厚度小于30μm。相对的, 琛航岛采集的珊瑚样品在扫描电镜下没有观察到被侵蚀的痕迹, 其骨骼微结构完整(图2分别展示了各点具有代表性的一个样品)。
为了评估微生物侵蚀对珊瑚骨骼强度的影响, 选取了“橘色条带”明显且完整的样品的SEM图像以及未被侵蚀的骨骼样品进行孔隙率的对比。结果表明, 微生物侵蚀对滨珊瑚骨骼孔隙率变化的影响有限, 孔隙率增加最大值为6.76%, 最低仅为1.54%。然而, 仅仅是孔隙率较小的增加, 导致骨骼抗压强度的变化却十分显著, 减低27.1%至51.2% (表1)。对比各地的珊瑚样品, 发现被微生物侵蚀后, 骨骼抗压强度下降幅度最大的出现在涠洲岛, 最小的出现在大亚湾, 但是整体来说涠洲岛样品的骨骼抗压强度下降幅度并没有明显高于大亚湾, 而琛航岛珊瑚样品的骨骼抗压强度均显著高于涠洲岛与大亚湾(ANOVA,=25.38,<0.01)。
表1 被微生物侵蚀的珊瑚骨骼以及对照样品的物理参数变化

Tab. 1 Differences in physical parameters between eroded and control coral skeletal samples
注: W为涠洲岛样品, D为大亚湾样品, C为琛航岛样品
3 讨论
研究表明, 大型生物侵蚀与水体富营养化程度有关(Grand et al, 2011; Hutchings et al, 2002; Chen et al, 2013)。类似大型侵蚀生物, 微生物侵蚀可能也与水体富营养化密切相关, 在印度洋留尼汪岛、加勒比海以及夏威夷等地均有相关研究发现在水体富营养化的情况下微生物侵蚀会大大增强(Zubia et al, 2001; Carreiro-Silva et al, 2005; Tribollet et al,2009)。本文采样的三个地点海水富营养化程度也存在差异, 大亚湾和涠洲岛海域的富营养化指数远高于西沙海域(聂永康等, 2016; 梁鑫等, 2018; 张颖等, 2018)。结合本文发现的证据, 可以得到与全球其他地点一致的规律, 即近岸海域、海水污染程度高的大亚湾和涠洲岛采集的样品中, 微生物侵蚀较为普遍, 且大多数微生物侵蚀都伴随着大型生物侵蚀; 而远离大陆的西沙群岛的珊瑚样品中则没有观察到微生物侵蚀现象。水体富营养化可以视为诱发微生物侵蚀的重要原因, 但具体影响需要更多的实验进行验证。
通过计算发现, 被微生物侵蚀的珊瑚骨骼, 其孔隙率增加了1.54%至6.76%, 虽然孔隙率变化幅度较小, 但其导致珊瑚骨骼抗压强度显著下降, 达到27.1%至51.2%(图3)。而骨骼抗压强度是珊瑚骨骼结构稳定性的重要指标, 抗压强度的下降意味着珊瑚应对外力作用的能力下降, 在微生物侵蚀的作用下珊瑚骨骼抗压能力下降至少三成, 最多超过一半, 这使得珊瑚骨骼变得更加“疏松”, 更容易被其他钻孔生物(如海绵、双壳类、蠕虫等)侵蚀, 也更容易在外力作用下破碎。需要注意的是, 虽然微生物对珊瑚骨骼的侵蚀程度似乎远远低于大型生物, 但微生物侵蚀出现在接近珊瑚生长表面的地方, 即1~5cm的次表面, 且通过珊瑚切片可以看到微生物侵蚀的“橘色条带”是连续的。如果是一个完整的珊瑚群体(而不是切片), 那么微生物侵蚀痕迹的分布是呈一层“壳”状遍布骨骼次表面, 这意味着微生物侵蚀能够形成分布在珊瑚骨骼次表面(1~5cm)的“骨质疏松层”。
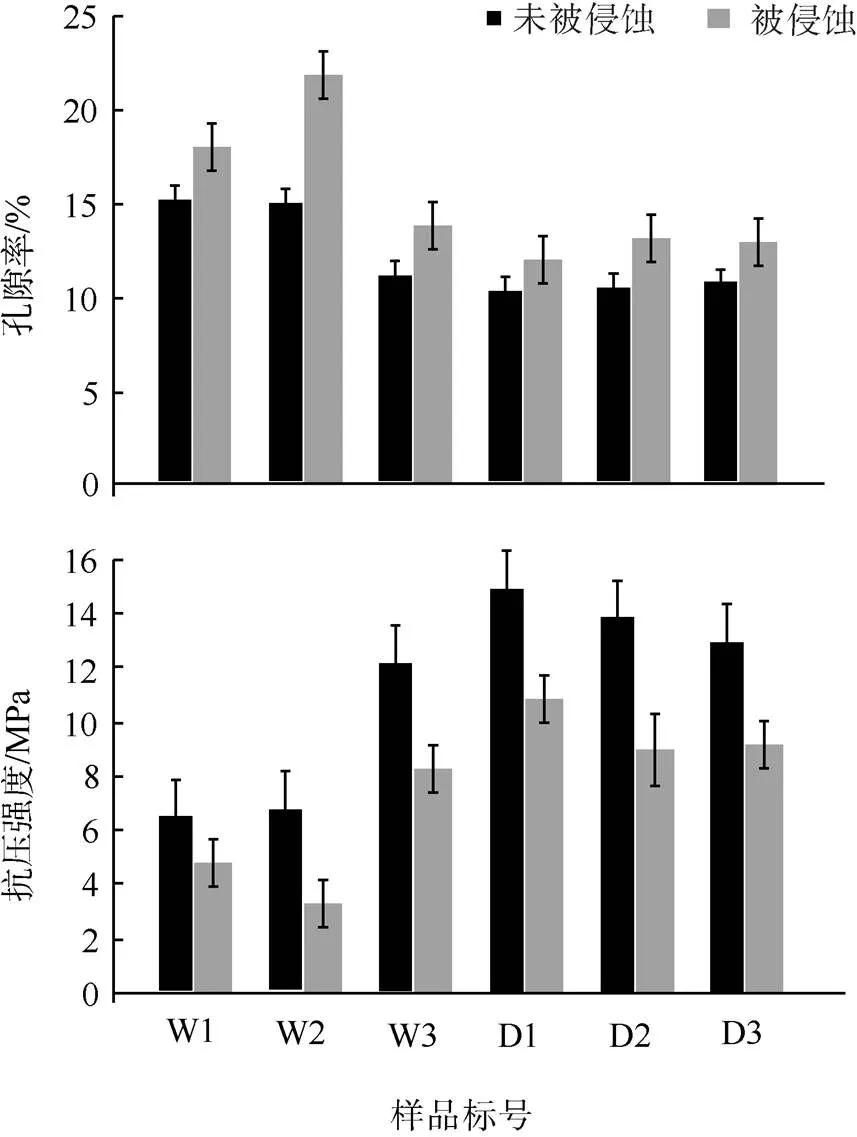
图3 珊瑚骨骼孔隙率及抗压强度对比
W为涠洲岛样品, D为大亚湾样品
Fig. 3 Differences in skeleton porosity and compressive strength between eroded and control coral skeletal samples
微生物侵蚀产生的“骨质疏松层”会使大型生物侵蚀变得更加容易。大型侵蚀生物往往在幼虫时期就开始侵入珊瑚, 而次表面的“骨质疏松层”使这些幼虫更容易深入珊瑚骨骼内部, 同时作为侵蚀微生物的内生藻类为部分大型侵蚀生物提供了食物来源(Zubia et al, 2001)。例如星虫(Sipunculans)会主动选择高孔隙率且内生藻类丰富的珊瑚, 通过“骨质疏松层”可以更方便地侵入并将藻类作为食物来源, 将珊瑚骨骼作为躲避天敌的避难所。因此, 侵蚀微生物在珊瑚骨骼内的分布、密集程度等都是影响大型生物侵蚀速率的重要因素之一(Campion- Alsumard et al, 1995)。另一方面, 随着大型侵蚀生物不断入侵珊瑚骨骼内部, 间接为骨骼内部提供了更多的光和养分, 这又为内生藻类生长以及向骨骼内部继续渗透提供了便利(Schneider et al, 1983; Chazottes et al, 1995; Zubia et al, 2001)。因此微生物侵蚀与大型生物侵蚀是“互惠互利”的关系, 微生物侵蚀便利了大型生物侵蚀, 大型生物侵蚀继续扩张加剧, 进一步又便利微生物侵蚀, 二者相互促进, 大大加快了生物侵蚀速率, 使得生物侵蚀过程一旦开始便很难停止, 最终导致珊瑚内部“千疮百孔”(Chen et al, 2013), 这是一种典型的“正反馈效应”。被侵蚀严重的珊瑚内部布满大小不一的空腔, 而分布在珊瑚底部的空腔松动了珊瑚底部与基底的粘合, 使得珊瑚更容易在风暴、巨浪等强烈的外力作用下从基底上被剥落下来, 且在翻滚、碰撞中碎裂, 造成珊瑚死亡(陈天然等, 2013), 最终导致珊瑚群落生态系统的退化。
4 结论
通过对涠洲岛和大亚湾珊瑚骨骼微生物侵蚀形成的“橘色条带”研究, 发现在整个生物侵蚀过程中, 微生物侵蚀扮演了“先行者”的角色, 使原来致密、坚硬的骨骼变得疏松、脆弱, 为大型生物侵蚀提供了便利, 间接协助了大型生物对珊瑚的侵蚀。而大型生物侵蚀又会促进微生物侵蚀, 二者互相配合加快了生物侵蚀速率, 这种“正反馈效应”对珊瑚礁的破坏作用不容忽视。只有控制污染物排放, 改变当前海水富营养化的状态, 才能有效遏制生物侵蚀作用。
陈刚, 赵美霞, 刘斌, 等, 2016. 基于 Reef Check 调查的涠洲岛珊瑚礁生态状况评价[J].热带地理, 36(1): 66–71.CHEN GANG, ZHAO MEIXIA, LIU BIN, et al, 2016.Ecological Situation of Coral Reefs in the Weizhou Island Based on Reef Check[J]. Tropical Geography, 36(1): 66–71. (in Chinese with English abstract)
陈天然, 余克服, 施祺, 等, 2009. 大亚湾石珊瑚群落近25年的变化及其对2008年极端低温事件的响应[J]. 科学通报, 54(6): 812–820. CHEN TIANRAN, YU KE FU, SHI QI, et al, 2009. Twenty.-five years of change in scleractinian coral communities of Daya Bay (northern South China Sea) and its response to8t1he2 2008 AD extreme cold climate event[J]. Chinese Sci Bull, 2009, 54(6): 812–820. (in Chinese with English abstract)
陈天然, 郑兆勇, 莫少华, 等, 2013. 涠洲岛滨珊瑚中的生物侵蚀及其环境指示意义[J]. 科学通报, 58: 1574–1582. CHEN TIAN RAN, ZHENG ZHAO YONG, MO SHAO HUA, et al, 2013. Bioerosion in Porites corals at Weizhou Island and its environmental significance (in Chinese)[J]. Chin Sci Bull(Chin Ver), 58: 1574–1582. (in Chinese with English abstract)
黄晖, 马斌儒, 练健生, 等, 2009. 广西涠洲岛海域珊瑚礁现状及其保护策略研究[J]. 热带地理, 29(4): 307–312. HUANG HUI, MA BINRU, LIAN JIANSHENG, et al, 2009. Status and Conservation Strategies of the Coral Reef in Weizhou Island, Guangxi[J]. Tropical Geography, 29(4): 307–312. (in Chinese with English abstract)
金昱昕, 陈天然, 孟庆山, 等, 2017. 单轴抗压强度揭示南海珊瑚骨骼结构的差异[J]. 热带海洋学报, 36(2): 33–39. JIN YUXIN , CHEN TIANRAN, MENG QINGSHAN, et al,2017. The difference of coral skeletal structure revealed by compressive strength measurements[J]. Journal of Tropical Oceanography, 36(2): 33–39. (in Chinese with English abstract)
梁文, 黎广钊, 张春华, 等, 2010. 20年来涠洲岛珊瑚礁物种多样性演变特征研究[J]. 海洋科学, 34(12): 78. LIANG WEN, LI GUANG-ZHAO, ZHANG CHUN-HUA, et al, 2010. Long-term changes of the coral reef biodiversity at the Weizhou Island, Beihai, Guangxi[J]. Marine Sciences, 34(12): 78. (in Chinese with English abstract)
梁鑫, 彭在清, 2018. 广西涠洲岛珊瑚礁海域水质环境变化研究与评价[J]. 海洋开发与管理, 1: 114–119. LIANG XIN, PENG ZAIQING, 2018. Analysis and appraisal of seawater quality in coral reef water, Weizhou Island, Guangxi[J]. Ocean Development and Management, 1: 114–119. (in Chinese with English abstract)
聂永康, 陈丕茂, 余景, 等, 2016. 大亚湾中央列岛海域水质分析[J]. 安徽农业科学, 44(16): 57–60. NIE YONGKANG, CHEN PIMAO, YU JING, et al, 2016. Analysis of water quality in the Central Islands of Daya Bay[J]. Journal of Anhui Agri. 44(16) : 57–60. (in Chinese with English abstract)
杨永康, 丁学武, 冯春燕, 等, 2016. 西沙群岛珊瑚礁灰岩物理力学特性试验研究[J]. 广州大学学报, 15(5): 78–82. YANG YONGKANG, DING XUEWU, FENG CHUNYAN, et al, 2016. Experimental research on physics mechanics characteristics of coral reefs calcareous rock in Xisha Islands[J]. Journal of Guangzhou University, 15(5): 78–82. (in Chinese with English abstract)
张颖, 杨清松, 张燕英, 等, 2018. 造礁石珊瑚共附生固氮微生物的固氮活性[J]. 生态学杂志, 37(7): 2122–2129. ZHANG YING, YANG QINGSONG, ZHANG YANYING, et al, 2018. Nitrogen-fixation activity of the hermatypic corals associated diazotrophs[J]. Chinese Journal of Ecology, 37(7): 2122–2129. (in Chinese with English abstract)
Campion-Alsumard Le T, Golubic S, Hutchings P ,1995. Microbial endoliths in skeletons of live and dead corals:lobata (Moorea, French Polynesia) [J]. Marine Ecology Progress Series, 117: 150.
CARREIRO-SILVA M, MCCLANAHAN T R, KIENE W E, 2005. The role of inorganic nutrients and herbivory in controlling microbioerosion of carbonate substratum[J]. Coral Reefs, 24: 214–221.
Chazottes V, Campion-Alsumard Le T, Peyrot- Clausade M, 1995. Bioerosion rates on coral reefs: interactions between macroborers, microborers and grazers (Moorea, French Polynesia) [J].Palaeogeogr Palaeoclimatol Palaeoecol, 113: 189–198.
CHAZOTTES V, CABIOCH G, GOLUBIC S, et al, 2009. Bathymetric zonation of modern microborers in dead coral substrates from New Caledonia–Implications for paleodepth reconstructions in Holocene corals[J]. Palaeogeogr Palaeocl, 280:456–468.
CHEN TIANRAN, LI SHU, YU KEFU, 2013. Macrobioerosion incorals in subtropical northern South China Sea: a limiting factor for high-latitude reef framework development [J]. Coral Reefs, 32: 101–108.
FINE M, LOYA Y, 2002. Endolithic algae: an alternative source of photoassimilates during coral bleaching[J]. Proceedings of the Royal Society B-Biological Sciences, 269: 1205–1210.
FORSTERRA F, HAUSSERMANN V, 2008. Unusual symbiotic relationships between microendolithic phototrophic organisms and azooxanthellate cold-water corals from Chilean fjords[J]. Marine Ecology-Progress Series, 370: 121–125.
Glynn P W, Manzello D P, 2015. Bioerosion and coral reef growth: A dynamic balance[M]// BIRKELAND C. Coral Reefs in the Anthropocene. Dordrecht: Springer Netherlands: 69.
Grand Le HM, Fabricius KE, 2011. Relationship of internal macrobioeroder densities in living massiveto turbidity and chlorophyll on the Australian Great Barrier Reef[J]. Coral Reefs, 30:97–107.
GUTNER-HOCH E, FINE M, 2011. Genotypic diversity and distribution ofwithin scleractinian corals[J]. Coral Reefs, 30: 643–650.
HALPERN B S, WALBRIDGE S, SELKOE K A, et al, 2008. A global map of human impact on marine ecosystems[J]. Science, 319: 948–952, DOI: 10.1126/science.1149345
Holmes K E, EDINGER E N, HARIYADI, et al, 2000. Bioerosion of live massive corals and branching coral rubble on Indonesian coral reefs[J]. Marine Pollution Bulletin, 40(7): 606–617.
HUGHES T P, HUANG H., YOUNG M A L, 2012. The wicked problem of China’s disappearing coral reefs[J]. Conservation Biology, 27, 261–269
Hutchings P A, Peyrot-Clausade M, 2002. The distribution and abundance of boring species of polychaetes and sipunculans in coral substrates in French Polynesia[J]. Journal of Experimental Marine Biology and Ecology, 269: 101–121.
KIENE W E, HUTCHINGS P A, 1994. Bioerosion experiments at Lizard Island, Great Barrier Reef[J]. Coral Reefs, 13: 91–98.
MALLELA J, 2018. The influence of micro-topography and external bioerosion on coral-reef-building organisms: recruitment, community composition and carbonate production over time[J]. Coral Reefs, 37: 227–237.
RISK M J, SAMMARCO P W, EDINGER E N, 1995. Bioerosion in Acropora across the continental shelf of the Great Barrier Reef[J]. Coral Reefs, 14: 79–86.
SCHLICHTER D, KAMPMANN H, CONRADY S, 1997. Trophic potential and photoecology of endolithic algae living within coral skeletons[J]. Marine Ecology, 18: 299–317.
SCHNEIDER J, TORUNSKI H, 1983. Biokarst on limestone coasts, morphogenesis and sediment production[J]. Marine Ecology, 4: 45-63.
SCOTT P J B, RISK M J, 1988. The effect of Lithophaga (Bivalvia, Mytilidae) boreholes on the strength of the corallobata[J]. Coral Reefs, 7: 145–151.
SHI QI, LIU GUO.HUI., YAN HONG.QIANG., et al, 2012. Black disease (): A probable cause for the rapid coral mortality at the northern reef of Yongxing Island in the South China Sea[J]. AMBIO, 41: 446-455.
TITLYANOV E A, KIYASHKO S I, TITLYANOVA T V, et al, 2008. δ13C and δ15N values in reef coralslutea and P.cylindrica and in their epilithic and endolithic algae[J]. Marine Biology, 155 (4): 353–361.
TRIBOLLET A, GODINOT C, ATKINSON M, et al, 2009. Effects of elevated pCO2 on dissolution of coral carbonates by microbial euendoliths[J]. Global Biogeochemical Cycles, 23: GB3008.
VERBRUGGEN H, TRIBOLLET A, 2011. Boring algae[J]. Current Biology, 21 (21): R876–R877.
ZHAO MEIXIA, YU KEFU, SHI QI, 2016. The coral communities of Yongle atoll: Status, threats and conservation significance for coral reefs in South China Sea[J]. Marine and Freshwater Research, 67(12): 1888–1896.
Zubia M, Peyrot-Clausade M, 2001. Internal bioerosion ofin Re´union (Indian Ocean): Microborer and macroborer activities[J]. Oceanologica Acta, 24: 251–262.
Micro-bioerosion incorals in the northern South China Sea
ZHAO Kuan1, 2, ZHANG Ting1, 2, CHEN Tianran1
1. CAS Key Laboratory of Ocean and Marginal Sea Geology, South China Sea Institute of Oceanology, Guangzhou 510301, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China
The effect of microorganisms on coral skeletons is more concealed than that by macro-bioerosion, which is visible to the naked eye. The study of micro-bioerosion is rare, and there is no such research in China. In this study, micro-bioerosion research was carried out under scanning electron microscopy on the coral skeletons of thesamples collected from Weizhou Island, Daya Bay and Chenhang Island. The “Orange Bands” were formed by microorganisms in the coral skeletons of Weizhou Island and Daya Bay, while there were no similar bands in the samples of Chenhang Island. This phenomenon may be related to the eutrophication of local sea water. Scanning electron microscopy of these "Orange Bands" revealed that this was caused by an endolithic algae—, a common eroding microorganism in the tropical coral reef area. The structure ofskeleton eroded byis destroyed, the thickness is reduced, the porosity is increased from 1.54% to 6.76%, and the compressive strength is reduced from 27.1% to 51.2%. The microorganism makes the coral skeleton more "loose" and form a layer of "osteoporosis" on the entire surface of the coral. This microorganism acts as a “forerunner,” making corals more susceptible to macro-bioerosion, which in turn promote micro-bioerosion. The “positive feedback effect” explains the increased bioerosion of the coral skeleton in the eutrophic northern South China Sea.
bioerosion; microorganism; coral reef; northern South China Sea; scanning electron microscope
10.11978/2019006
http://www.jto.ac.cn
Q958.8
A
1009-5470(2019)06-0074-06
2019-01-09;
2019-02-26。
林强编辑
国家自然科学基金(41476038、41676049); 中国科学院青年创新促进会基金(2015284); 广东省自然科学基金(2018A030313142)
赵宽(1993—), 男, 硕士研究生, 主要从事珊瑚礁地质与生态研究。E-mail: kuanzhao@scsio.ac.cn
陈天然, 男, 研究员, 从事珊瑚礁与全球变化研究。E-mail: chentianran@scsio.ac.cn
*致谢:感谢中国科学院热带海洋生物资源与生态重点实验室张吕平研究员为本文扫描电镜实验及前处理工作提供指导和帮助。
2019-01-09;
2019-02-26.
Editor: LIN Qiang
National Science Foundation of China (41476038, 41676049); Youth Innovation Promotion Association CAS (2015284); Natural Science Foundation of Guangdong Province (2018A030313142)
CHEN Tianran. E-mail: chentianran@scsio.ac.cn
