临床药师参与晚期直肠神经内分泌瘤患者的药学服务
2019-12-03赵全凤龚玉竹谢赣丰夏培元
赵全凤,龚玉竹,谢赣丰,夏培元,唐 敏
(陆军军医大学第一附属医院 1.药学部,2.肿瘤科,重庆 400038)
胃肠胰神经内分泌肿瘤(gastro-entero-pancreatic neuroendocrine tumor,GEP-NET)是一组起源于神经外胚层含神经内分泌颗粒,原发于胃黏膜、小肠和大肠、直肠或胰腺的肿瘤[1]。直肠癌是亚裔人群最好发部位,且近年来其发病率逐年升高,是胃肠道肿瘤中发病率仅次于大肠癌的肿瘤[2]。晚期转移性直肠神经内分泌瘤的后线治疗方案缺乏,虽然,新型抗肿瘤药物众多,但由于抗肿瘤药物在杀伤肿瘤细胞的同时,也可能引起正常组织或细胞损害,故其不良反应风险较高。我院临床药师通过参与1例晚期直肠神经内分泌瘤患者的药物治疗和全程服务,在此过程中临床药师所做的药学服务工作和发挥的作用可为同仁们参考借鉴。
1 临床资料
患者男性,50岁,体重80 kg,身高181 cm。2011年7月于我院普外科行“腹腔镜直肠类癌根治术(Miles)”,术后病理诊断(直肠)类癌,Ki67阳性细胞数10%,分级为NET G2。术后定期复查,截止2013年7月未见明显复发征象。2014年6、7月复查影像学检查均提示肝转移、盆腔淋巴结转移。考虑该患者病情进展,遂予以24周期奥曲肽微球30mg im,q4w治疗,治疗期间整体病情评估示缓慢进展。2016年7月入院体检诊断2型糖尿病。
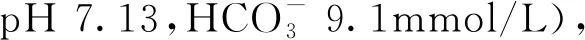
2018年3月复查胸腹部CT示肺部、肝脏病灶进展、多发骨转移瘤较前增多增大,考虑病情进展。鉴于患者体力活动状态(performance status,PS)评分较差(3分),使用卡培他滨1500mg bid单药抗肿瘤治疗。2018年4月复查示病情再次进展,临床药师查阅相关资料发现,目前阿帕替尼用于该患者抗肿瘤治疗的循证证据较充分,建议停用卡培他滨,换用阿帕替尼0.5g qd抗肿瘤治疗。阿帕替尼使用4个月后,2018年8月复查示:双肺结节、纵隔淋巴结均减少;肝脏多发转移瘤,胰腺转移瘤均较前缩小;多发骨转移瘤,较前变化不大,疗效评价为部分缓解(图1)。2018年10、11月患者连续两次影像学评估示肺部、肝脏病灶较2018年4月增大,疗效评估病情进展,使用阿帕替尼的无进展生存期(progression free survival,PFS)约6个月。上述病情评价均根据RECIST1.1标准。患者全程诊疗过程详见图2。
阿帕替尼治疗过程中,主要的不良反应为高血压(使用后约20 d左右出现血压升高,血压多在155~170/103~110 mmHg左右,2级,予以氯沙坦钾100 mg/d 口服降压治疗,血压维持在140~145/85~95 mmHg)、腹泻(间断出现腹泻,严重时每日约5次,2级,予以蒙脱石散等对症处理后好转)。本文不良反应分级均采用美国CTC标准[3]。
2 药学监护与讨论
2.1 依维莫司致高血糖
患者出现高血糖主要考虑两方面,一是疾病因素:患者既往患有2型糖尿病,但未服用依维莫司前自诉血糖水平较低,波动较小,故疾病因素可能性较小。二是药源性因素:根据不良反应评价标准,①患者使用依维莫司与其出现高血糖存在时间相关性;②高血糖反应符合依维莫司已知的不良反应;③住院期间停用依维莫司后,未服用降糖药,而患者血糖恢复正常。故推断该患者是依维莫司引起的不良反应。依维莫司致高血糖的机制与其抗肿瘤作用有关,依维莫司是mTOR抑制剂,mTOR通路抑制可引起胰岛细胞功能障碍,胰岛素分泌受损,同时影响葡萄糖代谢,从而导致高血糖[4]。
然而,前期患者使用依维莫司化疗效果尚可,多次评估均为病情稳定,是否停用依维莫司或者不停药而选择减量等方式继续服用该药?临床药师查阅文献后给出会诊意见建议停药:①高血糖发生率较高:相关大样本Ⅱ/Ⅲ期临床试验研究[5-6]显示,依维莫司致高血糖在神经内分泌肿瘤治疗中的发生率为10%~22%(其中3~4级高血糖发生率为5%~10%),在糖尿病患者中发生率更高。②目前依维莫司在抗肿瘤治疗中致高血糖与其剂量相关性仍不明确。有研究[7]显示依维莫司致高血糖的发生率与剂量相关,但该研究中高低剂量组依维莫司致严重高血糖的发生率无显著性差异,故推测减量使用也可能无法降低该患者的高血糖风险。③该患者发生高血糖所致的酮症酸中毒并发症,虽然根据随机血糖值 (25 mmol/L)属3级不良反应,但其已危及患者生命,应归为4级不良反应。依维莫司相关用药建议[8]中,对于4级不良反应,应永久停止使用依维莫司。综上,不建议继续使用依维莫司。嘱患者停用依维莫司,院外每日监测血糖,当空腹血糖高于7 mmol/L,建议行口服二甲双胍治疗,并及时就医。2018年2月患者再次自行服用依维莫司,临床药师通过全程化药学服务,及时电话随访建议停用依维莫司,避免血糖异常不良反应的再次发生。
2.2 阿帕替尼用于晚期转移性直肠神经内分泌瘤
该患者属于无功能性神经内分泌瘤,先后使用长效奥曲肽、依维莫司、卡培他滨治疗后未能抑制进展。目前多线治疗失败患者的后线化疗药物选择仍是一大难题,且此时患者一般情况较差(PS评分3分),迫切需要有效的药物来改善患者的生活质量和延长生存期,而神经内分泌瘤属富血管肿瘤,遂考虑抗肿瘤血管生成药物治疗的可能。
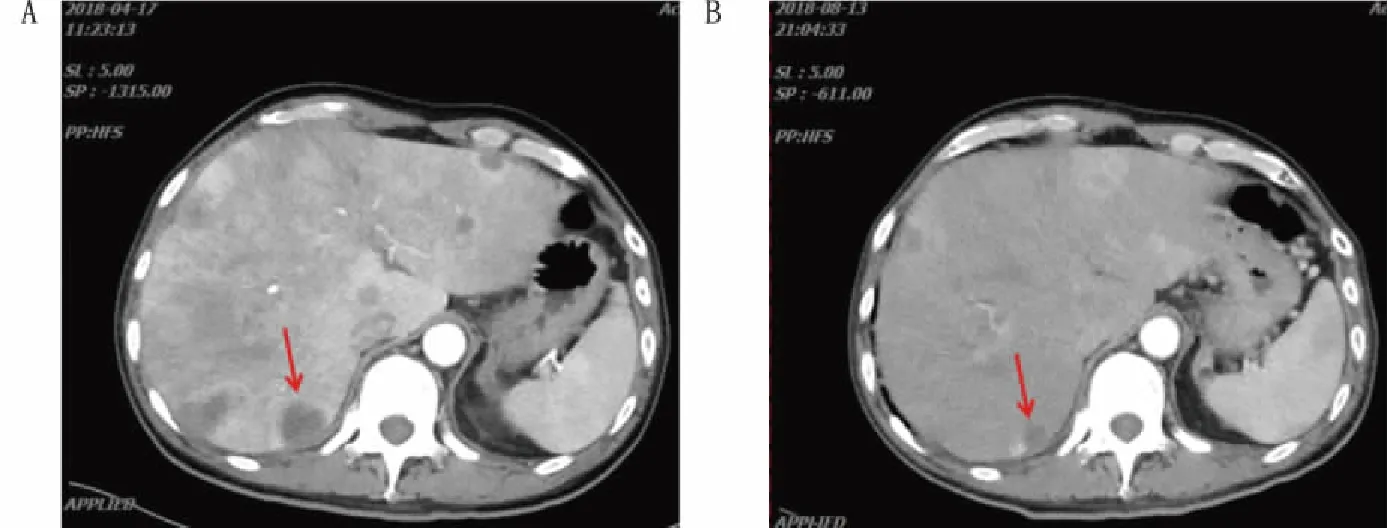
图1 患者对阿帕替尼的应答 A.2018-04-17的CT影像;B.2018-08-13的CT影像
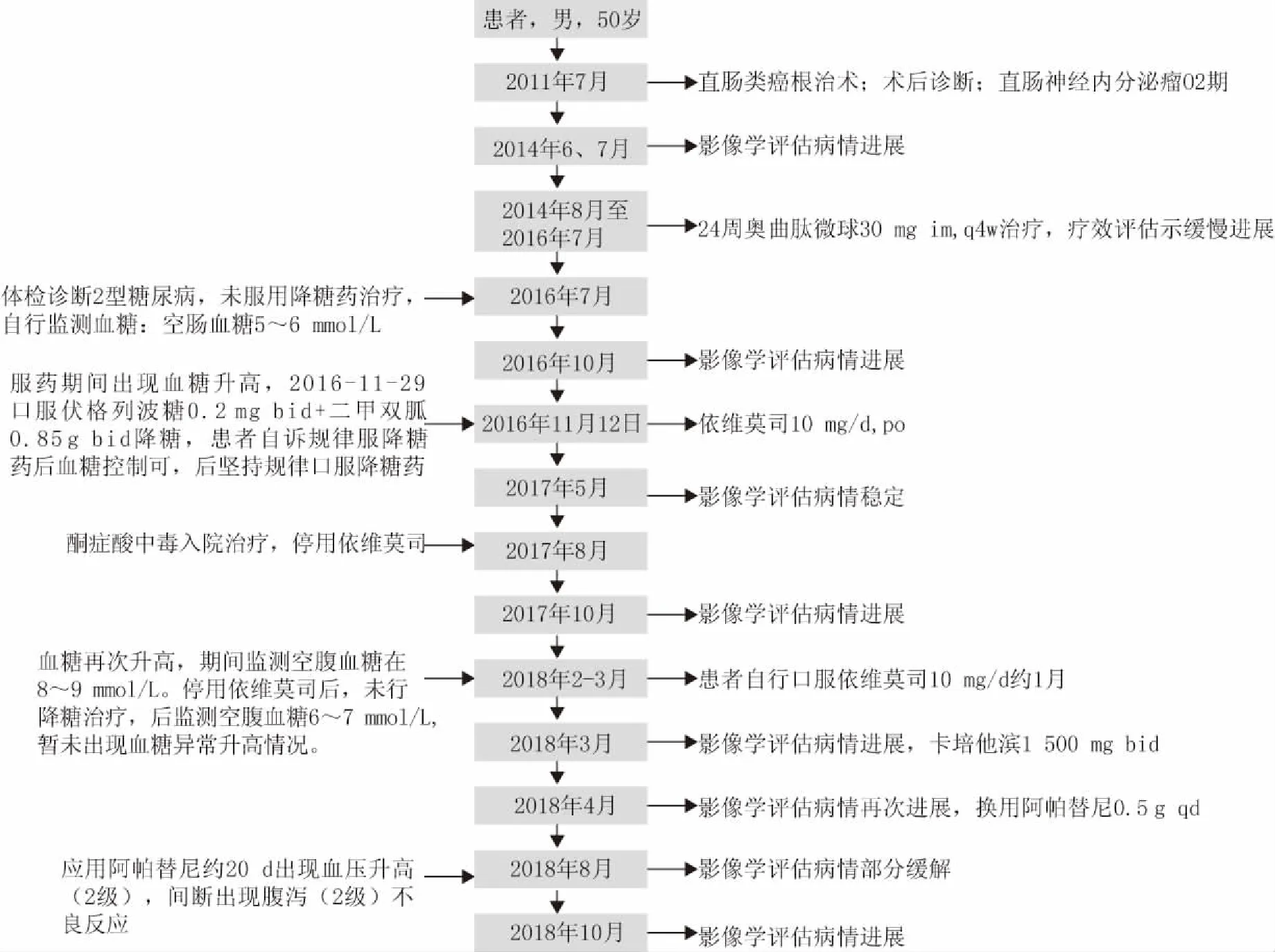
图2 患者全程治疗管理时间轴
抗肿瘤血管生成制剂种类众多,临床药师查阅文献后发现,目前无大样本临床试验讨论晚期直肠神经内分泌瘤如何选用抗肿瘤血管生成制剂,主要参考胃或胰腺神经内分泌瘤,以及其他富血管肿瘤。血管内皮生长因子(vascular endothelial growth factor ,VEGF)及血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)均为肿瘤血管生成的关键驱动因素。目前以VEGF为靶点的药物主要分为抗体类VEGF抑制剂和小分子酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)。抗体类VEGF抑制剂以贝伐珠单抗为代表,相关临床研究显示贝伐珠单抗与卡培他滨[9]、奥曲肽[10]等联用,用于G1/G2进展期神经内分泌瘤均有较好的疾病控制率,但目前暂无贝伐珠单抗单药方案的研究。VEGF主要通过VEGFR的结合和活化显示出促血管生成功能,尤其是VEGFR-2。贝伐珠单抗仅通过靶向外源性相关途径以阻止其与VEGFR-2结合,分析可能是贝伐珠单抗作用靶点单一,而不推荐其单药用于神经内分泌瘤的治疗。近年来小分子多靶点TKI在神经内分泌瘤诊治中的临床研究较多。舒尼替尼是FDA唯一批准用于进展期高分化胰腺神经内分泌瘤(pancreatic neuroendo- crine tumor,pNET)的抗肿瘤血管生成制剂。
该患者目前属于快速进展期,而相关研究显示舒尼替尼对于慢进展型疗效优于快进展型[11]。索拉非尼同属口服多靶点TKI,但相关II期研究结果显示[12],索拉非尼用于高分化的胃肠胰神经内分泌瘤的临床疗效欠佳。帕唑帕尼是国外近年来批准用于肾癌和软组织肉瘤等富血管肿瘤的小分子TKI,Grande的研究结果显示[13],帕唑帕尼单药在晚期转移性胃肠胰神经内分泌瘤中均有较好的疾病控制率,但既往使用过mTOR抑制剂(依维莫司等)或其他TKI药物的患者的无进展生存期显著降低。结合患者既往化疗史(既往使用过依维莫司)和病情状态(目前处于快速进展期),上述药物均不适用。
阿帕替尼是新一代的小分子TKI,作用靶点与上述几种小分子TKI类似,但主要区别是其对VEGFR-2具有高度选择性从而发挥强效的抗血管作用。2014年被批准用于晚期胃腺癌的治疗,目前在肝癌、软组织肉瘤等富血管实体瘤中均有II/Ⅲ期临床试验结果。最新的一项阿帕替尼用于晚期神经内分泌瘤的真实世界研究[14]中,阿帕替尼作为晚期神经内分泌瘤的后线治疗具有较好的疾病控制率,且阿帕替尼属我国自主研发新药,临床研究人群主要以亚洲人为主,药物获得性高,且药物经济学成本相对较低。
综上,结合患者病情、前期化疗史及药物经济学等因素,目前阿帕替尼可能是最佳选择。因此,临床药师与临床医师汇总文献研究结果后,建议选用阿帕替尼靶向治疗。本案例中患者使用阿帕替尼后评估示病情缓解,共获得约6个月的PFS,虽在阿帕替尼治疗中,患者出现了高血压和腹泻(2级),但通过药学监护等均得到缓解。
3 结语
本案例是一例肿瘤专科临床药师拓展临床药学服务,参与晚期直肠神经内分泌瘤患者全程化药学监护的案例。尤其在患者出现药源性不良反应以及抗肿瘤药物后线选择循证证据缺乏的情况下,临床药师结合患者病情,查阅相关文献,协助临床医师优化药物治疗方案,发挥了应有的作用。
