有机小分子催化α,β-不饱和酮的不对称共轭加成反应研究进展
2019-12-02蒋伟健陈志卫
蒋伟健,陈志卫
(浙江工业大学药学院,浙江 杭州 310014)
α,β-不饱和酮的不对称共轭加成反应在有机合成中是一类连接C-C 键的非常重要的反应[1-2]。该反应广泛应用于手性药物的制备、天然产物的合成,该类反应的产物是许多天然产物、生物活性物质以及手性药物的重要中间体[3]。近年来,不对称催化已经成为合成手性分子的一个重要手段。发展得较早的是手性配体与过渡金属联合催化[4-5],但是由于金属离子的引入使得后处理时难以避免部分重金属残留,不利于在制药领域的工业化生产。
相比手性过渡金属以及酶催化,有机小分子催化剂有着独特的优势,如不含过渡金属、容易制备、价格低廉、反应条件温和以及稳定性强等[6-8]。因此,近年来越来越受到有机化学家的关注。同时,有机小分子手性催化剂的广泛应用使得合成手性药物的工业化进程得到了大大提高。本文主要介绍了几类常见的有机小分子催化剂对α,β-不饱和酮的不对称共轭加成反应以及在有机合成中的应用。
1 手性胺催化的α,β-不饱和酮的不对称共轭加成
2014 年,Luo 课题组[9]首次报道了采用手性伯胺催化简单烯烃(芳香烯胺)对α,β-烯酮进行不对称共轭加成。一般来说,简单烯烃由于亲核性较弱以及控制立体选择性难度较高,很少用于共轭加成反应。但是,采用手性伯胺催化的方法可以解决上述困难。该反应底物适用性高,包括α-取代的乙烯基酮都能以高收率和良好的对映选择性得到乙烯基化加合物(图1)。

图1
2015 年,Maruoka 小组[10]通过使用轴向手性胺催化剂,实现了醛对含对甲苯磺酰基保护的α,β-不饱和酮的不对称共轭加成。进一步,通过对甲苯磺酰基的β 消除,可以将产物转化为普通方法难以制备的具有γ-立体中心的烯酮。(图2)

图2
2017 年,He 课题组[11]首次使用简单的手性伯胺作为催化剂,开发了一种简单的有机催化迈克尔-羟醛脱水多米诺反应,用于从丙酮和α,β-不饱和酮制备手性3,5-二芳基-环己烯酮。并且获得了中等至良好的产率(高达85%)和出色的对映选择性(88%~98%ee)(图3)。

图3
2019 年,Luo 小组[12]报道了通过手性伯胺催化剂以烯酮和硝酮进行1,3-偶极环加成得到具有多个立体异构中心的稠合双环异恶唑烷衍生物的合成方法。该反应具有良好至优异的对映选择性(图4)。
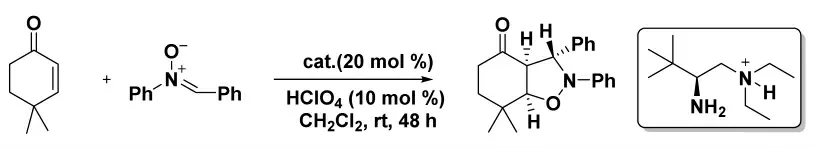
图4
2 手性磷酸催化的α,β-不饱和酮的不对称共轭加成
2012 年,游书力小组[13]报道了一条通过手性磷酸催化色胺与烯酮的迈克尔加成环化级联反应得到吡咯烷二酮的路线。该路线用低至5 mol%的手性磷酸,从廉价易得的色胺和烯酮中以良好的收率和对映选择性(高达95%收率和83%ee值)获得了对映体富集的吡咯并吲哚衍生物。值得指出的是,该方法可进一步应用于合成含有吡咯并吲哚核心的天然产物(图5)。

图5
2017 年,游书力课题组[14]提出了在催化量的手性磷酸的存在下,以温和的反应条件,吲哚基烯酮进行对映选择性分子内脱芳香性迈克尔加成,可获得具有良好的收率和高对映选择性(高达97% ee)的各种带有季立体异构中心的富含对映体的螺-吲哚胺(图6)。并在后续实验中以克级反应得到的螺-吲哚胺,其收率和选择性并未发生改变。

图6
2017 年,Correia 等人[15]报道了一条以手性磷酸为催化剂,对吲哚嗪与烯酮进行不对称共轭加成制备高收率和高选择性的烷基化吲哚嗪的路线(图7)。除了其广泛的生物学活性外,还原型的吲哚嗪还因其为吲哚嗪二生物碱的直接前体而闻名。该路线以较高收率和ee 值合成了几种烷基化的吲哚嗪,并对其进行了包括还原胺化、还原内酯化和部分氢化的衍生。
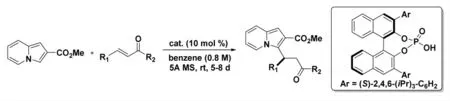
图7
2019 年,Li 小组[16]报道了在手性螺环磷酸催化下将吲哚和吡咯与外环烯酮共轭加成的路线,该路线具有较高的收率以及高度的对映选择性(图8)。该路线为合成具有α-手性中心和特征的含吲哚的环状酮提供了一种简单有效的方法。
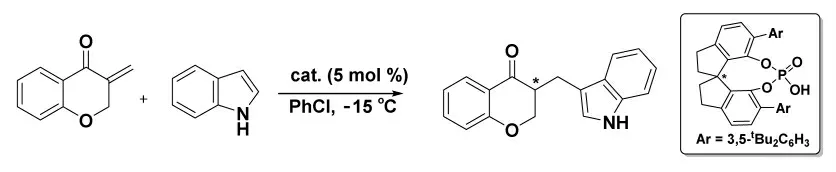
图8
3 手性联萘酚催化的α,β-不饱和酮的不对称共轭加成
2007 年,Wu 课题组[17]首次报道了非金属催化的不对称共轭链烯基化方法(图9)。该路线所使用的烯基硼酸酯和联萘酚催化剂均已实现商品化。并且对于广泛的烯酮底物,产物均具有优异的对映选择性。

图9
2011 年,Turner 课题组[18]报道了以手性联萘酚为催化剂,催化芳基硼酸酯亲核进攻α,β-不饱和酮制备手性化合物的方法(图10)。该路线实现了以往难以实现的不对称共轭芳基化,并且其收率和选择性(最高至99% ee 值)均较高。但美中不足的是,该路线的反应温度较高,且反应时间较长。

图10
2012 年,Luan 小组[19]报道了手性联萘酚催化芳基或链烯基硼酸酯对邻醌甲基化物的不对称共轭加成(图11)。在10 mol%催化量下,以高选择性(最高96% ee)和高收率(最高95%)获得取代的2-苯乙烯基苯酚。并且通过该路线,以高收率和选择性两步合成(S)-4-甲氧基金氧烷。
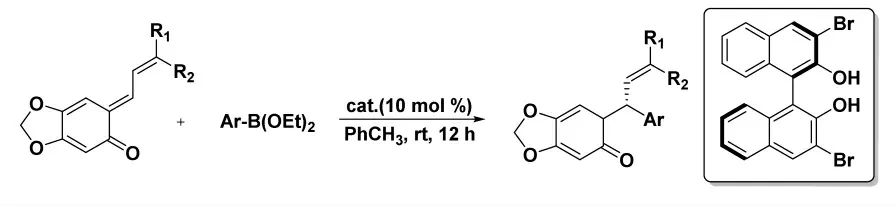
图11
2015 年,Shih 课题组[20]使用手性联萘酚催化剂,以相应的三氟硼酸盐作为亲核试剂,通过有机催化对映选择性共轭加成反应形成双-杂芳基或双-芳基立体中心(图12)。该反应在邻位取代的芳基亲核试剂和范围广泛的β-芳基烯酮和烯醛中反应良好。同时,该方法可应用于BR5 成纤维细胞迁移的抑制剂-盘状吡咯D 的合成。

图12
4 结语
由于α,β-不饱和酮在医药领域的应用,对其手性衍生物的研究具有重要的意义。其参与的不对称共轭加成反应是合成新的手性化合物或杂环化合物的重要方法,这其中有机小分子催化剂的研究显得十分重要。实验结果表明,现阶段催化剂的使用范围和通用性仍然具有不同程度的局限性。所以,在现有催化剂基础上对其进行合理修饰,得到具有更优催化效果且可以大量使用在不对称反应中的有机催化剂,是今后研究领域的工作重点。
