混合盐碱胁迫对龙葵幼苗生理生化特性的影响
2019-11-28于爽高剑于洋杨新宇王春雪冀屹
于爽 高剑 于洋 杨新宇 王春雪 冀屹
摘要:为了明确龙葵(Solanum nigrum L.)幼苗对不同盐碱胁迫的适应性差异,从而合理高效地利用龙葵资源,以龙葵幼苗为材料,用不同浓度的中性单盐NaCl、中性混合盐(NaCl、Na2SO4的浓度比为1 ∶2)和碱性混合盐(NaCl、Na2SO4、NaHCO3、Na2CO3的浓度比为5 ∶23 ∶9 ∶3)进行胁迫处理,研究龙葵幼苗抗氧化酶与渗透调节物质含量的变化。结果表明,在中性盐与碱性盐的作用下,龙葵幼苗都会遭受氧化胁迫。随着盐浓度的升高,叶片中的丙二醛含量增大,超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性也在一定范围内增大。在碱性混合盐的作用下,抗氧化酶活性在盐浓度为100~150 mmol/L时达到最大值,然后开始下降;在中性混合盐胁迫下,只有POD活性上升,SOD、CAT活性均表现出先上升然后下降的趋势;在中性单盐NaCl的胁迫下,只有CAT活性在盐浓度>200 mmol/L 时下降,而其他2种酶活性持续上升。在碱性混合盐作用下,龙葵幼苗会积累更多的丙二醛,在盐浓度为300 mmol/L时达到最高值,渗透调节物质(脯氨酸、可溶性糖)的含量也在一定范围内增加。
关键词:龙葵;盐碱胁迫;生理指标;生化指标
中图分类号: S332.6;Q945.78文献标志码: A
文章编号:1002-1302(2019)18-0164-04
收稿日期:2019-03-01
基金项目:2018年度黑龙江省省属高等学校基本科研业务费科研项目(编号:1353ZD007);黑龙江省大学生创新创业训练计划(编号:201810233044);牡丹江师范学院学位与研究生教育教学改革研究项目“植物学科研究生课程体系建设与优化”(2018)。
作者简介:于 爽(1974—),女,黑龙江宝清人,硕士,教授,主要从事植物生物学的教学与研究工作。E-mail:swxys@126.com。
近年来,由于化肥的过量施用及缺乏正确合理的灌溉方式,盐碱化土地面积逐年扩大。土壤盐碱化已经成为世界性的环境问题[1],严重影响了植物的生长和发育。盐碱土的分布类型多种多样[2-3],以往的研究只注重中性盐胁迫方面[4],但是在实际情况中,盐与碱是相伴而生的[5],研究混合盐碱下植物的生理生化响应规律及与单盐胁迫的差异性,具有十分重要的意义。
龙葵(Solanum nigrum L.)是茄科茄属的一年生草本植物,在我国分布广泛,其性寒、味苦、微甘[6-8],可以作为中草药饲料添加剂,龙葵的嫩枝叶也可以作为畜禽饲料源[9]。龙葵的果肉甜而多汁,营养丰富,含有较高的维生素C、维生素B及多种矿物质,可以制成果醋饮料,具有广阔的应用前景[10-12]。研究发现,龙葵对干旱和低温具有一定的适应性[13-16],而关于混合盐碱条件下龙葵生理生化响应方面的研究还未见报道。本研究利用溶液培养模拟土壤盐碱化条件对龙葵幼苗进行处理,探讨龙葵幼苗在混合盐碱胁迫下的生理生化指标变化规律,以期为龙葵的种植及开发利用提供一定的理论依据。
1 材料与方法
1.1 试验材料
本试验于2016年7月在牡丹江师范学院温室中进行。从牡丹江西山采集成熟的龙葵果实,将种子取出并播种到塑料盆钵中,在26 ℃培养箱中培养至幼苗长出4张真叶时,取生长良好、大小相同的幼苗作为试验材料。
1.2 盐胁迫处理
用1/2 Hoagland配制盐溶液,将幼苗放置于广口瓶中进行培养,广口瓶用黑纸遮光以保证根系不见光。设A组为NaCl中性盐溶液,B组为NaCl+Na2SO4中性混合盐溶液(浓度比为1 ∶2),C组为NaCl+Na2SO4+NaHCO3+Na2CO3碱性混合盐溶液(浓度比为5 ∶23 ∶9 ∶3)。每组均设置0(对照)50、100、150、200、300 mmol/L 6个浓度梯度,对照为1/2 Hoagland营养液。每个处理设置3个重复。为了避免盐冲击现象,先用低浓度盐溶液培养,逐渐更换成高浓度盐溶液,最终达到最高浓度,其间定期更换处理液。在达到最高浓度10 d 后,采集各个植株的第3~4张功能叶,进行各个指标的测定。
1.3 指标测定
采用蒽酮比色法测定可溶性糖含量;采用硫代巴比妥酸法测定丙二醛(MDA)含量;采用茚三酮比色法测定脯氨酸含量;采用氮藍四唑法测定超氧化物歧化酶(SOD)活性;采用高锰酸钾滴定法测定过氧化氢酶(CAT)活性;采用愈创木酚比色法测定过氧化物酶(POD)活性[17-18]。每个样品、每个指标重复检测3次。
1.4 数据统计分析
采用Excel 2007和SPSS 18.0对试验数据进行分析。
2 结果与分析
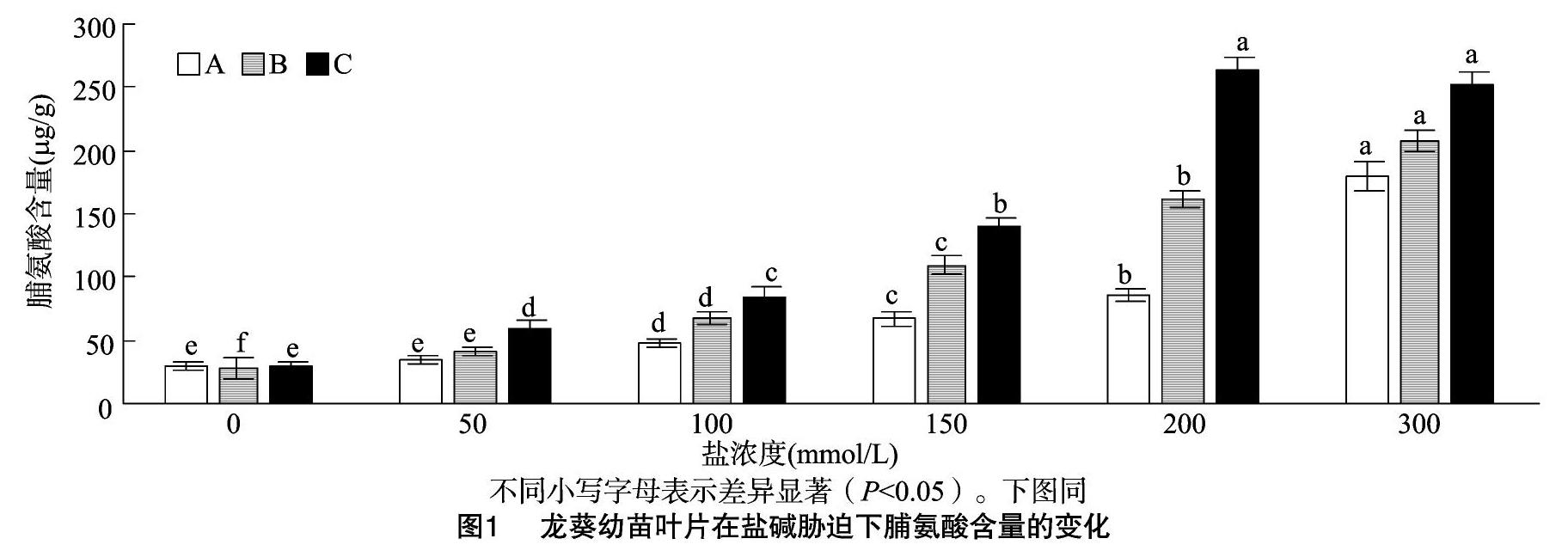
2.1 盐碱胁迫对龙葵叶片脯氨酸含量的影响
脯氨酸是植物中主要的渗透调节物质,植物在受到逆境胁迫时,体内会大量累积脯氨酸,进而调节细胞的渗透势[19],植物的抗逆能力与脯氨酸的累积量呈正相关。从图1可以看出,龙葵幼苗叶片内的脯氨酸含量随着盐浓度的不断升高整体上出现不同程度的上升趋势。当盐浓度为50~150 mmol/L 时,碱性盐胁迫相比于中性盐胁迫对植物产生的影响更早。当盐浓度为200 mmol/L时,碱性混合盐处理的脯氨酸含量最高,是对照的9.0倍(P<0.05),差异显著,中性单盐、中性混合盐处理的脯氨酸含量分别是对照的3.1、5.5倍(P<0.05)。当盐浓度为300 mmol/L时,中性单盐和中性混合盐处理的脯氨酸含量最高。由此可见,相比于中性盐,碱性盐对脯氨酸含量的影响较大。在盐浓度为0~200 mmol/L的范围内,脯氨酸含量能够表现出植株受伤害的程度,而盐浓度为300 mmol/L时,会超越植株的忍耐程度,其组织和器官的生理代谢功能已经被破坏。
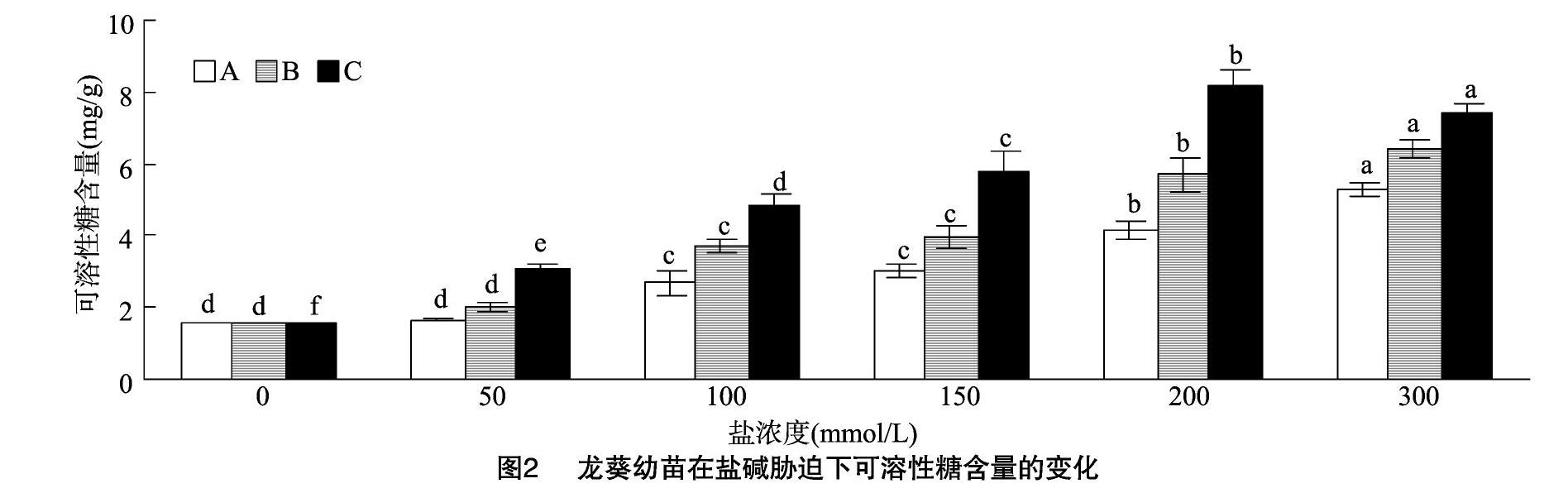
2.2 盐碱胁迫对龙葵叶片可溶性糖含量的影响
植物在适应盐渍环境的过程中会产生可溶性糖,又因为可溶性糖在细胞中的溶解度较大,因此在盐渍情况下,随可溶性糖含量的增多,能够使细胞质浓度变大,从而使植物的吸水能力变强,增强其耐盐性[20]。由图2可以看出,在中性盐胁迫下,可溶性糖含量随着盐浓度的增加呈上升趋势,中性单盐、中性混合盐处理的可溶性糖含量在其浓度为300 mmol/L 时达到最高值,分别是对照的3.3、4.1倍(P<0.05),与对照间的差异达到显著水平。而在碱性盐胁迫下,可溶性糖含量呈现先升后降的趋势,200 mmol/L时最高,是对照的4.7倍(P<0.05),碱性混合盐与中性单盐、中性混合盐的差异也最大,C处理是A处理的1.97倍,是B处理的1.43倍(P<0.05),差异显著。龙葵通过增加叶片的可溶性糖含量,以保护细胞免受伤害。当盐浓度为200~300 mmol/L时,可溶性糖含量开始下降,可能由于盐浓度的继续增加,致使细胞的渗透性调节系统失衡。
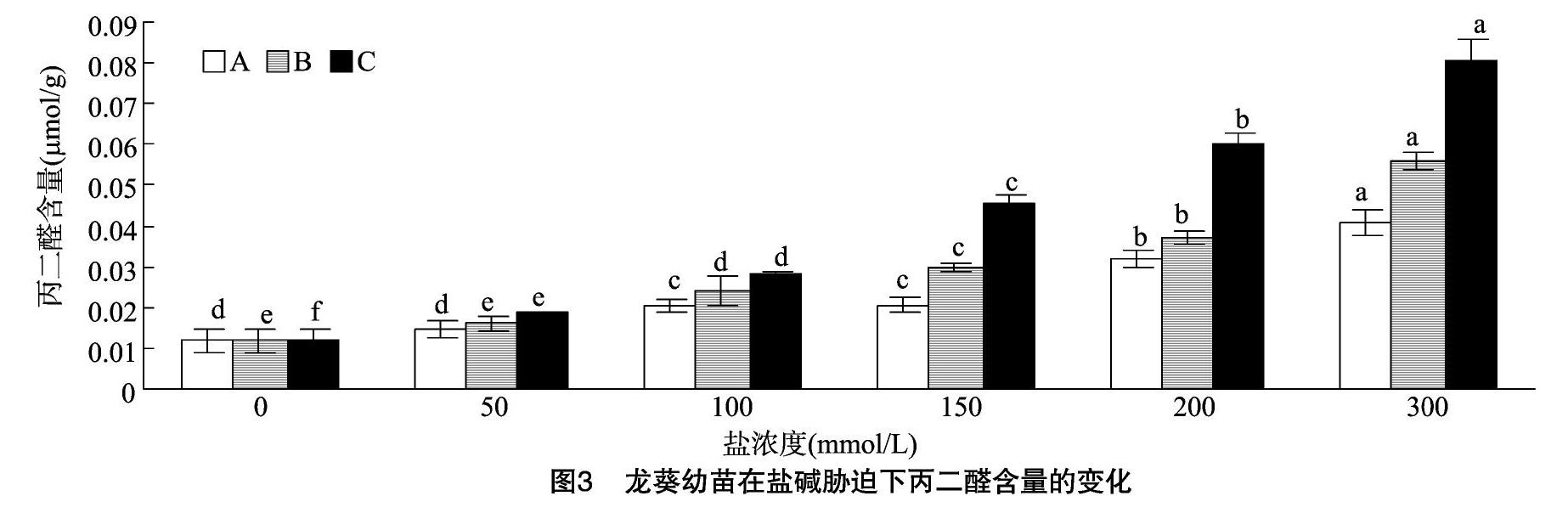
2.3 盐碱胁迫对龙葵叶片丙二醛含量的影响
膜脂过氧化过程能够产生一种非常重要的物质MDA,其含量能够衡量植物体内自由基的动态变化和细胞的受损程度[21]。由图3可知,当盐浓度达到50 mmol/L时,3个处理组对丙二醛含量的影响是很小的,与对照相比差异不明显,说明当盐浓度较低时,龙葵对于中性盐与碱性盐都有一定的适应
性。当盐浓度大于100 mmol/L时,3个处理组的丙二醛含量随着盐浓度的升高而明显增多。当盐浓度为300 mmol/L时,丙二醛含量均达到最高值,丙二醛含量与盐浓度之间表现出正相关,上升趋势为C组>B组>A组。说明混合盐对龙葵的伤害要高于单盐,而碱性盐相比于中性盐,对龙葵的伤害要更高。由此可见,在碱性盐胁迫下会使龙葵的膜脂过氧化程度加强,对于龙葵叶片细胞膜系统功能的损伤更大。
2.4 盐碱胁迫对龙葵叶片超氧化物歧化酶活性的影响
超氧化物歧化酶广泛分布在植物体内,其主要作用是去除活性氧,能够把植物体内具有破坏性的超氧化物阴离子自由基转变为H2O2,产物H2O2可由过氧化氢酶进一步分解为H2O和O2,或被过氧化物酶利用,从而避免自由基对细胞进行破坏[22]。从图4可以看出,当盐溶液浓度升高时,中性单盐处理的SOD活性呈现不断升高的趋势,在300 mmol/L处理下达到较高水平,此时的SOD活性是对照组的2.2倍,但不能够确定是否为活性峰值;当中性混合盐和碱性混合盐溶液浓度持续升高时,中性混合盐、碱性混合盐处理的SOD活性呈先上升后下降的趋势,并且碱性混合盐处理的SOD活性明显大于中性混合盐,中性混合盐、碱性混合盐达到SOD活性最佳水平时分别是对照的1.92、2.64倍。SOD活性体现了植物体内活性氧产生的情况,这可能说明碱性混合盐对SOD的影响要远高于中性混合盐和中性单盐。
2.5 盐碱胁迫对龙葵过氧化物酶活性的影响
过氧化物酶是植物活性氧清除系统中防止植物受活性氧危害的具有重要意义的酶,植物体内过多的H2O2就是由POD来清除从而起到防止植物受损作用的。植物耐盐性的强弱在很大程度上是由POD活性的大小来决定的,因此植物耐盐性的大小可用POD活性来衡量[23]。从图5可以看出,中性单盐、中性混合盐处理下的POD活性随着盐浓度的增加呈现出上升趋势,在300 mmol/L盐浓度处理下达到较高水平,分别为对照组的2.48、3.30倍。在碱性混合盐处理下呈先上升后下降的趋势,在150 mmol/L盐浓度时达到峰值,为对照组的3.52倍。POD作为组织老化的一种生理指标,可以反映3种处理对植物机体的损害程度,在50~300 mmol/L浓度范围内,POD活性大小排序为C组>B组>A组。
2.6 盐碱胁迫对龙葵过氧化氢酶活性的影响
在植物组织中常見一种含铁的过氧化氢酶,这种酶主要存在于抗氧化系统中,在叶绿素中也存在。由于过氧化氢酶能将其分解为H2O、O2,因此大大减少了由H2O2诱发产生的单线态氧和某些自由基,从而避免了对膜结构、DNA及蛋白质等的损伤[24]。由图6可知,3组处理下的CAT活性随着盐溶液浓度的增加均呈先上升后下降的趋势,3个处理组的CAT活性分别在200、150、100 mmol/L盐浓度下达到峰值,分别是对照组的1.50、1.55、1.52倍。从先后达到峰值的处理水平可以看出,植物机体对于3种盐溶液处理的耐受程度表现为中性单盐处理>中性混合盐处理>碱性混合盐处理。
3 讨论与结论
渗透胁迫是植物遭受盐胁迫最直接的生理反应,渗透调节物质的产生可以增强植物细胞的吸水能力[25]。脯氨酸和可溶性糖是植物体内重要的渗透调节剂[26],在本试验中,随着盐浓度的升高,龙葵叶片的脯氨酸与可溶性糖含量整体上呈现増加趋势。在碱性盐胁迫下,脯氨酸、可溶性糖的含量在盐浓度达到200 mmol/L时出现峰值,之后便开始下降。这说明渗透调节系统在碱性盐浓度高于200 mmol/L时已遭到损坏,无法维持渗透压的稳定,无法抵抗由盐分逆境而引起的渗透胁迫[27]。中性盐2个处理组(A组和B组)的可溶性糖含
量变化情况相同,都随盐浓度的不断增加而增加,而且组间无显著差异,这说明离子成分对可溶性糖含量所产生的影响要远小于盐浓度所造成的影响。
POD、SOD、CAT是保护酶系统中最重要的3种酶,它们能抑制活性氧(ROS)对质膜的破坏作用,MDA是植物遭受逆境胁迫后膜脂过氧化的重要产物,它们之间存在十分紧密的关系[28]。本研究中,在低浓度盐胁迫下(<100 mmol/L),3种胁迫处理的MDA含量缓慢增加,POD、SOD活性都逐渐增强。当盐浓度增加至100~150 mmol/L时,碱性混合盐处理下的龙葵叶片MDA含量快速増加,而SOD、CAT活性则呈下降趋势。在中性盐胁迫下,在浓度达到150~200 mmol/L时,中性混合盐处理的CAT活性开始下降,而中性混合盐、中性单盐处理的POD活性均持续上升。究其原因,可能是在胁迫初期,细胞膜脂过氧化,MDA含量上升,与此同时植物为减缓细胞伤害,启动叶片内保护酶POD、SOD、CAT,清除细胞内多余的活性氧,致使抗氧化酶活性上升。植物细胞内的活性氧随着处理盐浓度的增加而不断积累,抗氧化酶活性因破坏了抗氧化酶结构而下降。同时在胁迫后期,加剧了盐胁迫的毒害作用,使植物细胞的膜脂过氧化更为严重。这主要是因为一般植物都会存在一个忍耐活性氧的阈值,当植物体内的活性氧水平超过这个阈值时,植物自身的抗氧化系统就会遭到破坏,从而导致植物自身的活性氧代谢失调,对植物自身造成了损伤。因此本研究得出,POD对活性氧的忍耐阈值最高,CAT最差,而SOD居中。
参考文献:
[1]宇振荣. 中国土地盐碱化及其防治对策研究[J]. 农业生态环境,1997,13(3):1-5.
[2]魏博娴. 中国盐碱土的分布与成因分析[J]. 水土保持应用技术,2012,18(6):27-28.
[3]王善仙,刘 宛,李培军,等. 盐碱土植物改良研究进展[J]. 中国农学通报,2011,35(24):1-7.
[4]郭 玲,周慧杰. 盐胁迫对南疆野生龙葵种子萌芽的影响[J]. 北方园艺,2012,36(24):25-27.
[5]周道玮,李 强,宋彦涛,等. 松嫩平原羊草草地盐碱化过程[J]. 应用生态学报,2011,22(6):1423-1430.
[6]张海洋. 值得开发的植物资源——龙葵[J]. 北方园艺,1997,117(6):13-14.
[7]文志华. 野生资源龙葵的开发利用[J]. 云南农业科技,2006,47(1):56-58.
[8]徐东花. 龙葵的化学成分及药理作用研究[J]. 黑龙江中医药,2007,61(2):46-47.
[9]王万贤,杨 毅. 野生食果资源与产品开发[M]. 武汉:武汉大学出版社,1998:137.
[10]朱 畅,李 伟. 龙葵果醋饮料的研制[J]. 食品研究与开发,2015,36(21):86-89.
[11]王晓英,王 磊,段连海,等. 野生龙葵果在食品行业中的应用与进展[J]. 饮料工业,2014,17(1):40-43.
[12]伍敏生,黄玉明,胡耀威. 龙葵果加工炮制方法及工艺研究[J]. 中医学报,2017,32(3):433-435.
[13]单会娇,王 冰,许 亮,等. 环境胁迫对龙葵形态特征及内在品质影响[J]. 现代中药研究与实践,2015,29(5):1-3.
[14]杨 彬,金小青,陈修斌. 温度对龙葵幼苗质膜透性和抗氧化酶活性的影响[J]. 农业工程,2018,8(4):123-127.
[15]苏 旭,刘玉萍,廉海霞,等. 青海省药用植物龙葵栽培前后光合特性的比较[J]. 中国野生植物资源,2013,32(4):13-19.
[16]卞 勇,吕冬霞. 龙葵的室内栽培及利用[J]. 生物学杂志,2003,20(4):40-41.
[17]王学奎. 植物生理生化实验原理和技术[M]. 2版. 北京:高等教育出版社,2006:28-32.
[18]张志良,瞿伟菁,李小方. 植物生理学实验指导[M]. 4版. 北京:高等教育出版社,2009:186-192.
[19]Aroca R,Ruiz-Lozano J M,Zamarreo A M,et al. Arbuscular mycorrhizal symbiosis influences strigolactone production under salinity and alleviates salt stress in lettuce plants[J]. Journal of Plant Physiology,2013,170(1):47-55.
[20]李志亮,王 刚,吴忠义,等. 脯氨酸与植物抗渗透胁迫基因工程改良研究进展[J]. 河北师范大学学报,2005,63(4):404-408.
[21]李 悦,陈忠林,王 杰,等. 盐胁迫对翅碱蓬生长和渗透调节物质浓度的影响[J]. 生态学杂志,2011,37(1):72-76.
[22]闫永庆,王文杰,朱 虹,等. 混合盐碱胁迫对青山杨渗透调节物质及活性氧代谢的影响[J]. 应用生态学报,2009,29(9):2085-2091.
[23]陶 晶,陈士刚,秦彩云,等. 盐碱胁迫对杨树各品种丙二醛及保护酶活性的影响[J]. 东北林业大学学报,2005,62(3):13-15.
[24]樊瑞苹,周 琴,周 波,等. 盐胁迫对高羊茅生长及抗氧化系统的影响[J]. 草业学报,2012,29(1):112-117.
[25]刘 铎. 盐柳对中、碱性钠盐生长与生理响应差异性研究[D]. 北京:中国林业科学研究院,2015:35-40.
[26]沈义国,陈受宜. 植物盐胁迫应答的分子机制[J]. 遗传,2001,23(4):365-369.
[27]刘凤容,陈火英. 盐胁迫下不同基因型番茄可溶性物質含量的变化[J]. 植物生理与分子生物学学报,2004,30(1):99-104.
[28]李淑梅,董丽平. 混合盐碱胁迫对高羊茅种子萌发及幼苗生理生化特性的影响[J]. 黑龙江畜牧兽医,2016,61(3):139-140.
