欧洲温室型黄瓜同源四倍体新种质的创制与鉴定
2019-11-28武娅歌赵建华宋晓飞李晓丽孙成振闫立英郑金双
武娅歌 赵建华 宋晓飞 李晓丽 孙成振 闫立英 郑金双


摘要:为构建黄瓜同源四倍体诱导技术体系,创制新种质,以3个秋水仙素浓度(0.1、0.2、0.3 g/L)3个处理次数(3、5、7次)对二倍体欧洲温室型黄瓜(2n=2x=14)幼苗生长点进行处理,通过植株形态鉴定与气孔鉴定、DNA相对含量鉴定和细胞学鉴定等方法,筛选诱变植株并鉴定倍性。研究发现,以2、3 g/L秋水仙素处理5次诱导效果较好,获得了欧洲温室型黄瓜同源四倍体(2n=4x=28)和非整倍体(2n=4x=26)。与二倍体亲本相比,同源四倍体黄瓜子叶大小、叶片大小、主茎粗、雌雄花大小、保卫细胞大小和保卫细胞内叶单位面积绿体数目等均呈极显著增加,但气孔密度极显著减少。本研究获得了欧洲温室型黄瓜同源多倍体新种质,为黄瓜种质创新与欧洲温室型新品种选育奠定了基础。
关键词:欧洲温室型黄瓜;秋水仙素;多倍体;二倍体;同源四倍体;气孔;细胞学;诱导效果;形态特征
中图分类号:S642.202.4文献标志码: A
文章编号:1002-1302(2019)18-0141-05
收稿日期:2018-06-08
基金项目:河北省自然科学基金(编号:C2015407058)。
作者简介:武娅歌(1993—),女,河北邢台人,硕士研究生,研究方向为蔬菜作物育种。E-mail:969361514@qq.com。
通信作者:郑金双,博士,讲师,研究方向为蔬菜作物、药用植物栽培和育种。E-mail:jinshuangk@163.com。
黄瓜(Cucumissativus L.)为葫芦科甜瓜属植物,原产于喜马拉雅山南麓的热带雨林地区和中国的云南地区,是世界上主要的蔬菜作物之一,也是设施栽培的主要蔬菜作物[1]。不同区域喜好不同,主栽品种和类型也不同,果实形态、口感差异较大。欧洲温室型黄瓜以无刺、色深绿、肉质软、味甜等特点,成为重要的鲜食“水果型”黄瓜。目前,黄瓜遗传基础狭窄,我国黄瓜育种材料的亲缘关系过于单一,遗传育种研究相对落后[2]。
多倍体因其“巨大性”,能显著提高作物的产量和品质,增强植物的抗病、抗逆能力[3-4]。多倍体育种已广泛应用在粮食作物[5]、果蔬作物[6-8]、观赏植物[9-11]以及药用植物[12-14]的育种工作中。
目前,黄瓜多倍体育种方面的研究已经开展。陈劲枫等利用秋水仙素溶液处理萌动种子,获得了华北型黄瓜同源四倍体[6]。刁衛平等采用离体诱导未授粉子房的方法,获得了华北型黄瓜同源四倍体[15]。鄢郁霖等利用秋水仙素处理干种子和已露出0.5~1.0 cm胚根的萌动种子,获得了露地型黄瓜同源四倍体[16]。刘永月等利用秋水仙素和二甲基亚砜混合液处理萌动种子,获得了华北型无毛黄瓜同源四倍体[17]。但关于欧洲温室型黄瓜多倍体的研究报道较少。本研究采用不同浓度和不同处理次数对欧洲温室型黄瓜幼苗生长点进行诱导处理,旨在建立秋水仙素诱导黄瓜幼苗生长点技术体系及其倍性鉴定体系,创造同源四倍体新种质,丰富黄瓜种质资源,为欧洲温室型黄瓜新品种的选育奠定基础。
1 材料与方法
1.1 试验材料
以南京农业大学黄瓜课题组陈劲枫教授提供的欧洲温室型黄瓜‘南水3号种子为试验材料。
1.2 多倍体诱导
2015年秋,种子温烫浸种后播于50孔穴盘中,置于日光温室内育苗。2张子叶完全展开后,将棉球置于生长点,用胶头滴管吸取秋水仙素溶液,滴于生长点棉球上,完全浸湿棉球。于07:00—08:00和17:00—18:00进行0.1、0.2、0.3 g/L 3个秋水仙素浓度处理,3个处理次数为3、5、7次,共9个处理,以蒸馏水处理为对照,每个处理100株。处理结束后,弃去棉球。
1.3 多倍体植株的鉴定
1.3.1 植株形态鉴定与气孔鉴定
形态鉴定:于同一时间观测对照与处理植株的高度、叶片形态,进行变异植株初步的形态鉴定。
气孔鉴定:取完全展开的叶片,撕取下表皮,利用显微镜观察气孔的大小、气孔密度、保卫细胞内叶绿体数量,进行气孔鉴定。每个植株选取10个视野,统计(20倍视野下)气孔密度,每个视野随机选1个气孔测量气孔保卫细胞的长度和宽度。
1.3.2 DNA相对含量鉴定和细胞学鉴定
通过形态鉴定和气孔鉴定,对筛选出的候选变异植株进行自交留种。2016年春播种,对T1代植株进行DNA相对含量鉴定和细胞学鉴定。
DNA相对含量鉴定:取对照和候选变异植株生长点幼嫩叶片,利用流式细胞仪进行DNA相对含量鉴定。
细胞学鉴定:根据流式细胞仪检测结果,对DNA相对含量变化的植株进行染色体计数,进一步鉴定倍性。于晴天07:00—08:00取长度约1 mm的幼嫩雄花,于卡诺固定液(无水乙醇 ∶冰乙酸3 ∶1)中固定24 h,蒸馏水洗涤3次,75%乙醇中保存。采用常规压片制片法[18],利用光学显微镜观察花药绒毡层体细胞染色体数量,进行细胞学鉴定。每个植株统计20个细胞,以加倍染色体数量所占比例高于85%作为同源四倍体纯合体的鉴定标准。
根据秋水仙素处理后成苗株数计算死亡率,根据上述鉴定方法鉴定获得的同源四倍体株数计算诱导率。
死亡率=死亡的幼苗数/总数×100%;
诱导率=产生变异的幼苗数/总数×100%。
1.4 二倍体与同源四倍体欧洲温室型黄瓜比较
对鉴定为同源四倍体的欧洲温室型黄瓜植株进行自交留种,2017年春对T3代植株进行二倍体与同源四倍体植株形态、显微特征与果实品质比较。
1.4.1 二倍体与同源四倍体欧洲温室型黄瓜植株形态特征比较
营养器官:于子叶期和结果期分别测量二倍体与变异植株的形态特征,子叶期测定子叶长、子叶宽、子叶节长、子叶节粗,结果期测定植株的高度、中部的叶片长与叶片宽、主蔓节间长、主蔓节间粗、叶柄长、叶柄粗。
生殖器官:取当天开放的雌花和雄花进行拍照,分割雌花与子房,比较二倍体和同源四倍体雌雄花和子房大小。
1.4.2 二倍体与同源四倍体欧洲温室型黄瓜显微特征比较
气孔特征比较采用的方法同“1.3.1”气孔鉴定。取0.5 mm 左右大小的雄花,用卡诺固定液(无水乙醇 ∶冰乙酸=3 ∶1)固定24 h,75%乙醇保存。采用常规压片制片法,利用光学显微镜观察花粉粒形态。取当天开放雄花,利用KYKY-2800扫描电子显微镜观察二倍体与同源四倍体的花粉粒形态。
1.4.3 二倍體与同源四倍体欧洲温室型黄瓜果实特征比较
取二倍体与同源四倍体商品瓜,测定商品瓜果实形态特征(瓜长、瓜横径、瓜把长、中心腔、果肉厚)、含水量和含糖量。
1.5 数据分析
数据统计采用Excle 2010,数据分析采用DPS 14.50。
2 结果与分析
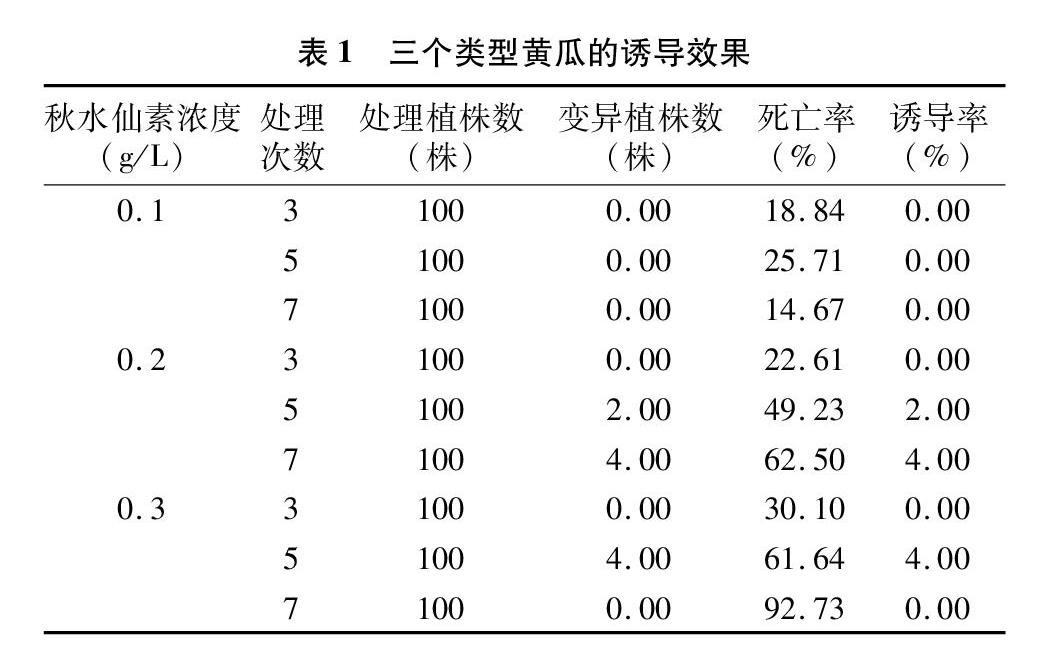
2.1 秋水仙素对欧洲温室型黄瓜的诱导效果
由表1可知,随着秋水仙素处理浓度的增加和次数的延长,死亡率呈增加趋势。0.1 g/L秋水仙素处理时,黄瓜幼苗死亡率相对最低,变异率为0.00。0.3 g/L 秋水仙素处理时,随着处理次数的增加,对生长点毒害作用增强,黄瓜幼苗死亡率相对较高,处理7次时死亡率达到92.73%。综合诱导率和死亡率,以0.2、0.3 g/L秋水仙素处理5次诱导效果较佳。
2.2 多倍体黄瓜植株的获得
2.2.1 植株形态鉴定与气孔鉴定
根据植株形态进行变异植株初步筛选,结果表明,与对照相比,各处理组黄瓜植株高度、生长速度、叶片大小和形态均出现不同程度的变异现象,如植株矮小、叶色变深、叶片褶皱等(图1-A和1-B)。
气孔的巨大性是多倍体植株在解剖水平的重要表现,也是初步筛选和鉴定多倍体的重要标准。筛选出气孔面积明显增大、气孔密度减少的候选变异植株(图1-C和1-D),并对其进行进一步鉴定。
2.2.2 DNA相对含量鉴定和细胞学鉴定
利用流式细胞仪对候选变异植株进行进一步倍性确定。研究发现,二倍体欧洲温室型黄瓜相对荧光强度为50(图2-A),候选变异植株的相对荧光强度为100(图2-B)、75(图2-C)等。
采用常规染色体压片、染色体计数技术,对变异植株染色体数目进行进一步确定。结果表明,二倍体黄瓜染色体为2n=2x=14(图2-D),变异植株染色体为2n=4x=28(图2-E)、2n=4x=26(图2-F)。经鉴定,共获得欧洲温室型黄瓜同源四倍体新种质4个、非整倍体新种质1个。
2.3 二倍体与同源四倍体欧洲温室型黄瓜比较
2.3.1 植株形态比较
二倍体与同源四倍体黄瓜差异显著性分析表明,子叶节长和株高达到极显著差异,子叶节粗差异显著(表2)。与二倍体相比,同源四倍体黄瓜的子叶大小、叶片大小呈极显著增大,此外,同源四倍体黄瓜的叶片颜色加深、叶片厚度增加、叶片表面褶皱。
同源四倍体黄瓜与二倍体相比,除雌花子房长差异不显著外,雄花和雌花花冠大小、花瓣大小均明显增大,花期子房直径和果柄长均达到极显著差异,且花冠褶皱程度高(表3、图3)。
2.3.2 显微特征比较
由表4可知,与二倍体相比,同源四倍体欧洲温室型黄瓜叶片下表皮气孔保卫细胞大小、单位面积叶绿体数量均呈现极显著增加,分别为二倍体的1.52、203倍;气孔密度极显著减少,为二倍体的0.34倍。二倍体黄瓜花粉为三孔型(图4-A和4-C),同源四倍体花粉除正常三孔型外,还出现四孔型、五孔型花粉(图4-B、4-D和4-E),且败育花粉比率较高,达70%以上(图4-F)。
2.3.3 果实形态与品质比较
在果实形态与品质特征方面,与二倍体亲本相比,同源四倍体黄瓜果实长度、直径、中心腔直径、果肉厚、瓜把长等均较小,但含糖量显著提高(表5)。
3 讨论与结论
人工诱导多倍体是植物育种的一个重要手段,也是创制新种质的重要途径。陈劲枫等对采用不同浓度秋水仙素溶液浸泡干种子的方法获得黄瓜同源四倍体,发现4 g/L秋水仙素浸萌动种子4 h的染色体加倍率可达26.7%[6]。本研究采用秋水仙素处理幼苗生长点的方法,发现以2、3 g/L 秋水仙素处理5次诱导效果较好。低浓度处理次数较少时,成苗率较高,而在较高浓度处理次数较多时,成苗率降低,这与孔素萍等的研究结果[19]相一致。在本研究中,黄瓜幼苗的死亡率与秋水仙素处理时间和浓度呈正相关。
二倍体与同源四倍体植株在形态学、生理学、细胞学等方面均存在较大差异,研究表明,同源四倍体植株叶片气孔大小、花粉粒大小、雌雄花大小、叶片大小与厚度、保卫细胞内叶绿体数量等均高于二倍体亲本,而植株高度、气孔密度均低于二倍体亲本[13,20]。本研究中二倍体亲本黄瓜通过秋水仙素诱变后,在形态学、解剖学、细胞学等方面均表现出不同程度的畸形现象。首先利用诱变植株的形态学特征、气孔特征进行变异植株初步筛选,再对候选植株进行DNA相对含量和染色体数目鉴定确定其倍性水平,极大程度提高了多倍体植株筛选的工作效率。
多倍体雄花和花粉直径均大于二倍体,而且花粉形态异常,萌发率低[21],多倍化容易导致植物育性降低[22-24]。陈劲枫等发现,四倍体花粉粒大小不一,每一朵花中平均有2.3%的4孔花粉粒[6]。Diao等发现,四倍体植株自交后代在细胞遗传水平上较稳定,但二倍体与同源四倍体黄瓜育性上存在较大差异[25]。本研究发现,变异植株花粉出现四孔型、五孔型等形态变异类型,且同源四倍体黄瓜花粉有较高比率的败育现象,可能是导致自交授粉后单瓜结籽率低的主要原因。本研究为黄瓜遗传育种提供了新种质,为双子叶植物多倍体育种提供了技术支持。
參考文献:
[1]顾少涵,潘 俏,李子昂,等. 黄瓜耐低温突变体材料的筛选与鉴定[J]. 南京农业大学学报,2017,40(2):219-224.
[2]管 苇,张云霞,杨树琼,等. 黄瓜倍性材料创制及染色体组成的FISH鉴定[J]. 中国农业科学,2014,47(17):3513-3522.
[3]徐丽娟,周鸿章,张蜀宁,等. 优质、抗热同源四倍体不结球白菜的创制及鉴定[J]. 福建农业学报,2014,29(5):449-453.
[4]吕 炜,户秋稳,李艳艳,等. 优质四倍体萝卜新种质创新及鉴定[J]. 南京农业大学学报,2016,39(1):48-54.
[5]罗小金,贺浩华. 水稻多倍性育种研究进展[J]. 中国农学通报,2001,17(6):53-56.
[6]陈劲枫,雷 春,钱春桃,等. 黄瓜多倍体育种中同源四倍体的合成和鉴定[J]. 植物生理学通讯,2004,40(2):149-152.
[7]Blasco M,Luisa B M,Del M N M. Colchicine-induced polyploidy in loquat[Eriobotrya japonica (Thunb.) Lindl.][J]. Plant Cell Tissue and Organ Culture,2015,120(2):453-461.
[8]Amaral C,Silva S,Ledo C,et al. Agronomic characterization of autotetraploid banana plants derived from‘PisangLilin(AA)obtained through chromosome doubling[J]. Euphytica,2015,202(3):435-443.
[9]Xing S H,Guo X B,Wang Q,et al. Induction and flow cytometry identification of tetraploids from seed-derived explants through colchicine treatments in Catharanthus roseus (L.) G. Don[J]. Journal of Biomedicine & Biotechnology,2011(1):793198.
[10]李豆豆,刘芝龙,黄明忠,等. 鹤顶兰四倍体植株的诱导与鉴定[J]. 园艺学报,2013,40(10):2033-2038.
[11]Chen R,Jiang W Z,Li Q L,et al. Comparison of seven colchicine-induced tetraploid clones with their original diploid clones in purple coneflower(Echinacea purpurea L.)[J]. Euphytica,2016,207(2):387-399.
[12]王朝梁,陈中坚,孙玉琴,等. 秋水仙碱诱导三七多倍体的初步研究[J]. 中国中药杂志,2007,32(12):1222-1224.
[13]张海凤,郭宝林,张成合,等. 陈新华.杜仲四倍体的诱导与鉴定[J]. 园艺学报,2008,35(7):1047-1052.
[14]Madani H,Hosseini B,Dehghan E,et al. Enhanced production ofscopolamine in induced autotetraploid plants of HyoscyamusreticulatusL.[J]. ActaPhysiologiaePlantarum,2015,37(3):55.
[15]刁卫平,贾媛媛,江 彪,等. 黄瓜未授粉子房培养获得同源四倍体[J]. 园艺学报,2008,35(12):1781-1786.
[16]鄢郁霖,王小蓉,唐海东,等. 秋水仙素处理对黄瓜生长发育及诱变效应研究[J]. 长江蔬菜,2010(6):8-11.
[17]刘永月,许建鹏,李田田,等. 无毛黄瓜同源四倍体诱导及鉴定[J]. 山东农业科学,2016,48(11):21-25.
[18]郑金双,张蜀宁,孙成振,等. 二倍体及同源四倍体不结球白菜核型分析[J]. 南京农业大学学报,2012,35(1):131-134.
[19]孔素萍,段乃彬,刘冰江,等. 不同诱变剂对大蒜四倍体诱导的影响[J]. 核农学报,2016,30(6):1067-1073.
[20]Abdoli M,Moieni A,Badi H N. Morphological,physiological,cytological and phytochemical studies in diploid and colchicine-induced tetraploid plants of Echinacea purpurea (L.)[J]. ActaPhysiologiaePlantarum,2013,35(7):2075-2083.
[21]Lin L,Yao Q C,Xu H W,et al. Characteristics of the staminate flower and pollen from autotetraploid Betulaplatyphylla[J]. Dendrobiology,2013,69(1):3-11.
[22]轩淑欣,罗双霞,张成合,等. 同源四倍体结球甘蓝胚胎发育和结实性研究[J]. 河北农业大学学报,2009,32(1):14-18.
[23]刘富强,张巍巍,蔡丽静,等. 大白菜DH系同源四倍体的获得及其细胞学研究[J]. 河北农业大学学报,2013,36(5):24-28.
[24]张巍巍,刘富强,轩淑欣,等. 四倍体黑芥的获得与鉴定[J]. 园艺学报,2015,42(12):2505-2511.
[25]Diao W P,Bao S Y,Jiang B,et al. Primary trisomics obtained from autotriploid by diploid reciprocal crosses in cucumber[J]. Sexual Plant Reproduction,2009,22(1):45-51.
