Mg2+调控低温环境下单水方解石的合成
2019-11-28施翰林李明慧刘迎新朱立平
施翰林,李明慧,刘迎新,朱立平
(1. 中国科学院青藏高原研究所, 北京 100101; 2. 中国地质大学(北京) 珠宝学院, 北京 100083; 3. 青藏高原地球科学卓越创新中心, 北京 100101)
碳酸钙矿物在自然界中分布广泛,可存在于各种生物和非生物环境中。已知碳酸钙有6种矿物相:方解石、文石、球霰石、单水方解石(MHC)(CaCO3·H2O)、六水方解石(CaCO3·6 H2O)及无定形碳酸钙。其中方解石、文石、球霰石为无水相,单水方解石、六水方解石及无定形碳酸钙为含水相。单水方解石作为一种热力学亚稳定相,不易保存,很容易转化为热力学相对更稳定的文石和方解石(Hull and Turnbull, 1973; Taylor, 1975; Munemoto and Fukushi, 2008; Kimura and Koga, 2011; Chaka, 2018)。因此,它的形成和赋存吸引了众多学者的研究。目前自然环境中的单水方解石主要出现在湖泊沉积物、洞穴堆积物以及极地海洋环境中(Stoffers and Fischbeck, 1974; Taylor, 1975; Last and Deckker, 1990; Bischoffetal., 1991; Dahl and Buchardt, 2006; Zhouetal., 2007; Howie and Ealey, 2011; Lietal., 2012; López-Martínezetal., 2016; Bazarovaetal., 2018)。由于单水方解石在地质环境中的罕见性,它的出现可能指示该区域的环境变化。因此,探究环境中单水方解石的成因具有重要意义。

1 材料与方法
1.1 试剂
无水氯化钙(CaCl2,AR,上海国药)、氯化镁(MgCl2·6 H2O,AR,上海国药)、氯化钾(KCl,AR,上海国药)、氯化钠(NaCl,AR,上海国药)、无水碳酸钠(Na2CO3,AR,上海国药),实验用水为超纯水。
1.2 实验方法
首先配制不同Mg/Ca摩尔比的混合溶液(表1),其中Mg2+浓度为0~0.5 M,Ca2+浓度为0.05 M。向混合溶液中加入11.5g NaCl、1g KCl搅拌至完全溶解,然后将溶液转移至反应容器中,加入Na2CO3固体1.0 g,快速搅拌2 min后密封反应容器,放置于4℃恒温箱中静置反应一段时间。使用真空抽滤装置对不同时间的反应溶液进行抽滤,将滤膜上的固体干燥并保存在冰箱中。在进行实验之前,将实验中使用的超纯水放入4℃冰箱中保存24 h,以减少误差。
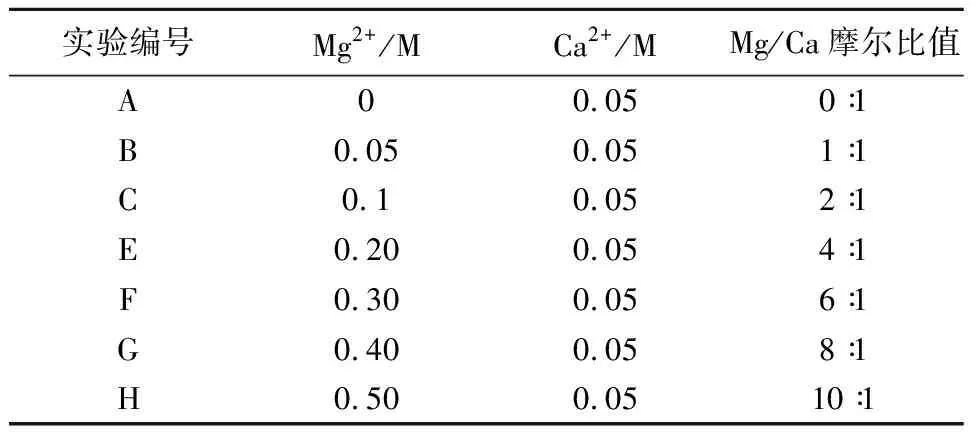
表 1 初始反应溶液的主要组成Table 1 The primary composition of the initial reaction solution
1.3 测试方法
傅里叶变换红外光谱(FTIR)分析:取1 mg沉淀物样品和150 mg溴化钾(KBr)于玛瑙研钵中,在红外灯下研磨至二者均匀混合,使用压片机制片。使用德国BRUKER TENSOR 27型傅里叶变换红外光仪,采用透射法对样品进行分析,扫描温度为室温,扫描范围4 000~400 cm-1,分辨率为4 cm-1。该测试在中国地质大学(北京)珠宝学院珠宝鉴定实验室完成。
X射线粉晶衍射(XRD)分析:使用日本理学Smart Lab(9KW)型X射线粉晶衍射仪对样品进行分析。辐射波长为1.540 6 Å(Cu-Kα1); DS=SS=(2/3)°,RS=0.3 mm;电流200 mA,电压40 kV;扫描范围10°~70°,扫描速度为10°/min。该测试在中国地质大学(北京)科学研究院实验中心完成。
电感耦合等离子体发射光谱(ICP-OES)分析:取30 mg沉淀物样品,溶于1%硝酸溶液中,使用美国LeemanLabs公司 Prodigy-H型电感耦合等离子体发射光谱仪对样品中Mg2+、Ca2+的浓度进行,测定误差小于5%。该测试在中国科学院青藏高原研究所大陆碰撞与高原隆升重点实验室完成。
2 结果与分析
2.1 沉淀物的XRD分析
对照组Mg/Ca=0,即反应溶液中不含Mg2+时,当Na2CO3加入后,溶液迅速变成白色混浊状,并且有白色沉淀产生。XRD测试结果(图1)证明沉淀物均为方解石(JCPDS 05-0586)。随着反应时间的继续延长,XRD图谱中未出现新矿物相的衍射峰。因此,在不添加Mg2+的溶液中,方解石为唯一结晶相。
Mg/Ca=1的反应中,XRD图谱中只有一种矿物相的衍射峰(图2a),相比于无Mg2+添加的方解石的衍射图谱,该图谱中所有的衍射峰均变得宽化且向高角度略微偏移。例如,图1中不添加Mg2+的方解石(104)晶面的2θ值为29.285°,而图2中方解石的(104)晶面2θ值增加到了29.713°。Lenders等(2012)等证明方解石的XRD图谱随着晶格中Mg2+的进入而发生变化,即所有的衍射峰向着高角度发生略微偏移。因此,Mg/Ca=1的反应沉淀物为镁方解石(JCPDS 43-0697)。反应240 h后,XRD图谱的衍射峰仍然为镁方解石,无其他结晶相生成。

图 1 Mg/Ca=0不同反应时间沉淀物的XRD图Fig.1 XRD patterns of the precipitates in different reaction time spans at Mg/Ca=0
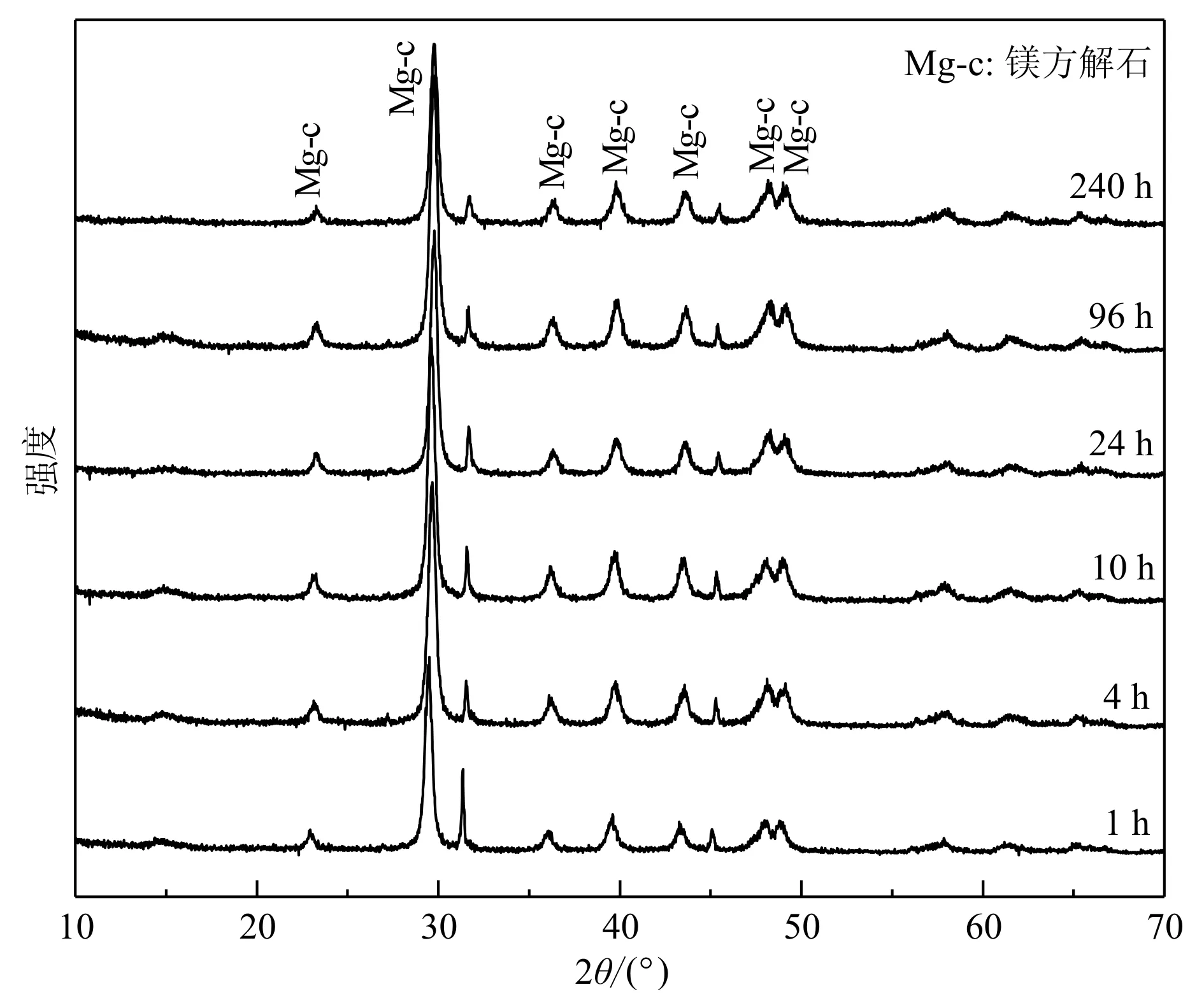
图 2 Mg/Ca=1不同反应时间沉淀物的XRD图Fig. 2 XRD patterns of the precipitates in different reaction time spans at Mg/Ca=1
对Mg/Ca=2的反应沉淀物进行XRD测试,衍射图谱中出现了新矿物相的衍射峰(图3)。反应1 h的沉淀物经过XRD分析,与单水方解石矿物晶体的XRD衍射峰一致(JCPDS 29-0306)。当反应进行到14 h时,XRD谱图中出现了文石(JCPDS 41-1475)和镁方解石衍射峰(JCPDS 43-0697),而单水方解石的衍射峰相比逐渐减弱,并且在反应48 h后完全消失,而文石的衍射峰在14 h时开始出现,并随着反应时间的增加逐渐增强。另外,由于溶液的饱和状态,从XRD分析结果显示,反应沉淀物中还有少量氯化钠结晶相析出。
Mg/Ca=4的溶液反应2 h后,XRD谱图未检测出任何衍射峰(图4),谱图基本为一条直线,仅在2θ=30°左右有一略微隆起的馒头包,该谱图与文献报道的无定形碳酸钙(ACC)衍射峰一致(Losteetal., 2003; Nishiyamaetal., 2013),是一种非晶相物质。

图 3 Mg/Ca=2不同反应时间沉淀物的XRD图Fig. 3 XRD patterns of the precipitates in different reaction time spans at Mg/Ca=2
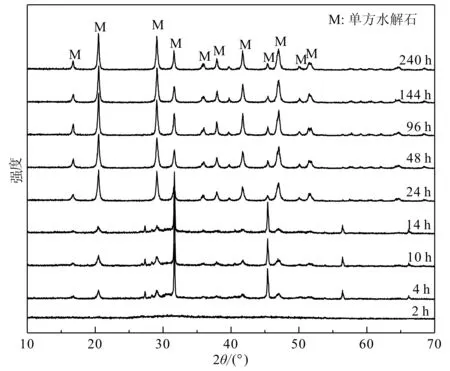
图 4 Mg/Ca=4不同反应时间沉淀物的XRD图Fig. 4 XRD patterns of the precipitates in different reaction time spans at Mg/Ca=4
反应4 h时,XRD衍射图谱出现了非常弱的单水方解石的衍射峰,且峰型较为宽化,可能是由于MHC晶粒过小导致。随着反应时间的增长,单水方解石的衍射峰越来越强,且越来越尖锐,表明单水方解石的晶粒越来越大,且含量也越来越多。当反应240 h后,XRD谱图中除了单水方解石的衍射峰之外仍然没有发现其他矿物相的衍射峰,表明此阶段生成物为单水方解石纯相。
类似的结果也出现在Mg/Ca=6的反应中,如图5a所示,反应24 h沉淀物的XRD图谱中开始出现微弱的单水方解石衍射峰,峰形宽化可能是由于MHC的晶粒过于细小所致。反应至96 h后,根据XRD图谱的强度以及峰的尖锐度,证明反应体系中的单水方解石逐渐增多,并且晶粒在逐渐增大。Mg/Ca=8的反应中,XRD测试结果如图5b,反应24 h的沉淀物中检测不到任何衍射峰,表明该阶段的沉淀物仍然为ACC。继续反应至48 h,沉淀物的XRD谱图开始出现单水方解石的衍射峰,随着反应时间的增加,衍射图谱中单水方解石的峰值也越来越强,且一直持续到240 h。在Mg/Ca=10的反应中,单水方解石的衍射峰在反应96 h的沉淀物中开始出现(图5c)。XRD谱图中其衍射峰的强度较弱,且峰形宽化,说明此阶段单水方解石可能刚开始形成,晶粒较小且含量也较少。当反应240 h后,沉淀物物的衍射峰仍然与单水方解石的衍射峰一致,未出现其他矿物相。综上所述,单水方解石在溶液中的出现时间随着溶液中Mg/Ca比的增加而延迟,说明Mg2+影响了溶液中单水方解石的成核和生长过程,具体机理需要进一步讨论。

图 5 Mg /Ca=6(a),Mg/Ca=8(b),Mg/Ca=10(c)的不同反应时间沉淀物XRD图Fig. 5 XRD patterns of the precipitates in different reaction time spans with Mg/Ca ratios of 6 (a), 8 (b), 10 (c)
2.2 沉淀物的FTIR分析
对不同反应条件下的沉淀物进行FTIR分析,图6为部分典型沉淀物的FTIR分析结果。图6a中714、876、1 420 cm-1处出现峰值,分别对应于方解石的ν4、ν2、ν3振动峰,与文献中方解石FTIR峰值一致(Losteetal., 2003)。图6b中,717、874、1 423 cm-1出现吸收峰,可以归于镁方解石的ν4、ν2、ν3振动峰。已有研究证明Mg2+替代晶格中部分Ca2+会增加方解石结构的无序性,在1 084 cm-1(ν1)和1 801 cm-1处产生弱的吸收峰,并且方解石的ν4(712 cm-1)振动峰由于Mg2+的增多向更高的波数移动(Losteetal., 2003)。本研究中的FTIR谱图在1 085 cm-1和1 801 cm-1处均有弱的吸收峰,并且与图6a相比714 cm-1处峰值迁移至717 cm-1处,与文献所记录的镁方解石FTIR特征图谱一致。图6c为Mg/Ca=2的反应沉淀物的谱线,其中的分裂峰701/712 cm-1,以及854、1 082、1 473 cm-1分别对应文石的ν4、ν2、ν1、ν3振动峰(Zhouetal., 2004);712、874 cm-1为镁方解石的ν4、ν2振动峰,此结果与XRD的测试结果一致。图6d为单水方解石的特征谱线,图中700、872、1 068 cm-1以及1 413/1 487 cm-1分别为单水方解石的ν4、ν2、ν1、ν3振动峰,而强宽峰590、766 cm-1为单水方解石的晶格振动峰(Effenberger, 1981; Shahack-Grossetal., 2003; Neumann and Epple, 2007)。图6e为无定形碳酸钙的红外谱线,由于XRD对于非晶物质的检测并不太灵敏,而FTIR却能更好的表征该物质,使实验结果的分析更加准确。谱线中865、1 080 cm-1以及1 452/1 477 cm-1为无定形碳酸钙的ν2、ν1、ν3振动峰,1 644 cm-1为无定形碳酸钙中的水分子振动峰(Losteetal., 2003; Demenyetal., 2016; Konradetal., 2018)。

图 6 不同反应条件下部分沉淀物的FTIR图Fig. 6 FTIR spectra of partial precipitates under different reaction conditions
2.3 沉淀物中Ca2+和Mg2+的含量变化
将不同反应条件下的沉淀物使用ICP-OES分析,在所有实验的沉淀物中,Ca2+的含量随着反应时间的增加而增加,Mg2+的含量随着反应时间的增加而减少(图7a、7b)。 反应240 h后沉淀物中Ca2+离子最高含量为98%左右,最低约为88%。由图7a可知,随着反应溶液中Mg/Ca摩尔比值的增加,初始沉淀物中的Ca2+含量也逐渐减少,在Mg/Ca=1时,反应1 h的沉淀物中的Ca2+含量约为87%,Mg/Ca=2反应1h的沉淀物中的Ca2+含量约为76%,Mg/Ca=4时,反应1 h沉淀物中Ca2+含量仅为49%。另外,随着反应液中Mg/Ca比的增加,沉淀物中Ca2+含量达到稳定的时间也逐渐增加,在Mg/Ca=1的反应中, 沉淀物中Ca2+含量基本不变(89%),Mg/Ca=2的反应沉淀物中的Ca2+含量在反应24 h左右稳定(90%),Mg/Ca=4的反应沉淀物中的Ca2+含量在反应30 h左右稳定(94%),Mg/Ca=6的反应沉淀物中的Ca2+含量在反应110 h左右稳定(95%),Mg/Ca=8的反应与Mg/Ca=6时类似,而在Mg/Ca=10的反应中,由于反应时间的原因,直至反应时间结束仍未能观察到稳定趋势。
图7b沉淀物中Mg2+含量变化与Ca2+含量变化相反,即沉淀物中Mg2+含量随着反应时间的增加而减少。反应240 h后,沉淀物中Mg2+含量最高约为10%,最低约为3%。由图可知,随着反应溶液中Mg/Ca的增加,初始沉淀物中Mg2+含量也逐渐增加。Mg/Ca=1时,初始沉淀物中Mg2+含量约为13%,Mg/Ca=2时,出时沉淀物中Mg2+含量约为24%,Mg/Ca=4时初始沉淀物中Mg2+含量达到了50%左右。另外,与Ca2+变化相似,随着反应的进行,沉淀物中的Mg2+含量也逐渐稳定。并且,除了Mg/Ca=1的实验,其他条件反应之后沉淀物中的Mg2+含量约为5%。

图 7 沉淀物中Mg2+和Ca2+的含量随时间变化曲线Fig. 7 The curve of Mg2+ and Ca2+ content in precipitates with time
综上所述,在各组反应的沉淀物中均有Mg2+存在,说明Mg2+参与了反应,并进入了沉淀物的结构中。但是,随着反应的进行,Mg2+却逐渐从沉淀物中释放。因此,Mg2+可能对反应过程中沉淀物的成核和生长过程产生了影响。
3 讨论
3.1 单水方解石的形成过程
本实验在4℃条件下,通过调控反应溶液中的Mg/Ca摩尔比,成功合成了单水方解石,并且单水方解石能够在Mg/Ca>2的溶液中稳定240 h而不向其他矿物相转变。根据实验结果(图4,图5a、5b),在Mg/Ca>2的反应中,单水方解石形成之前存在一种无定形碳酸钙(ACC)矿物相,XRD测试结果显示没有任何衍射峰存在,证明该物质为非晶态。FTIR分析在865、1 080 cm-1及1 452/1 477 cm-1处有吸收峰,与文献报道的ACC的特征峰值一致。对于ACC,许多研究在反应初期都发现此物质,认为它是合成一些碳酸钙矿物相的前驱体,可以通过控制溶液的化学组成、pH值等条件,使其转化为目标产物(Losteetal., 2003; Nishiyamaetal., 2013; Rodriguez-Blancoetal., 2014; Blueetal., 2017; Purgstalleretal., 2017; Chaka, 2018; Fukushi and Matsumiya, 2018; Konradetal., 2018; Zhangetal., 2018)。例如Purgstaller等(2017)通过改变溶液中Mg2+/Ca2+的活度比使其转化为镁方解石;Blue等(2017)在研究物理和化学因素控制ACC转化过程时,通过调整溶液的pH值使ACC转化为单水方解石和文石。在Mg/Ca=2的反应中,单水方解石在反应1 h后生成,之前未发现无定形碳酸钙。原因可能归因于实验过程中并未对该反应1 h之前的沉淀物进行取样测试,导致未发现该矿物的生成。本实验过程中,随着反应的进行ACC逐渐消失,单水方解石出现,说明单水方解石是由ACC转化而来。另外,沉淀物中Mg2+含量逐渐减少(图7b)说明随着反应的进行,ACC逐渐溶解并向溶液中释放Mg2+,之后其它碳酸盐矿物相开始成核结晶。即单水方解石的形成是一种溶解再沉淀过程,而不是直接的固态相变过程。
3.2 Mg2+的作用
关于单水方解石的实验室合成过程,已有相关报道(Losteetal., 2003; Kimura and Koga, 2011; Nishiyamaetal., 2013; Rodriguez-Blancoetal.,2014; Blueetal., 2017; Fukushi and Matsumiya, 2018)。本实验中,Mg/Ca<2和不含Mg2+时,反应后的沉淀物未出现单水方解石 (图1和图2), Mg/Ca=2和>2的实验中单水方解石开始出现(图3,图4,图5a~5c),说明单水方解石的形成需要Mg2+参与。根据实验结果,图8总结了单水方解石的形成条件与初始溶液中Ca2+和Mg2+浓度的关系。根据已有的研究和本实验的结果,单水方解石的形成在比较广泛的Mg2+含量范围,且单水方解石的形成过程中Mg2+是必不可少的因素。
自然环境中,单水方解石大多形成于Mg/Ca很高的体系中(表2)。例如,格陵兰岛伊卡峡湾(Mg/Ca>5)的石灰岩柱中(Dahl and Buchardt, 2006),澳大利亚Fellmongery(Mg/Ca>20)湖岸滩岩石中,加拿大Manito湖(Mg/Ca>40)的湖泊沉积物中以及西藏纳木错(Mg/Ca>10)湖泊沉积物中。与实验室合成单水方解石的条件相比,这些自然环境下单水方解石形成体系中的Mg/Ca比远高于实验室模拟条件。所以,Mg/Ca比的高低并不是该矿物形成的决定因素。此外,由图8和表2可知,形成单水方解石体系中的Mg2+含量却远高于Ca2+,说明单水方解石的形成取决于体系中Mg2+含量。

图 8 单水方解石的分布与初始溶液中Mg2+和Ca2+浓度的关系Fig. 8 Distribution of the MHC as a function of the Ca2+ and Mg2+ concentration in the initial solution

Mg/mmol·L-1Ca/mmol·L-1Mg/Ca摩尔比值Ikka Fjord(伊卡峡湾)(Buchardt et al., 2001)45.708.835Fellmongery(费尔蒙戈里湖)(Taylor, 1975)68.002.0034Nam Co(纳木错)(Li et al., 2008)1.800.1611Manito(曼尼托湖)(Last et al., 2010)17.000.2664

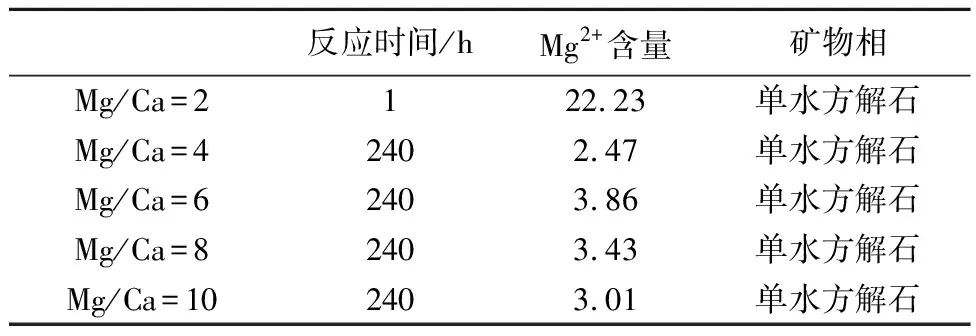
表 3 不同条件下形成的单水方解石中Mg2+的含量 xB/%Table 3 Mg content of MHC formed in different conditions
4 结论
(1) 低温(4℃)、Mg/Ca摩尔比>2时,单水方解石可在溶液中形成。单水方解石(MHC)的形成过程是无定形碳酸钙(ACC)的溶解再沉淀过程,而不是直接的固态相变。
(2) 单水方解石的形成过程受Mg2+调控,Mg2+的作用是阻碍单水方解石的脱水,溶液中Mg2+含量越多,单水方解石的存在时间越长。Mg2+也会抑制方解石的成核,有利于单水方解石的成核与生长。
(3) 本研究为纳木错单水方解石的无机成因提供了可能的理论依据。但是,纳木错湖泊的水体环境中还存在许多微生物,如细菌、蓝藻和绿藻等,它们对单水方解石的成核及生长过程的影响还需要进一步研究和讨论。
