花生新黑地珠蚧发生为害及其系统发育
2019-11-27李绍建王娜崔小伟
李绍建 王娜 崔小伟


摘要 本文以花生地下害虫花生新黑地珠蚧为研究对象,对其田间危害及虫体发育情况进行了调查,并利用分子生物学技术对其进行系统发育研究。田间调查结果表明,花生新黑地珠蚧在河南省一年发生一代,多发生于沙壤土,主要以珠体状的2龄若虫为害花生根部;雌雄珠体数量及大小差异均较大,单株花生上为害的雌珠体数17~78头,雄珠体数59~146头,雌雄珠体性比为1.00∶2.61,雌雄珠体直径分别为4.72~7.26 mm和1.83~2.65 mm。通过系统发育分析和传统形态学分类的综合分析表明本研究中所采集害虫为花生新黑地珠蚧,隶属于半翅目蚧总科珠蚧科。
关键词 花生新黑地珠蚧; 田间为害; 虫体发育; 系统发育分析; 珠蚧科
中图分类号: S 435.652 文献标识码: A DOI: 10.16688/j.zwbh.2018400
Abstract This study aims to investigate the field hazard and development of Neomargarodes gossypii, and reconstruct the phylogenetic relationship among different families. Field survey indicated that N.gossypii occurred one generation per year in Henan province which fed on the roots of peanut by its pearl shaped 2nd-instar nymph, and preferred sandy soil habitats. There were large differences on the amount and size between female and male pearl. The amount of female and male pearl per peanut was 17~78 and 59~146, respectively and the sex ratio was 1.00∶2.61. The diameters of female and male pearl were 4.72~7.26 mm and 1.83~2.65 mm, respectively. Through comprehensive analysis of phylogenetic tree and morphological classification, the samples collected in Henan peanut fields were identified as N.gossypii that belongs to Margarodidae (Hemiptera: Coccoidea).
Key words Neomargarodes gossypii; field hazard; development; phylogenetic analysis; Margarodidae
花生新黑地珠蚧Neomargarodes gossypii Yang,屬半翅目Hemiptera蚧总科Coccoidea珠蚧科Margarodidae[1],在我国华中、华东、华北及西北地区均有发生,是一种严重为害花生的地下害虫[2-5]。该虫主要以2龄若虫聚集在花生根部刺吸根系汁液为害,导致根系衰弱,侧根减少,进而花生生长不良,结果少而瘪或不结果,严重影响花生产量和品质[6]。据调查,一般田块可造成花生减产20%~30%,严重田块可达50%以上,甚至绝收[7]。近年来,花生新黑地珠蚧的为害越来越严重,已成为制约我国花生产业发展的重大阻碍。
新黑地珠蚧又名乌黑新珠蚧,其最早于1912年由英国学者Green作为新种以Margarodes niger的拉丁学名发表,并将其归类至珠蚧属Margarodes下,1928年Morrison将该虫归类至新珠蚧属Neomargarodes下,并沿用拉丁文种名niger[8]。我国学者侯璋德等首次将为害我国花生的珠蚧定为乌黑新珠蚧Neomargarodes niger (Green)[9],随后此名称被多名学者沿用。1979年,杨集昆先生通过对各地为害花生的新珠蚧标本进行对比鉴定,确定为害我国棉花、豆类等作物的新珠蚧是新种,应为棉根新珠蚧Neomargarodes gossypii Yang,随后的研究发现,该珠蚧主要为害豆科植物且能完成生活史,却不能在棉花上完成生活史,因此建议将其中文名改为花生新珠蚧[1]。目前,国内学者习惯将其称之为花生新黑地珠蚧[4-5]。
截至目前,国内学者对花生新黑地珠蚧的研究相对较少,且主要集中于对其生物学特性及防治方法的研究,未见其系统发育的相关报道,国外更是鲜有关于花生新黑地珠蚧的相关研究。为了更好地了解花生新黑地珠蚧的发生为害及其系统发育,我们对其田间危害及虫体发育情况进行了调查并利用分子生物学技术对其进行系统发育分析,现将结果报道如下。
1 材料与方法
1.1 田间调查
选取有花生新黑地珠蚧发生的田块,调查其为害花生的症状及花生受害情况,同时定期调查花生各发育期及收获期后田间花生新黑地珠蚧的发生发展情况。
1.2 样本采集
于田间花生新黑地珠蚧高发期,在河南省开封市和濮阳市分别选取受害严重的地块采集花生新黑地珠蚧珠体,分地域标记记录后带回室内。
1.3 花生新黑地珠蚧基因组DNA提取
将田间采集的花生新黑地珠蚧珠体放入玻璃培养皿中,置于28℃的恒温培养箱中避光培养,15 d左右后雌珠体可羽化出成虫; 收集单头雌成虫于灭菌1.5 mL PE离心管内,每管加入3 μL STE (0.1 mol/L NaCl; 10 mmol/L Tris-Cl,pH 8.0; 1 mmol/L EDTA,pH 8.0)裂解液及灭菌小玻璃珠若干,于Bullet Blender STORM研磨仪(Next Advance)上研磨至匀浆,每管补足裂解液至30 μL并加入0.2~0.3 μL蛋白酶K,56℃恒温水浴裂解2~3 h,然后95℃水浴10 min灭活蛋白酶K,短暂离心,吸取每管内DNA溶液于新的灭菌1.5 mL PE离心管,分别标记后置于-20℃冰箱保存备用。
1.4 花生新黑地珠蚧序列扩增及测定
花生新黑地珠蚧的序列扩增选取核糖体小亚基(18S)基因[10]、核糖体大亚基(28S)基因的D2和D10扩展区域[11-12]以及蛋白编码延伸因子1α(EF-1α)基因[13],各序列扩增引物信息见表1。
PCR反应体系为25 μL,其中2×Taq PCR Master Mix 12 μL,ddH2O 10 μL,上、下游引物各1 μL(10 μmol/L),模板DNA 1 μL。扩增程序为: 94℃预变性4 min; 94℃变性45 s,57℃(18S)/56℃(28S-D2)/62℃(28S-D10)/55℃(EF-1α)退火30 s,72℃ 延伸1 min,30个循环; 72℃延伸5 min,4℃保存。取4 μL PCR擴增产物,在1%琼脂糖凝胶上电泳检测,将含有目的片段的PCR扩增产物送生工生物工程(上海)股份有限公司进行测序。
2 结果与分析
2.1 花生新黑地珠蚧田间为害
花生新黑地珠蚧喜干燥疏松的沙土或沙壤土,在黄壤土、黏壤土中发生较轻或不发生。该虫主要以1~2龄若虫聚集在花生根部,大量刺吸花生汁液,造成花生主根发黑,侧根减少,甚至腐烂,植株严重矮化,叶片自下而上褪绿发黄甚至整株花生干枯死亡,花生结果少而瘪,甚至不结果。将受害花生植株连根拔起,可见大量2龄珠体吸附于根部,花生新黑地珠蚧在田间常成片发生,且为害严重(图1a,图1b)。
2.2 花生新黑地珠蚧虫体发育循环
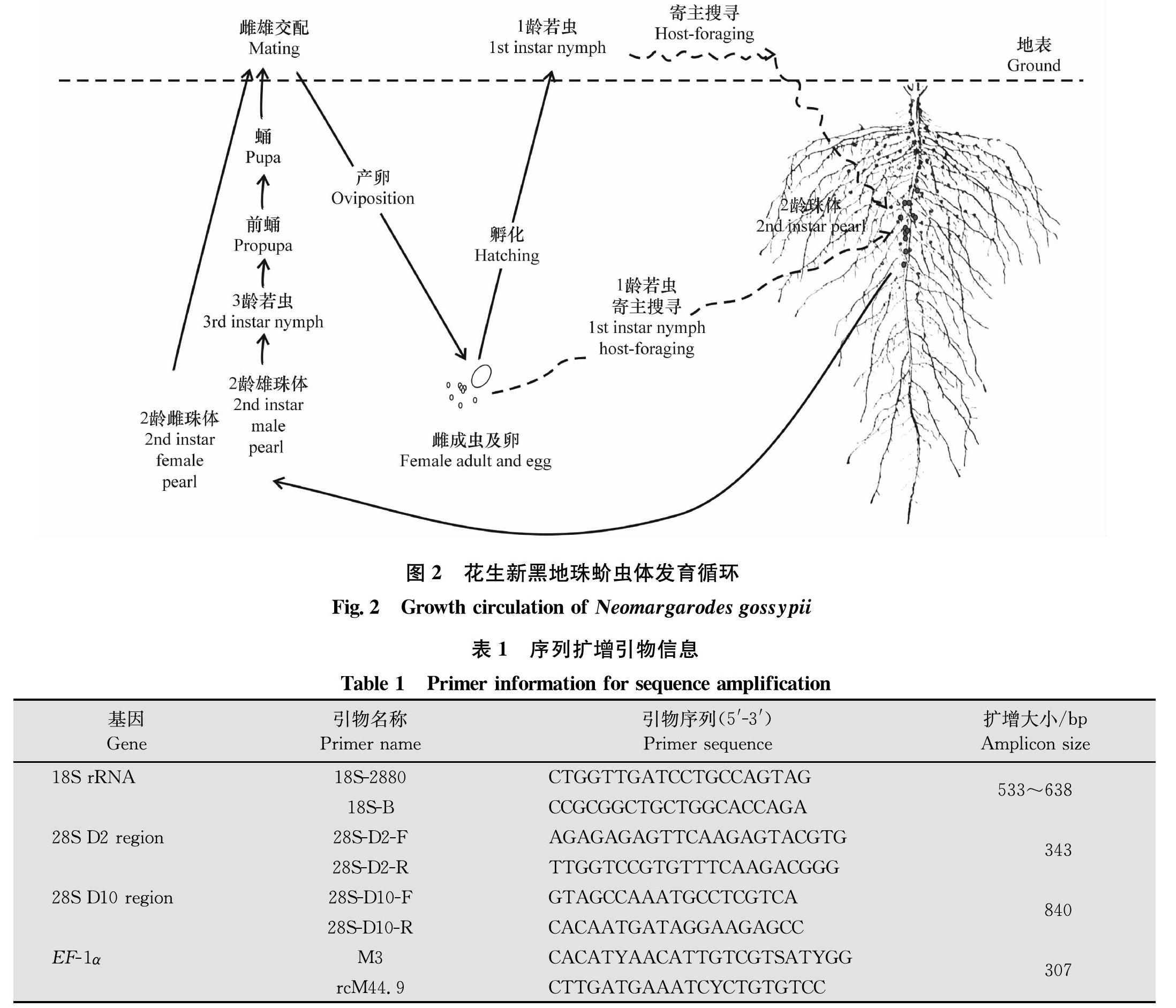
通过对花生新黑地珠蚧在花生各发育期及收获期后的定期调查发现,花生新黑地珠蚧在河南省各发生地区均1年发生1代,以2龄若虫在花生主根层土壤中越冬,2龄若虫珠体状,分深褐色和黑色两种:大的为雌性,小的为雄性。4月初至5月下旬,2龄雄珠体先蜕壳变为3龄若虫,然后变为前蛹,再变为蛹,4月底至6月上旬蛹羽化变为雄成虫爬出地面。2龄雌珠体于4月底至6月初蜕壳变为雌成虫,爬上地面与雄成虫交配产卵。5月中下旬至6月中下旬,卵孵化成为1龄若虫,1龄若虫部分爬出地面寻找花生寄主,部分直接在土壤中寻找花生根部,进而取食花生根部汁液,于7月上旬至8月下旬发育为大小不同的雌雄2龄珠体,聚集吸附在花生根部为害(图1a,图2)。
花生新黑地珠蚧雌成虫交配后即爬回地下产卵,卵块多分布于距地表10 cm左右,每个卵块中卵粒数从110粒到1 058粒不等,单株花生根上为害的花生新黑地珠蚧雌珠体数17~78头,雄珠体数59~146头,花生新黑地珠蚧卵及珠体数量详见表2。同一株花生根部为害的花生新黑地珠蚧雄珠体数量明显多于雌珠体数量,雌雄性比平均为1.00∶2.61。2龄雌雄珠体大小相差较大,雌珠体直径4.72~7.26 mm,平均6.27 mm,雄珠体直径1.83~2.65 mm,平均2.30 mm(表3)。
2.3 花生新黑地珠蚧系统发育
本研究中所测河南省开封(KF)和濮阳(PY)的花生新黑地珠蚧18S、28S-D2、28S-D10和EF-1α基因序列分别上传到GenBank数据库并获得登录号:开封的花生新黑地珠蚧18S、28S-D2、28S-D10和EF-1α的GenBank登录号分别为MH051908、MH133216、MH133218和MH230870; 濮阳的花生新黑地珠蚧18S、28S-D2、28S-D10和EF-1α的GenBank登录号分别为MH051909、MH133217、MH133219和MH230871。
为更加准确地分析花生新黑地珠蚧的系统发育,将所测得的两个地区花生新黑地珠蚧的18S、28S-D2、28S-D10和EF-1α的序列分别用Geneious软件(11.1.4)进行串接。同时,利用GenBank数据库中蚧总科内其他科属的串接序列,以粉蚧科Pseudococcidae为外群,利用MEGA 6.0软件[14],采用Kimura 2-parameter距离模型[15],邻接法(neighbor-joining)构建系统发育树,系统树各分支置信度(bootstrap)均进行1 000次重复检验(图3),构建系统发育树的其他不同物种序列GenBank登录信息见表4。从图3的系统发育树可以看出,采自河南省开封(KF)和濮阳(PY)的两个珠蚧种群与红珠蚧Eumargarodes laingi聚为一支(bootstrap值=1 000),同属于珠蚧科Margarodidae。
3 结论与讨论
本研究通过对花生新黑地珠蚧的田间发生为害调查,已基本摸清该虫在田间的为害时期、为害特征、虫体发育循环等特性。花生新黑地珠蚧主要在河南省境内黄河故道及黄泛区区域内的沙土及沙壤土中发生为害,这与马铁山等关于花生新黑地珠蚧主要发生在沙质土壤,在黏土和壤土中未见有发生的调查结果一致[16]。花生新黑地珠蚧雌成虫需钻入土中产卵,卵孵化出的1龄若虫需钻出地面找寻花生寄主并钻入地下取食为害花生根部,沙土或沙壤土土质疏松的特性有利于花生新黑地珠蚧成虫和若虫的活动和入土。本研究前期调查发现,开封地区花生新黑地珠蚧各虫态发育时期均比濮阳地区花生新黑地珠蚧的各虫态发育时期稍早,如开封地区4月底5月初花生新黑地珠蚧2龄雌珠体即蜕壳为雌成虫爬上地表,而濮阳地区这一时间则要稍错后至5月中下旬,由于濮阳地处豫北,我们推测可能是由于地域上的南北温度差异造成开封地区虫体发育的提前,这一推测与马铁山等对濮阳地区花生新黑地珠蚧生物学特性的研究及马铁山对不同温度条件下花生新黑地珠蚧发育历期的影响结果是一致的[6, 16]。
本研究中,根据所采集的珠体及卵块的形态特征,田间初步认定为珠蚧科昆虫。结合武三安先生对于花生新黑地珠蚧的形态特征描述[1],我们在室内利用分子生物学方法对其进行了系统发育分析,综合分析后确定本文研究对象确为花生新黑地珠蚧,系统进化分析结果与传统形态学分类结果相互佐证并保持一致。
近年来,花生新黑地珠蚧在河南省的发生越来越严重,其整个发育过程中大部分时间均生活在地下,这给生产上采用化学药剂防治提出了很大挑战。本研究中对花生新黑地珠蚧虫体发育的研究表明,其卵孵化为1龄若虫后需爬回地表进行寄主搜寻,这一时期在地表活动的1龄若虫易接触药剂,因此可作为花生新黑地珠蚧的防治适期,此时期可选用适宜药剂进行喷雾并辅以花生根部喷淋进行防治。
参考文献
[1] 武三安.花生新珠蚧的学名考证(半翅目:蚧总科:珠蚧科)[J].昆虫分类学报,2007,29(3):199-204.
[2] 柴晓娟,王改云,杨红丽,等.花生新珠蚧生物學特性观察及防治技术研究[J].陕西农业科学,2004(5):98-99.
[3] 付东,任英,杨宽林,等.花生新黑地珠蚧的发生规律及防治技术[J].植物检疫,2006,20(6):350-351.
[4] 常春梅,苗连河,苗奎领.花生新黑地珠蚧在豫北的为害特点与综合治理技术[J].中国植保导刊,2012,32(4):33-34.
[5] 刘艾英,严攀,张焕玲,等.花生新黑地珠蚧生物学特性研究[J].陕西农业科学,2015,61(5):38-41.
[6] 马铁山.花生新珠蚧发育起点温度和有效积温研究[J].植物保护,2009,35(3):60-62.
[7] 任应党,申效诚,刘玉霞,等.花生新珠蚧的生物学特性及防治研究[J].华北农学报,2001,16(植物保护专辑):48-52.
[8] JAKUBSKI A W.A critical revision of the families Margarodidae and Termitococcidae (Hemiptera:Coccoidea)[M].London:Trustees of the British museum (Natural history),1965:57-81.
[9] 侯璋德,孙元峰,张异,等.新黑地珠蚧为害花生的初步研究[J].河南农业大学学报,1985(1):58-61.
[10] VON DOHLEN C D,MORAN N A.Molecular phylogeny of the Homoptera:a paraphyletic taxon [J].Journal of Molecular Evolution,1995,41:211-223.
[11] BELSHAW R,QUICKE D L J.A molecular phylogeny of the Aphidiinae (Hymenoptera:Braconidae)[J].Molecular Phylogenetics and Evolution,1997,7:281-293.
[12] DIETRICH C H,RAKITOV R A,HOLMES J L,et al.Phylogeny of the major lineages of Membracoidea (Insecta: Hemiptera: Cicadomorpha) based on 28S rNDA sequences [J].Molecular Phylogenetics and Evolution,2001,18:293-305.
[13] CHO S,MITCHELL A,REGIER J C,et al.A highly conserved nuclear gene for low-level phylogenetics:elongation factor 1-alpha recovers morphology-based tree for heliothine moths [J].Molecular Biology and Evolution,1995,12:650-656.
[14] TAMURA K,STECHER G,PETERSON D,et al.MEGA6:Molecular evolutionary genetics analysis version 6.0 [J].Molecular Biology and Evolution,2013,30(12):2725-2729.
[15] YANG Ziheng.Estimating the pattern of nucleotide substitution[J].Journal of Molecular Evolution,1994,39(1):105-111.
[16] 马铁山,郝改莲,赵香云,等.濮阳地区花生新黑地珠蚧生物学特性及化学防治方法[J].中国植保导刊,2008,28(3):18-20.
(责任编辑: 杨明丽)
