嵌合蛋白MoSlp1-AtCERK1作为抗病激发子的研究
2019-11-27陈林枭冯华峰吴梦琪
陈林枭 冯华峰 吴梦琪

摘要 本研究通过DNA体外重组技术,将稻瘟病菌MoSlp1基因和擬南芥几丁质寡糖受体基因AtCERK1的跨膜结构域和胞内结构域基因融合,构成嵌合基因MoSlp1-AtCERK1。在烟草瞬时表达试验中,MoSlp1-AtCERK1嵌合蛋白诱导烟草产生以过敏性坏死为表现形式的过敏反应。以带有MoSlp1-AtCERK1蛋白的农杆菌注射烟草,可增强烟草对烟草花叶病毒的抗病性。同时提高烟草的PR-1基因转录表达水平,表明MoSlp1-AtCERK1嵌合蛋白基因通过水杨酸信号传导的途径激活烟草系统获得性抗病。
关键词 嵌合基因; 抗病激发子; 诱导途径
中图分类号: S 435.72 文献标识码: A DOI: 10.16688/j.zwbh.2018424
Abstract In this study, DNA recombination technology was used to fuse the MoSlp1 gene of Magnaporthe oryzae and the transmembrane and intracellular domain of AtCERK1 gene, the chitin elicitor receptor gene of Arabidopsis thaliana, to construct the chimeric gene MoSlp1-AtCERK1 as a disease-resistant elicitor. In tobacco transient expression experiments, MoSlp1-AtCERK1 chimeric protein induced tobacco allergic reactions in the form of allergic necrosis. Inoculation of tobacco with Agrobacterium carrying the MoSlp1-AtCERK1 protein enhanced tobacco resistance to Tobacco mosaic virus and at the same time increased the transcription level of PR-1 gene in tobacco, indicating that the MoSlp1-AtCERK1 chimeric protein activated the tobacco to acquire resistance through the salicylic acid signaling pathway.
Key words chimeric gene; disease-resistant elicitor; induction pathway
烟草花叶病是烟草的主要病害之一,严重影响烟草的生长,烟草花叶病毒(TMV)传染性强,可以在不同植物之间传播[1]。研究表明[2],烟草花叶病毒侵染烟草植株后会破坏植株的组织结构,叶片出现斑点,呈现出黄绿相间的不同区域。对烟草花叶病的主要防治手段有农业防治[3]、化学防治[4-6]和生物防治[7-9]。
通过DNA体外重组技术,构建能特异性结合激发子的嵌合受体,是增强植物抗病性的有效方法之一。Kishimoto等[10]发现将水稻的几丁质寡糖受体OsCEBiP与水稻抗白叶枯病的XA21受体的跨膜结构域和激酶结构域融合所构成的嵌合受体CRXA,在几丁质壳寡糖处理下,能激活水稻的过敏性坏死和诱导水稻对稻瘟病菌的有效限制。嵌合基因技术作为一种有效的基因重组技术,所构建的嵌合受体在植物抗病方面值得我们重视。通过DNA体外重组技术来增强植物的抗病性,将是一种全新的探索研究。
在水稻与稻瘟病菌亲和互作中,稻瘟病菌的菌丝顶端直接插入水稻细胞质中,大量分泌一种具有2个LysM结构域的效应蛋白MoSlp1(secreted LysM protein 1)。MoSlp1蛋白与水稻的几丁质受体OsCEBiP(chitin elicitor binding protein)竞争性结合几丁质寡糖,阻碍水稻由几丁质寡糖所激发的免疫反应[11]。效应蛋白MoSlp1是稻瘟病菌成功侵染水稻所必需的。
拟南芥Arabidopsis thaliana中几丁质寡糖受体被称为AtCERK1(chitin elicitor receptor kinase 1),胞外是由1个信号肽和3个LysM结构域所构成,MoSlp1是由1个信号肽和2个LysM结构域构成,同时AtCERK1能够增强烟草对烟草花叶病毒的抗性[12-13]。通过氨基酸序列比对发现,MoSlp1的2个LysM功能域MoSlp1-LysM1、MoSlp1-LysM2与AtCERK1-LysM2的同源性不高,但与几丁质寡糖结合处的氨基酸残基同源性较高[14]。这说明了MoSlp1-LysM1和MoSlp1-LysM2都有可能结合几丁质寡糖。所以我们以AtCERK1为桥梁,将AtCERK1胞外部分替换为MoSlp1,重组成对几丁质寡糖超敏感的MoSlp1-AtCERK1嵌合受体,观察MoSlp1-AtCERK1嵌合蛋白的抗病激发子活性并研究其诱导抗性的途径。
1 材料与方法
1.1 试验材料与仪器
烟草花叶病毒Tobacco mosaic virus(TMV),扬州大学纪兆林教授馈赠; 稻瘟病菌Magnaporthe oryzae(生理小种70-15)来自国家南方农药创制中心;克隆载体:零背景(pLB)快速连接试剂盒,天根生化科技(北京)有限公司; 表达载体: pHB(双35S启动子),本实验室保存; 原核表达载体: pET-30a(+),美国Novagen生物公司; 真菌RNA提取试剂盒: 北京康为世纪生物科技有限公司; 镍柱:美国GE医疗器械公司。
为了检测重组表达的MoSlp1-AtCERK1嵌合蛋白具有蛋白激發子活性,我们选用本氏烟草为研究对象,分别将带有GFP、AtCERK1和MoSlp1-AtCERK1蛋白的农杆菌注射烟草,48 h后用台盼蓝组织染色法检测死细胞,试验重复5次。
为检测MoSlp1-AtCERK1蛋白诱导烟草抗病所依赖的信号传导途径,以250 nmol/L的MoSlp1-AtCERK1蛋白喷雾处理整株烟草,48 h后取少许烟草叶片,提取RNA,反转录得cDNA,以EF-1a基因为内参,用荧光定量PCR法测定PR-1、LOX和ERF1的相对表达量,试验重复3次。本研究中所用引物序列见表1。
2 结果
2.1 MoSlp1-AtCERK1基因构建
如图1a所示,本研究将MoSlp1基因的终止密码子除去,再把整个MoSlp1基因与AtCERK1基因的跨膜结构域和胞内激酶结构域相互融合。两个基因在AtCERK1基因的第229位甘氨酸(Gly)与MoSlp1相融合形成MoSlp1-AtCERK1嵌合基因。之后再用双酶切法将整个嵌合基因插入到带有双重CaMV 35S启动子和绿色荧光蛋白(GFP)标签的pHB载体中。
2.2 MoSlp1-AtCERK1蛋白诱导表达
MoSlp1-AtCERK1蛋白诱导利用原核表达系统,在1 mmol/L IPTG诱导作用下,在大肠杆菌中将重组蛋白MoSlp1-AtCERK1成功表达出来。带有6×His标签的MoSlp1-AtCERK1蛋白的SDS-PAGE分析见图2。从图2 SDS-PAGE 分析可知,在80 kD左右处有单一条带,MoSlp1-AtCERK1蛋白体外成功表达,为后续试验提供方便。
2.3 MoSlp1-AtCERK1基因亚细胞定位
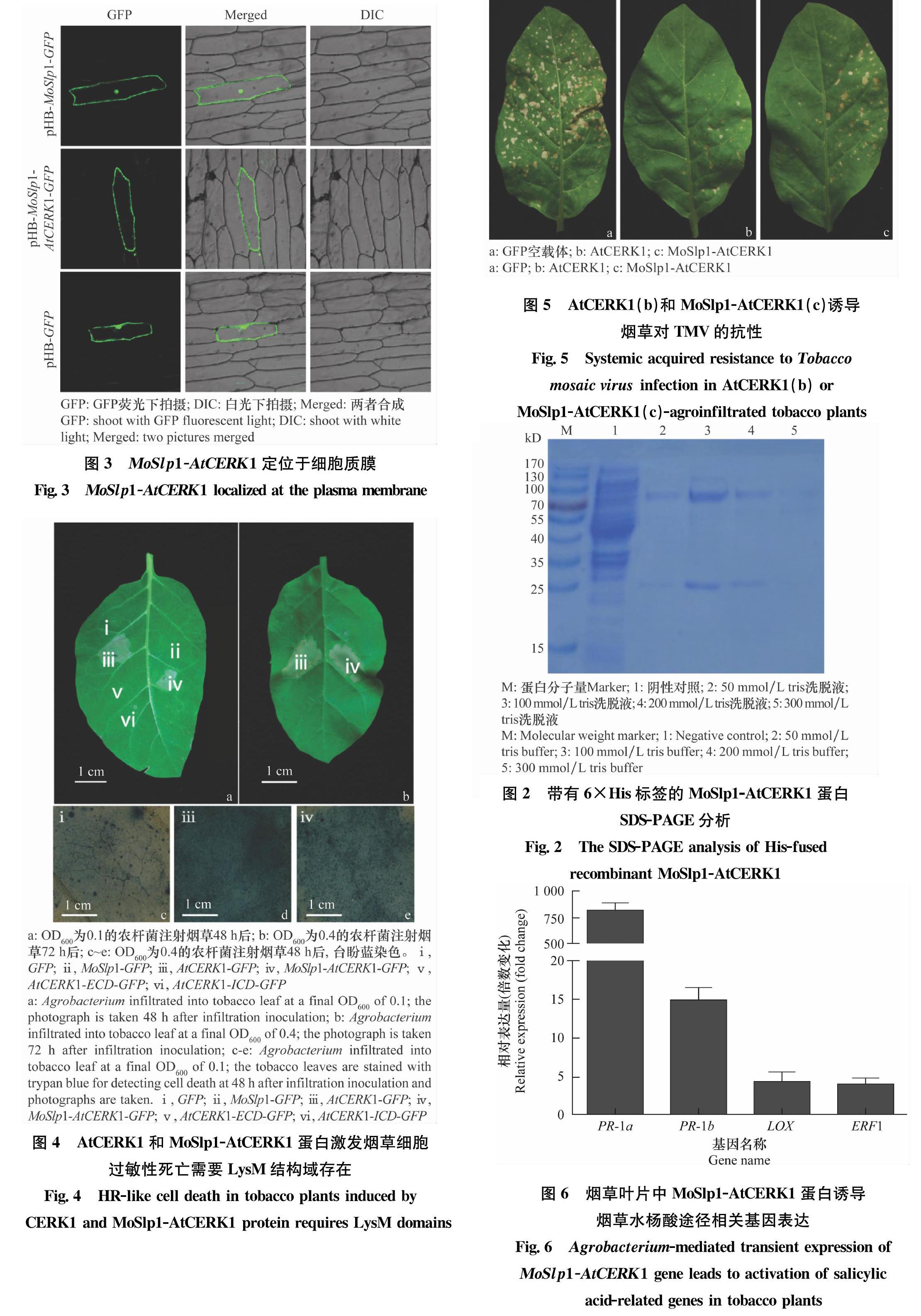
从图3可知,MoSlp1-AtCERK1基因定位于细胞质膜上,这与AtCERK1基因定位一致。这是因为在MoSlp1-AtCERK1基因的氨基酸序列中,AtCERK1基因的跨膜结构域全部被保留,利用跨膜结构域与膜结合的特性将MoSlp1-AtCERK1基因锚定于质膜上。MoSlp1基因的N端含有信号肽,没有跨膜结构域存在,这是MoSlp1基因定位于细胞核和细胞质中的主要原因。
2.4 MoSlp1-AtCERK1蛋白在烟草中瞬时表达及诱导烟草过敏反应 根据pHB载体上的酶切位点,本研究在MoSlp1-AtCERK1 C端插入了GFP标签,同时构建pHB-AtCERK1,pHB-AtCERK1-ECD,pHB-AtCERK1-ICD和pHB-MoSlp1载体,观察各个基因编码的蛋白在烟草中瞬时表达情况,结果见图4a~b。AtCERK1-GFP(ⅲ)和MoSlp1-AtCERK1-GFP(ⅳ)激发本生烟草的过敏性坏死。由此说明AtCERK1和MoSlp1-AtCERK1蛋白具有类似于蛋白激发子的活性,而MoSlp1-GFP(ⅱ),AtCERK1-ECD-GFP(ⅴ)和AtCERK1-ICD-GFP(ⅵ)没有产生过敏性坏死现象,所以都不具有蛋白激发子活性。从图4c~e可知,对照组GFP(c)中有少量的细胞死亡,可能是由于农杆菌侵染导致。而AtCERK1(d)和MoSlp1-AtCERK1(e)蛋白注射烟草后,死亡的细胞明显增多,表明烟草叶片产生过敏性坏死现象。
2.5 MoSlp1-AtCERK1蛋白诱导烟草对烟草花叶病毒抗性 MoSlp1-AtCERK1蛋白诱导烟草对烟草花叶病毒的抗性见图5。与对照组(a)相比,MoSlp1-AtCERK1(c)诱导的烟草病斑数明显减少,表明MoSlp1-AtCERK1蛋白可以诱导烟草对TMV抗性。而AtCERK1(b)诱导的烟草对TMV抗性更强,病斑数更少。我们观察到,烟草花叶病毒的病斑大小与对照组相比,没有明显差异,这说明AtCERK1和MoSlp1-AtCERK1蛋白诱导烟草抵御烟草花叶病毒的抗性仅表现为抑制初侵染,而一旦烟草花叶病毒成功入侵烟草后,对其增殖并没有明显抑制作用。
2.6 MoSlp1-AtCERK1信号传导途径
MoSlp1-AtCERK1蛋白诱导烟草相关防卫基因的表达见图6。从图6可知, PR-1a基因相对表达量明显上升了将近800倍,PR-1b基因相对表达量上升了约15倍。LOX和ERF1基因的相对表达量略有上升(4.5倍和4倍),与PR-1a基因相比可以忽略。由此我们可知,外源MoSlp1-AtCERK1蛋白处理诱导烟草抗病是依赖于SA信号传导途径。
3 结论与讨论
MoSlp1-AtCERK1基因定位于细胞膜上才能感知在非原生质体间积累的几丁质寡糖。MoSlp1自身发生同源二聚化或同源共聚化,通过AtCERK1激酶结构域将信号传递至胞内激酶结构域中,激活激酶结构域的磷酸化,将信号传导并放大,诱导植物产生一系列的免疫反应[18]。所以MoSlp1-AtCERK1 基因定位细胞膜上,是MoSlp1-AtCERK1 嵌合受体能诱导植物产生免疫反应的基础。
Pietraszewska等[16]认为AtCERK1蛋白在烟草中瞬时表达会引起LysM结构域的同源二聚化,激活胞内激酶结构域,从而引起烟草的过敏反应。若将AtCERK1胞内激酶结构域的关键位点(第349位的赖氨酸)突变,过敏反应将不会发生。Mentlak等[19]在酵母双杂交实验中发现MoSlp1能形成同源二聚体或同源共聚体,但我们的试验并没有发现MoSlp1引起过敏性坏死现象。MoSlp1蛋白LysM结构域的存在并发生同源二聚化或同源共聚化是MoSlp1-AtCERK1蛋白诱导烟草产生过敏反应所必需的,而且更进一步说明MoSlp1与AtCERK1-ICD融合构建的嵌合受体具有AtCERK1相似的功能和活性。植物病原菌分泌的Harpin蛋白作为蛋白类激发子在寄主植物上产生致病性,在非寄主植物上可以诱导过敏性坏死,同时可以诱导植物抗病并促进植物生长[18]。我们虽然没有将MoSlp1-AtCERK1蛋白与Harpin蛋白直接进行对比试验,但是我们预测融合蛋白MoSlp1-AtCERK1也可能作为一种蛋白类激发子,可以诱导植物的非寄主抗病和促进植物生长。
目前已知的植物抗病信號传导途径主要依赖于水杨酸(SA)、乙烯(ET)和茉莉酸(JA)介导的途径[20]。植物病程相关基因PR-1的诱导表达是植物依赖于水杨酸诱发系统获得性抗病产生的分子标志[21]。乙烯响应元件绑定因子ERF1基因是乙烯信号传导过程中的关键转录因子之一[22],脂氧合酶基因LOX是茉莉酸合成途径的关键酶编码基因[23]。所以常将PR-1、ERF1和LOX这3个基因作为水杨酸、乙烯和茉莉酸信号通路的标志性基因。在本文中,PR-1a基因相对表达量明显上升,说明外源MoSlp1-AtCERK1蛋白处理诱导烟草抗病是依赖于SA信号传导途径。
我们通过DNA体外重组技术克隆MoSlp1-AtCERK1基因,在烟草系统中测试了MoSlp1-AtCERK1作为蛋白激发子的各种生理指标试验,证明MoSlp1-AtCERK1具有蛋白激发子活性,可诱导烟草过敏性细胞坏死反应。同时MoSlp1-AtCERK1蛋白可以诱导烟草对烟草花叶病毒的抗性,此诱导过程依赖于水杨酸信号传导途径。
参考文献
[1] 马国胜,何博如. 烟草病毒研究现状与展望[J]. 中国生态农业学报,2006,14(2):150-153.
[2] 北京农业大学.农业植物病理学[M]. 北京:农业出版社, 1991: 301-302.
[3] 蔡健和, 周兴华, 黄福新,等. 广西烟草病毒病发生相关因素分析及综合防治研究[J]. 南方农业学报, 2009, 40(2):159-163.
[4] 李宏光, 钟权, 张赛, 等. 8种农药防治烟草花叶病的田间药效试验[J].江西农业学报, 2012, 24(4): 100-101.
[5] 刘旭, 万宣伍, 刘国军, 等. 3种药剂对烟草花叶病的控制作用及农艺性状的影响[J]. 西南师范大学学报(自然科学版), 2010, 35(1): 101-104.
[6] XU Xingyang, OUYANG Jin,YANG Ming. Field observation on control of Tobacco mosaic virus (TMV) with Chemicals [J]. Tobacco Science & Technology, 2017, 50(12): 90-95.
[7] 申莉莉, 王凤龙, 钱玉梅. 拮抗细菌对烟草花叶病毒(TMV)的抑制作用研究[J]. 中国烟草科学, 2007, 28(5): 9-11.
[8] 尤升波, 游银伟. 草酸青霉菌果胶酶诱导烟草抗TMV的研究[J].山东农业科学, 2014, 46(5): 102-106.
[9] LIAN Lingli, XIE Liyan, ZHENG Luping, et al. Induction of systemic resistance in tobacco against Tobacco mosaic virus by Bacillus spp.[J].Biocontrol Science & Technology,2011,21(3):281-292.
[10] KISHIMOTO K, KOUZAI Y, KAKU H, et al. Enhancement of MAMP signaling by chimeric receptors improves disease resistance in plants [J]. Plant Signaling and Behavior,2011,6(3):449-451.
[11] MENTLAK T A, KOMBRINK A, SHINYA T, et al. Effector-mediated suppression of chitin-triggered immunity by Magnaporthe oryzae is necessary for rice blast disease[J]. Plant Cell, 2012, 24(1): 322-335.
[12] MIYA A, ALBERT P, SHINYA T, et al. CERK1, a LysM receptor kinase, is essential for chitin elicitor signaling in Arabidopsis [J]. Proceedings of the National Academy of Sciences, 2007, 104(49): 19613-19618.
[13] ZHAO Xiaoming, SHE Xiaoping, DU Yugang, et al. Induction of antiviral resistance and stimulary effect by oligochitosan in tobacco [J]. Pesticide Biochemistry and Physiology, 2007, 87(1): 78-84.
[14] LIU Tingting, LIU Zixu, SONG Chuanjun et al. Chitin-induced dimerization activates a plant immune receptor [J]. Science, 2012, 336(6085): 1160-1164.
[15] HORTON R M, HO S N, PULLEN J K, et al. Gene splicing by overlap extension [J]. Methods in Enzymology, 1993, 217(1): 270.
[16] 安千里, 杨学健, 董越梅, 等. 用共聚焦激光扫描显微镜观测 GFP 标记的内生固氮菌 Klebsiella oxytoca SA2 侵染水稻根[J]. 植物学报, 2001, 43(6): 558-564.
[17] PIETRASZEWSKA-BOGIEL A, LEFEBVRE B, KOINI M A, et al. Interaction of Medicago truncatula lysin motif receptor-like kinases, NFP and LYK3, produced in Nicotiana benthamiana induces defence-like responses [J/OL].PLoS ONE,2013,8(6):e65055.DOI:10.1371/journal.pone.0065055.
[18] LI Xiaojie, HAN Bing, XU Manyu, et al. Plant growth enhancement and associated physiological responses are coregulated by ethylene and gibberellin in response to harpin protein Hpa1 [J]. Planta, 2014, 239(4): 831-846.
[19] MENTLAK A T. Investigating LysM effector function and the biotrophic growth phase of Magnaporthe oryzae[D]. Exeter: University of Exeter,2012.
[20] 汪斌, 李维明. 植物激素的信号转导系统研究进展[J]. 福建农林大学学报, 2001, 30(4): 433-438.
[21] UWE C, HERMAN S, KLESSIG D F. Protein dephosphorylation mediates salicylic acid expression of PR-1 genes in tobacco [J]. Plant Journal, 2010, 11(4): 747-757.
[22] SOLANO R, STEPANOVA A, CHAO Qimin, et al. Nuclear events in ethylene signaling: a transcriptional cascade mediated by ETHYLENE-INSENSITIVE3 and ETHYLENE-RESPONSE-FACTOR1 [J]. Genes & Development, 1998, 12(23): 3703.
[23] SHI Yanxia, YU Yang, FU Junfan, et al. Relationship between LOX activity and JA accumulations in cucumber leaves induced by pathogen [J]. Acta Phytophylacica Sinica,2008,35(6):486-490.
(責任编辑: 田 喆)
