SALL4基因表达与急性髓细胞白血病细胞系KG1a耐药相关性研究
2019-11-27郭野
郭 野
(中国医学科学院北京协和医院检验科,北京 100730)
化疗能使大部分急性髓细胞白血病患者的病情获得缓解,但是仍有相当一部分患者最终会复发。白血病细胞产生耐药性是导致疾病复发、治疗失败的主要原因之一[1-2]。在白血病细胞中存在0.1%~1.0%具有自我更新能力的白血病干细胞,它保留了干细胞的主要特征,其具有ATP相关转运体对药物、毒素、凋亡刺等耐受,可以逃避化疗药物的作用,这可能是白血病复发和耐药的原因[3-4]。SALL4基因过表达具有白血病致癌作用,它通过激活造血干细胞自我更新的重要通路Wnt/β-Catennin通路的活性,促进白血病干细胞不断增殖,导致白血病的发生[5-6]。但SALL4基因与白血病细胞耐药是否有关,还不得而知。本研究采用RNA干扰技术通过抑制白血病细胞KG1A中SALL4基因的表达,探讨SALL4基因表达改变时,其对化疗药物的耐受情况,以探寻SALL4基因与急性髓细胞白血病耐药的相关性。
1 材料与方法
1.1材料 AML-细胞系KG1a购自美国模式菌种收集中心(ATCC)。由GeneBank提供SALL4基因的引物序列,参考基因为β-actin,设计荧光定量PCR方法所用引物,并由北京奥科生物工程有限公司合成。所用基因和引物序列相关信息见表1。

表1 引物序列和片段大小
1.2试剂与仪器 成品shRNA-pRS质粒载体干扰SALL4基因表达系统为美国 Origene公司产品,Opti-MEMⅠReduced 血清、PLUS Reagent及DNA-Lipofectamin LTX购自美国 invitrogen公司,RNA提取试剂盒购自美国QIAGEN公司,逆转录PCR试剂盒购自加拿大New England BioLabs公司,荧光定量PCR试剂SYBR Premix Ex Taq购自大连宝生物工程大连有限公司,RPMI 1640培养液购自美国GIBCO公司,MTS细胞增殖检测试剂盒购自美国Promega公司。阿霉素、柔红霉素购自北京中硕科技有限公司。PCR热循环仪、电泳仪、凝胶成像仪购自美国BIO-RAD公司,Light Cycler荧光定量PCR扩增仪购自瑞士Roche公司,酶标仪购自芬兰热电公司,光学显微镜购自日本Nikon公司。
1.3方法
1.3.1细胞培养 急性髓系白血病细胞系KG1a以含10% FBS的RPMI 1640培养液于37 ℃ 5% CO2饱和湿度条件下培养,每2~3天进行换液。
1.3.2KG1A细胞转染 按照文献[7]转染KG1A细胞,设空白组(blank)、转染对照组(control组),转染组(test)于37 ℃ 5% CO2饱和湿度条件下培养test组转染SALL4-shRNA-pRS-1质粒载体,control组转染空shRNA-pRS1质粒载体。
1.3.3逆转录PCR及荧光定量PCR检测基因表达 转染48 h后收集各组KG1A细胞1×105个,进行逆转录PCR及荧光定量PCR。荧光定量PCR扩增反应条件为:95 ℃ 3 min,95 ℃ 30 s,57 ℃30 s,72 ℃ 20 s,78 ℃ 1 min,共40个循环。以β-actin为内参基因, SYBRGreen荧光染料法和ΔCt进行基因表达定量分析[7]。
1.3.4体外药敏试验 各组分别接种到含不同浓度化疗药物的新鲜10% FBS RPMI 1640培养液的96孔板中。其中阿霉素和柔红霉素均配成4个浓度梯度,分别为0.0、0.1、0.5、1.0 μg/mL。严格按照试剂盒操作要求在反应24 h后,将细胞增殖剂MTS-1添加到每个孔中。在450 nm处酶标仪读取结果。上述实验重复测定5次。
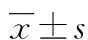
2 结 果
2.1RNAi抑制白血病细胞SALL4基因表达的分析 荧光定量PCR结果显示,test组和control组的SALL4基因表达水平为blank组的(30.0±4.9)%、和(102.0±6.5)%。 test组SALL4基因表达水平显著低于blank组(t=9.1,P<0.05);control组SALL4基因表达水平与blank组相比差异无统计学意义(t=1.1,P>0.05)。
2.2体外药敏试验结果分析 各组细胞在不同浓度的阿霉素作用24 h后,细胞相对增殖率呈规律性变化,见表2。在阿霉素作用下,SALL4基因抑制表达后,细胞增殖率较其正常表达时显著下降, 而这种趋势在不同浓度的阿霉素作用时均有体现。说明当SALL4基因抑制表达时,白血病细胞的耐药性会减弱。但随着阿霉素浓度的增加这种减弱趋势会降低,见图1A。当使用柔红霉素进行实验时也得到了相似的发现,见表3,在柔红霉素作用下,SALL4基因抑制表达后,细胞增殖率较其正常表达时显著下降。 在各个浓度柔红霉素作用下,SALL4抑制表达时细胞增殖率较其正常表达时均会显著下降,见图1B。

表2 不同浓度的阿霉素处理后细胞相对增殖率的改变
注:与control组比较,*P<0.05

表3 不同浓度的柔红霉素处理后细胞相对增殖率的改变(%)
注:与control组比较,*P<0.05;与blank组比较,#P<0.05

注:A表示不同浓度阿霉素处理后;B表示不同浓度柔红霉素处理后
图1 SALL4不同表达水平下细胞相对增殖率的改变折线图
3 讨 论
SALL4是一种在鼠科胚胎细胞中新发现的多功能干细胞因子。它在维持肝脏星状细胞的多能性方面具有重要的作用,并与造血系统发育和血液恶性肿瘤,特别是髓系白血病的发生具有相关性。以往研究表明它通过调节Wnt/β-catenin信号通路而导致白血病干细胞的异常增殖[8-9]。白血病干细胞不但是血液肿瘤发生的重要因素,而且与白血病耐药具有密切关系。SALL4基因作为白血病干细胞的重要调节因子,其与白血病耐药的关系还鲜有报道。本研究通过RNA干扰技术,抑制急性髓细胞白血病细胞系KG1A中SALL4基因的表达,然后与常用的化疗药物阿霉素和柔红霉素处理后,反向探寻SALL4基因不同表达水平下细胞相对增殖率的变化。
阿霉素为广谱抗肿瘤药,对机体可产生广泛的生物化学效应,具有强烈的细胞毒性作用。其作用机理主要是该品嵌入DNA而抑制核酸的合成。临床上用于治疗急性淋巴细胞白血病、急性粒细胞性白血病等[10-11]。本实验对不同处理组的KG1A细胞进行不同浓度的阿霉素处理,SALL4基因抑制表达时细胞的相对增殖率要显著低于SALL4基因正常表达时的水平。阿霉素的治疗效果与SALL4基因表达量相关,而阿霉素的使用浓度逐渐增高时这种趋势并未发生改变。柔红霉素为第1代蒽环类抗肿瘤抗菌药物,作为一种周期非特异性化疗药,其主要用于治疗各种类型的急性白血病(包括粒细胞性、淋巴细胞性、单核细胞性及粒-单核细胞性)、红白血病、慢性粒细胞性白血病、恶性淋巴瘤等[12-13]。使用柔红霉素来重复上述实验时,得到了相似的实验结果,柔红霉素的治疗效果与SALL4基因表达量同样具有相关性,SALL4基因表达量越高,柔红霉素的治疗效果越差。而随着柔红霉素使用浓度的增高,白血病细胞相对增殖率逐渐下降,但是药物浓度的改变并不影响SALL4抑制表达组的治疗效果均优于SALL4高表达组这一事实。上述体外实验表明,SALL4基因与急性白血病细胞产生抗药性密切相关[14]。而其耐药机制也是源于其SP细胞的特性。SP细胞具备非常强大的细胞膜泵功能以避免有害物质的入侵。Hoechst 33342可结合至DNA的A-T富集区域进入活细胞内,但是它也会被ATP-Binding Cassette(ABC)转运子排出细胞外,其这一特性,可以通过流式细胞仪把SP细胞和非SP细胞分开。化疗药物可能也可以通过高表达ABC转运家族成员ABCG2后,外排药物而导致肿瘤细胞发生耐药。多个血液肿瘤细胞的SP细胞SALL4基因的表达量均高于在非SP细胞中SALL4基因的表达。另外, SALL4基因抑制表达前后SP细胞的比例也会减低。SALL4与白血病发生耐药的机制可能源于SP细胞的外排功能而发挥作用[15]。
4 结 论
终上所述,SALL4基因的表达是急性髓细胞白血病产生耐药的正性调节因素,这一发现不仅有助于对急性髓细胞白血病发生耐药机制的认识,而且为以后的特异性靶向治疗提供了理论依据。其促进白血病发生耐药的具体机制可能是通过影响侧群细胞的外排机制而起作用,但更深入的机制还有待进一步研究。
