2种方法测定急性脑梗死患者蛋白C抗凝活性比较分析
2019-11-27王晓琳王培昌
李 蕾,马 静,杨 旭,王晓琳,洪 萍,王培昌
(首都医科大学宣武医院检验科,北京 100053)
蛋白C是体内一种重要的抗凝血因子,其抗凝活性占全血的20%~30%。蛋白C缺乏在健康人群中的检出率为0.2%~0.4%,在血栓症患者中的发病率为5%~15%,在静脉血栓栓塞症患者的检出率为2.3%~3.3%[1]。而我国蛋白C缺乏检出率为2.26%[2]。由于大部分患者临床表现轻微甚至无明显临床表现,2%的蛋白C缺乏症有明显而严重的临床症状,如深静脉血栓形成、弥散内血管内凝血等血栓性疾病[3],因此,对体内蛋白C的检测具有重要的临床意义。蛋白C抗凝活性检测主要是发色底物法和凝固法,目前不同实验室和仪器对蛋白C抗凝活性的检测方法尚不统一[4-6],并且国内用2种检测方法针对某一疾病进行蛋白C抗凝活性分析的研究较少。本研究针对本院健康人群和急性脑梗死患者,分别采用发色底物法和凝固法检测蛋白C抗凝活性并进行方法学比较,以确定2种方法在临床应用中的可交换性和替代性,为临床应用分析提供参考依据。
1 资料与方法
1.1一般资料 收集2018年7-12月首都医科大学宣武医院神经内科住院的急性脑梗死患者160例为疾病组,其中男82例,女78例,年龄46~86岁,平均(67.34±19.09)岁。纳入标准:(1)首次发作;(2)发病时间≤48 h;(3)符合1995年中华医学会第4届全国脑血管病学术会议制订的各类脑血管疾病诊断要点;(4)所有患者均经头颅CT或MRI检查确诊。排除标准:(1)接受早期再灌注治疗;(2)头部CT或MRI证实有脑出血;(3)肿瘤、免疫性疾病、严重感染、急性心肌梗死、肝肾疾病;(4)入院前1周内曾使用抗血小板或抗凝药物。以同期本院体检中心体检健康者134例为对照组,男54例,女46例,年龄48~85岁,平均(65.84±20.61)岁,所有患者无血液系统疾病、免疫性疾病、感染性疾病、恶性肿瘤、颅脑损伤、脑肿瘤、蛛网膜下腔出血及严重心、肺、肾等脏器功能障碍等病史。2组年龄、性别比较,差异均无统计学意义(P>0.05)。
1.2仪器与试剂 STAGO-R全自动凝血分析仪;STAGO配套的原装试剂,蛋白C发色底物法试剂盒(批号:250183),蛋白C凝固法试剂盒(实验方法),STAGO系统质控品(批号:115020),STAGO校准品(批号:252572)。
1.3方法 收集研究对象抗凝血标本,枸橼酸钠抗凝剂与全血比例为1∶9,标本无溶血、脂血、黄疸,3 000 r/min离心10 min后吸取血浆,保存于-80 ℃冰箱内。检测前待测标本置于37 ℃水浴箱内复融,在STAGO-R全自动凝血分析仪上用2种检测方法进行测定,严格按照厂家的操作说明书操作。目前对于蛋白C的筛查比较推荐的方法是发色底物法[7],选择发色底物法作为比较方法(x);而凝固法作为实验方法(y)。实验前均对检测系统进行校准和质控,确保在控时进行实验,以此保证数据的准确性。

2 结 果
2.12种方法差异性分析 应用配对t检验对所有入组人群、对照组和疾病组采用发色底物法与凝固法测得的蛋白C抗凝活性数据进行差异性分析,结果提示以上3组发色底物法与凝固法之间差异无统计学意义(P>0.05)。与对照组相比,疾病组蛋白C抗凝活性显著降低,差异有统计学意义(P<0.05)。见表1。
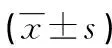
表1 2种方法测定蛋白C抗凝活性的比较分析
注:与发色底物法相比,*P>0.05;与对照组相比,#P<0.05
2.22种方法相关性分析 以发色底物法为比较方法x,凝固法为实验方法y,应用Pearson相关性分析进行比较,结果显示所有入组人群用2种方法测定蛋白C抗凝活性相关系数分别为r=0.870 5(P<0.001),r=0.857 0(P<0.001),r=0.882 4(P<0.001);决定系数分别为R2=0.757 8,R2=0.734 5,R2=0.778 7;直线回归方程分别为y=0.975 3x+1.934 5,y=0.922 6x+6.823 3,y=1.031 5x-2.790 8。Pearson相关性分析提示发色底物法与凝固法之间的相关性显著,呈高度线性相关。见图1~3。

图1 所有入组人群发色底物法与凝固法相关性分析

图2 对照组发色底物法与凝固法相关性分析

图3 疾病组发色底物法与凝固法相关性分析
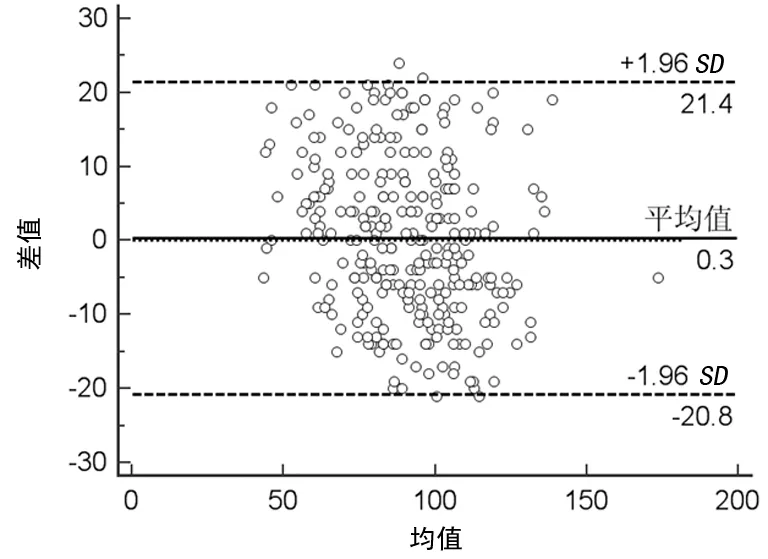
图4 所有入组发色底物法与凝固法一致性检验

图5 对照组发色底物法与凝固法一致性检验
2.32种方法一致性检验 以发色底物法与凝固法2种检测方法测定结果的均值为x轴,2种检测方法测定结果的差值为y轴,绘制Bland-Altman散点图。结果显示所有入组人群2种检测方法差值的平均偏倚为0.3%,95%一致性界限范围为-20.8%~21.4%,其中1.36%(4/294)的点在95%一致性界限外。在一致性界限范围内,最大偏倚相当于均值的23.18%。对照组2种检测方法差值的平均偏倚为0.4%,95%一致性界限范围为-20.8%~21.6%,其中2.50%(4/160)的点在95%一致性界限外。在一致性界限范围内,最大偏倚相当于均值的22.63%。疾病组2种检测方法差值的平均偏倚为0,95%一致性界限范围为-20.9%~20.9%,其中2.99%(4/134)的点在95%一致性界限外。在一致性界限范围内,最大偏倚相当于均值的22.68%。以上3组数据这种相差幅度在临床上不能接受。见图4~6。

图6 疾病组发色底物法与凝固法一致性检验
3 讨 论
蛋白C是一种由肝脏产生的维生素K依赖性血浆蛋白,在凝血酶或凝血酶-血栓调节蛋白复合物的作用下转变为活化蛋白C[8],活化蛋白C与其辅因子蛋白S形成复合物,灭活活化FⅤ(FⅤa)和活化FⅧ(FⅧa)并增强纤溶活性,因此具有抗凝作用。当蛋白C缺乏时,FⅤa和FⅧa灭活减少、血循环纤溶能力降低,致使纤维蛋白形成过多而发生血栓[9]。
蛋白C活性的检测大多通过商品试剂Protac®。Protac®是单链的蛋白酶,由铜斑蛇毒纯化提取的产物。Protac®能够极快速地激活蛋白C使之成为活化蛋白C,可以有效地排除蛋白C抑制剂对试验的影响。发色底物法通过测定产色底物的吸光度变化来推测所测物质的含量和活性,而凝固法的测定目标为蛋白C的抗凝活性,即对凝血因子FⅤa、FⅧa的灭活能力[10]。但目前对2种方法学的比较及干扰因素的研究较少。
由于神经科学为我院国家级重点学科,本室蛋白C抗凝活性检测人群主要来源于神经内、外科,其次是血管外科、妇产科等。病种大部分为急、慢性缺血性脑血管病,本研究疾病组选取病种为急性脑梗死患者。通过发色底物法和凝固法2种方法检测对照组和疾病组血浆中蛋白C抗凝活性,并进行统计学分析,结果显示在健康和特定疾病人群中不同方法测得蛋白C抗凝活性差异无统计学意义,仅凝固法测定结果略低于发色底物法。与对照组相比,急性脑梗死患者采用2种方法测定蛋白C抗凝活性均显著降低,与以往研究结果一致[11-12]。本研究组为急性脑梗死患者可能由于血栓事件急性期蛋白C消耗,出现抗凝蛋白水平的短暂下降[13],建议蛋白C降低患者1个月后复查,以排除易栓症可能性。
Pearson相关分析结果表明,采用不同方法检测蛋白C活性具有显著的相关性和线性回归,而Bland-Altman一致性检验显示在对照组和疾病组2种检测方法的测量结果相差幅度均较大,不能被临床接受,因此,不能作为发色底物法的替代方法。可能由于凝固法干扰因素多,如血浆FⅧ水平升高、高脂血症、狼疮性抗凝物均可影响凝固法测得的血浆蛋白C活性[14]。目前认为肝素含量低于1~2 U/mL,不会影响凝固法的检测;但是当含有阿加曲班、水蛭素、比伐卢定等凝血酶抑制剂时,会使检测结果假性升高[15]。而发色底物法当肝素含量不超过2 U/mL时不会影响检测结果,而且凝血酶抑制剂亦不会影响试验。发色底物法常见的干扰酶类有凝血酶、活化的FⅩa、激肽释放酶和组织纤维酶原激活剂等[10]。KHOR等[15]建议来自弥散性血管内凝血患者、含有组织纤溶酶原激活剂的样本或者采血缓慢的幼儿可应用空白对照。这样可排除干扰物质的作用,缩短报告时间,同时节省试剂成本。由于发色底物法干扰因素较少,比凝固法准确,目前对于检测蛋白C缺乏的筛查比较推荐的方法是发色底物法[7]。此外,本研究纳入数据均是单次测量,没有采取多次测量求平均值的方法,不能消除测量随机误差的影响。检测蛋白C抗凝活性的2种方法均受分析前因素和实验室各种因素的影响,要尽量排除分析前因素影响,定期校准仪器。本次研究仅针对相对健康人和急性脑梗死患者,对于其他血栓性疾病的比对分析尚需进一步研究,以使易栓症筛查的方法学标准化、数据精准化,更好地指导临床诊疗工作。
4 结 论
实验室在比较不同方法检测一致性时应采取多种方法从不同角度进行联合评价,以避免某一方法评价中局限性的影响,使评价结论更为合理、客观。
