黑木耳多糖的酶法生物转化工艺优化及其体外降血糖性能
2019-11-27骆嘉原孙凯峰包怡红
骆嘉原,孙凯峰,包怡红
(东北林业大学林学院,黑龙江哈尔滨 150040)
黑木耳(Auriculariaauricula),又称黑菜,木耳科,木耳属,是一种药食两用真菌,公认的保健食品之一。在神农氏时期,人们就已经开始食用,栽培黑木耳[1]。黑木耳多糖为黑木耳子实体的主要功能性成分,主要由水溶性β-D-葡聚糖、水不溶性β-D-葡聚糖和两种酸性杂多糖构成[2]。黑木耳多糖具有抗炎症、降低血脂、抗血栓形成、降低血液粘度、降低血糖、抗凝血、抗肿瘤、抗糖尿病、抗衰老等作用,是一种能够增强人体免疫功能和抗肿瘤作用的生物活性物质[3-15]。
近年来,糖尿病已经成为影响人体健康的慢性疾病之一,发病率与死亡率日益增高,并且患病人群也逐渐由中老年人群转向年轻人群[16]。高血糖会对人体的眼、肾、心血管等造成损伤,因此降低血糖是控制糖尿病危害的主要途径[17]。有研究表明多糖能够抑制α-淀粉酶的活性从而抑制高聚糖的分解,达到降低血糖水平的目的。这与多糖的结构及生物活性有较大的关联,但具体机制还需要进一步研究[18]。木耳多糖被发现有良好的降血糖能力,宗灿华等[19]研究发现黑木耳多糖对正常小鼠和糖尿病小鼠血糖均有降低效果,且对糖尿病小鼠的作用效果更显著。尹红力等[20]通过建立体外α-葡萄糖苷酶抑制剂筛选模型对黑木耳多糖的体外降血糖功能进行评估,该实验发现黑木耳酸性多糖通过影响葡萄糖的转运和代谢酶的活性而达到调节血糖的目的。
现今已有学者对木耳多糖的提取及功能活性的测定进行了研究,表明木耳多糖有良好的生物活性和广阔的应用前景。但大部分研究仅仅利用酶法提取多糖,文献利用酶对多糖进行生物转化。木耳多糖是聚合度较高的高分子碳水化合物,通过酶解转化为分子量较小的低聚糖,使更多的活性基团暴露,可能会使其拥有更好的生物活性。因此,本实验以黑木耳为原料,采用复合酶法对黑木耳多糖进行提取及降解达到生物转化的目的,并选取α-淀粉酶抑制率及葡萄糖透析延迟指数作为衡量降血糖性能的指标,同时监测多糖得率及分子量组成的变化。以期为黑木耳多糖的生物酶法改性提供理论依据,也为黑木耳的开发利用提供新的方法和途径。
1 材料与方法
1.1 材料与仪器
黑木耳 家乐福超市;纤维素酶(5000 U/g)、酸性蛋白酶(60000 U/g)、胰蛋白酶(300 U/g)、木瓜蛋白酶(45000 U/g)、果胶酶(40000 U/g)、糖化酶(10000 U/g)北京博奥拓达科技有限公司;碱性蛋白酶(60000 U/g)、α-淀粉酶(13000 U/g)、α-葡萄糖苷酶(20000 U/g) 上海源叶生物科技有限公司;中性蛋白酶(60000 U/g) 北京奥博星生物技术有限责任公司;其它试剂 均为国产分析纯。
FW100型高速万能粉碎机 天津市泰斯特仪器有限公司;DG-9240电热恒温鼓风干燥箱 西安禾普化工仪器有限公司;TDL-40B-W型离心机 上海标仪仪器有限公司;FA1004型分析天平、722S可见分光光度计、982S紫外风光光度计 上海精密科学仪器有限公司;DK-512电热恒温水浴锅 上海森信实验仪器有限公司。Agilent 1260 infinity HPLC-GPC系统、Agilent1362A示差折光检测器 安捷伦科技有限公司;300 mm×7.8 mm×5 μm G2000SWXL色谱柱 TSK株式会社。
1.2 黑木耳粉的制备
将黑木耳清洗,浸泡,挑选,沥干后,80 ℃烘箱干燥,高速粉碎机粉碎,过100目筛,得木耳粉备用。
1.3 黑木耳多糖的提取
1.3.1 黑木耳酶解多糖的提取 精确称取1 g木耳粉,置于锥形瓶中,加入一定量蒸馏水,搅拌均匀,用0.1 mol/L NaOH溶液(或0.1 mol/L HCl溶液)调节体系pH,加入相应的酶,并将锥形瓶放入水浴锅中,恒温酶解一段时间后取出,离心得到多糖提取液,醇沉过夜,得黑木耳酶解多糖。
1.3.2 黑木耳非酶解水提多糖的制备 精确称取1 g木耳粉,置于锥形瓶中,以1∶60的料液比与蒸馏水充分混合,100 ℃水浴2 h,取出离心,上清液为非酶解水提多糖提取液,醇沉过夜,得黑木耳非酶解水提多糖。
1.4 黑木耳多糖酶法生物转化试验设计
1.4.1 酶制剂的筛选 依据酶制剂的作用位点不同,选取纤维素酶、果胶酶、碱性蛋白酶、中性蛋白酶、酸性蛋白酶、木瓜蛋白酶,糖化酶,胰蛋白酶,以每种酶的最适条件(表1)进行酶解处理,以多糖降血糖性能及其得率考察酶解效果。

表1 酶解反应条件Table 1 Reaction conditions of enzyme

表2 复合酶解方案Table 2 Complex enzymatic hydrolysis scheme
1.4.2 复合酶加酶方式的确定 选取酶解效果较好的三种酶制剂进行复合酶解试验,分同时加入及分步加入考察加酶方式对多糖降血糖性能及其得率的影响,具体酶解方案见表2,固定总加酶量500 U/g,加酶配比1∶1∶1。其中,酶分步加入时,每种酶的反应时间相同,当一种酶反应结束后,100 ℃水浴5 min进行灭酶,冷却至室温后,重新调节反应条件,再按表加入相应的酶。
1.4.3 复合酶总加酶量的确定 在确定酶制剂种类及加酶方式的基础上,研究总加酶量(400,500,600,700,800 U/g)对黑木耳多糖体外降血糖性能及其得率的影响。
1.4.4 单因素实验
1.4.4.1 酶解时间对多糖得率及降血糖性能的影响 固定酶解温度50 ℃,酶解pH5.0,料液比1∶60 (g∶mL),考察不同酶解时间(0.5、1、1.5、2、2.5 h)对多糖得率及降血糖性能的影响。
1.4.4.2 酶解温度对多糖得率及降血糖性能的影响 固定酶解时间2 h,酶解pH5.0,料液比1∶60 (g∶mL),考察不同酶解温度(30、40、50、60、70 ℃)对多糖得率及降血糖性能的影响。
1.4.4.3 酶解pH对多糖得率及降血糖性能的影响 固定酶解时间2 h,酶解温度50 ℃,料液比1∶60 (g∶mL),考察不同酶解pH(3.0、4.0、5.0、6.0、7.0)对多糖得率及降血糖性能的影响。
1.4.4.4 料液比对多糖得率及降血糖性能的影响 固定酶解时间2 h,酶解温度50 ℃,酶解pH6.0,考察不同料液比(1∶40、1∶50、1∶60、1∶70、1∶80 g∶mL)对多糖得率及降血糖性能的影响。
1.4.5 正交优化实验 参照单因素试验,选取总加酶量、酶解温度、酶解时间、酶解pH为影响因素进行L9(43)正交实验,以多糖降血糖性能及得率为评价指标,对酶解工艺参数进行优化。
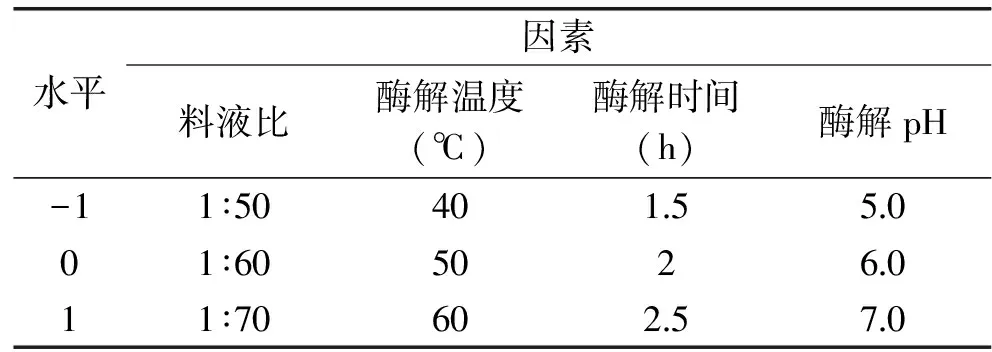
表3 正交试验因素水平表Table 3 Factors and levels of orthogonal experiment
1.5 黑木耳多糖的精制
1.5.1 脱蛋白 参照文献[21-22]的方法,略作修改,采用Sevag法对黑木耳酶解多糖和非酶解水提多糖进行脱蛋白处理,将Sevag试剂(氯仿∶正丁醇=5∶1)与黑木耳多糖水溶液以4∶1的比例混合,置于分液漏斗中,剧烈震荡后,静置30 min,保留上层水层,除去中间层及下层杂质。重复以上萃取操作四次。考马斯亮蓝法测定溶液脱蛋白前后多糖含量。根据式(1)计算多糖损失率:
多糖损失率(%)=(脱蛋白前多糖含量-脱蛋白后多糖含量)/脱蛋白前多糖含量×100
式(1)
1.5.2 脱色 参考文献[23]的方法,略作修改,采用H2O2法对黑木耳酶解多糖和非酶解水提多糖进行脱色处理。调节多糖溶液的pH至8.0(0.1 mol/L NaOH溶液),50 ℃恒温放置,缓慢加入20%体积的5%双氧水,反应2 h,直至颜色不再变化。分光光度法测定溶液脱色前后490 nm处吸光值及多糖含量。并根据式(2)、(3)计算脱色率及多糖损失率。
脱色率(%)=(脱色前吸光度值-脱色后吸光度值)/脱色前吸光度值×100
式(2)
多糖损失率(%)=(脱色前多糖含量-脱色后多糖含量)/脱色前多糖含量×100
式(3)
1.6 黑木耳多糖酶解效果分析
采用高效凝胶液相色谱对水提多糖和酶解多糖进行色谱分析,参考文献[24-25],分别精确称取水提多糖和酶解多糖1 mg,加入适量超纯水溶解,100 mL容量瓶定容,配制为1 mg/mL的溶液,0.22 μm水系滤膜过滤,进行色谱分析,得到色谱图。色谱条件:色谱柱为G2000SWXL色谱柱(300 mm×7.8 mm×5 μm);流动相为超纯水;流速为0.5 mL/min;柱温为40 ℃;柱操作压力为1.6 MPa;进样量10 μL,采用示差检测器进行检测。
1.7 指标分析
1.7.1 多糖含量及得率的计算
1.7.1.1 标准曲线的绘制 精确称取葡萄糖干燥标品2.5 mg,蒸馏水250 mL定容,制成0.1 mg/mL葡萄糖标准液。分别滴加葡萄糖标准溶液0、0.2、0.4、0.6、0.8、1.0、1.2 mL,再用蒸馏水补齐至2 mL,以2 mL蒸馏水管作为空白对照。每支试管中加入1 mL的苯酚溶液(浓度为9%),然后马上滴加5 mL浓硫酸,20 ℃放置20 min,摇匀,充分混合,再放置10 min,在490 nm处测其吸光值。以葡萄糖标准液的浓度为横坐标,吸光值为纵坐标,绘制葡萄糖标准曲线[26-27]。
1.7.1.2 样品多糖含量的测定及得率计算方法 吸取1 mL多糖提取液,蒸馏水稀释100倍制成待测溶液。利用苯酚硫酸法进行测定。根据标准曲线计算多糖含量,并根据式(4)计算多糖得率。
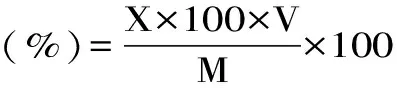
式(4)
式中:X-样品吸光值对应标准曲线上多糖含量(mg/mL);100-最终稀释后的溶液体积(mL);V-上清液体积(mL);M-黑木耳干品质量。
1.7.2 体外降血糖性能的测定
1.7.2.1 对α-淀粉酶活力抑制的测定 按照文献[28]的方法略作修改,称取α-淀粉酶5 mg,置于锥形瓶中,加入1 mL 5 mg/mL样品多糖溶液,室温放置30 min,使二者充分结合。加入15 mL 4%的可溶性淀粉溶液,30 ℃恒温震荡1 h。4500 r/min离心10 min,取上清液测定葡萄糖含量。同时做空白对照。根据式(5)计算α-淀粉酶活力抑制率:
α-淀粉酶活力抑制率(%)
式(5)
1.7.2.2 葡萄糖透析延迟指数的测定 按照文献[29]的方法略作修改,在10 mL 100 mmol/L的葡萄糖溶液中加入1 mL 5 mg/mL样品多糖溶液,均匀混合,37 ℃恒温震摇1 h后,将混合液转移到10 cm长、截留分子量为7000的透析袋中,同时做空白对照。将透析袋放于盛有150 mL去离子水的烧杯中,37 ℃恒温振摇1 h。分别在30、60 min时测定透析液中葡萄糖含量。葡萄糖的测定采用苯酚-硫酸法。根据式(6)计算葡萄糖透析延迟指数:
葡萄糖透析延迟指数(%)
式(6)
1.7.3 正交综合评分 试验以α-淀粉酶抑制率和多糖得率为双指标,参照文献[30-31],将所得数据进行归一化处理、统一数量级,对酶解效果进行综合评分。按照式(7)中计算各指标综合评分Y′ij:
式(7)
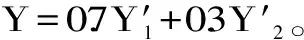
1.8 数据处理
本实验应用SPSS Statistics 20和Excel软件进行数据分析与作图,各组实验均重复三次,以平均值(mean)±标准偏差(SD)来表示。正交设计与分析采用正交设计助手软件。
2 结果与分析
2.1 标准曲线的绘制
根据葡萄糖的浓度和对应的吸光度的线性关系,可以绘制出葡萄糖标准曲线,并得到回归方程。其结果见图1。
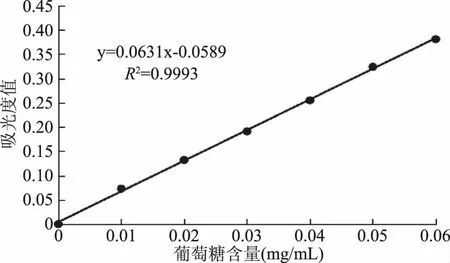
图1 葡萄糖标准曲线Fig.1 Glucose standard curve
2.2 酶制剂的筛选
由图2、图3可知,在其他条件相同时,使用糖化酶时木耳多糖对α-淀粉酶的抑制率最高,其α-淀粉酶抑制率为15.59%,优于其他酶类,同时在其作用下,木耳多糖的葡萄糖透析延迟指数相较其它酶类也有较优表现,30 min时为29.54%,60 min时为16.69%。这说明木耳多糖能有效吸附葡萄糖,具有较强的葡萄糖延迟吸收能力,随着透析时间的延长,木耳多糖对葡萄糖的吸附达到饱和,因此60 min时葡萄糖透析延迟指数较30 min时略低。因此,综合来看,糖化酶酶解后得到的木耳多糖拥有更好的降血糖性能。这可能是由于糖化酶能够水解多糖中的α-1,4和α-1,6糖苷键,多糖降解为小分子糖或寡糖,使其活性增强的缘故[32]。

图2 不同酶制剂对α-淀粉酶抑制率的影响Fig.2 Effects of different enzyme preparationson α-amylase inhibition rate
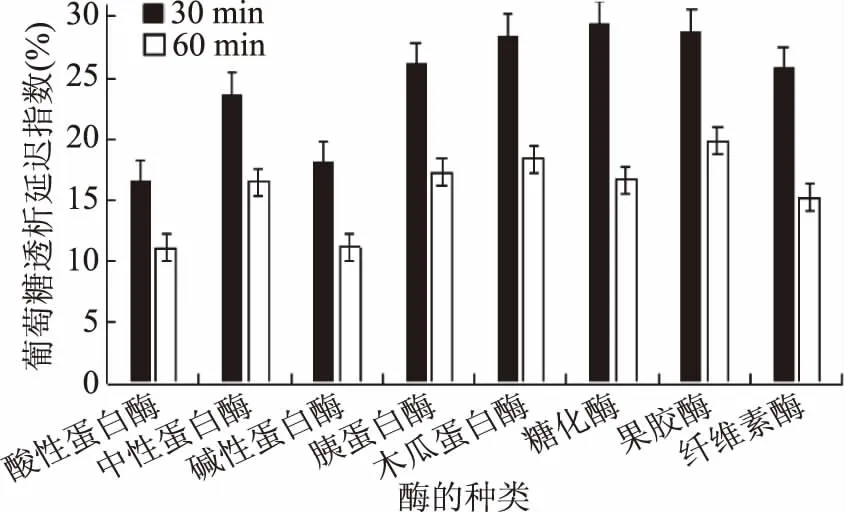
图3 不同酶制剂对葡萄糖透析延迟指数的影响Fig.3 Effects of different enzyme preparationson glucose dialysis delay index
由图4可知,使用纤维素酶时,木耳多糖的得率最高,糖化酶、果胶酶次之。由此根据以上实验结果计算综合评分,糖化酶的综合评分最高为17.50,木瓜蛋白酶和果胶酶次之,分别为15.27、14.46,且图中可以看出样本间的误差变异性不大。因此综合考虑多糖体外降血糖性能及其得率,糖化酶的作用效果最好,明显优于其他酶类。以上试验结果可能是由于酶的作用位点不同,提取出的多糖的结构与性质有所差别,造成其生物活性与得率有所不同[33]。因此,本实验选取木瓜蛋白酶、糖化酶、果胶酶复配用以进行下一部分的实验。

图4 不同酶制剂对多糖得率的影响Fig.4 Effects of different enzymepreparations on polysaccharide yield
2.3 复合酶加酶方式的确定
选取木瓜蛋白酶、糖化酶、果胶酶三种酶制剂,总加酶量500 U/g,加酶配比为1∶1∶1,分同时加入与分步加入进行加酶方式研究。酶解方案及结果见表4。

表4 复合酶提取木耳多糖的评分结果Table 4 The score of extracting polysaccharidesfrom Auricularia auricula by complex enzyme
由表4可知,根据综合得分,木瓜蛋白酶、糖化酶、果胶酶同时加入时综合得分最高,α-淀粉酶抑制率最高,体外降血糖性能最好,这可能是分步加入时三次高温灭酶处理及pH调节导致反应底物结构与性质变化所导致的结果。虽同时加入时多糖得率比果胶酶→木瓜蛋白酶→糖化酶方案略低,但α-淀粉酶抑制率最高,故选择同时加入木瓜蛋白酶、糖化酶、果胶酶同时加入的加酶方式。
2.4 复合酶总加酶量的确定
由图5可知,α-淀粉酶抑制率随总加酶量的增加而增加,总加酶量在700 U/g时,综合评分值达到最高,为21.36。多糖的α-淀粉酶抑制率为19.73%,也达到最高,此时多糖得率为25.17%。当加酶量继续增加时,α-淀粉酶抑制率呈下降趋势。因此确定总加酶量为700 U/g以进行后续实验。
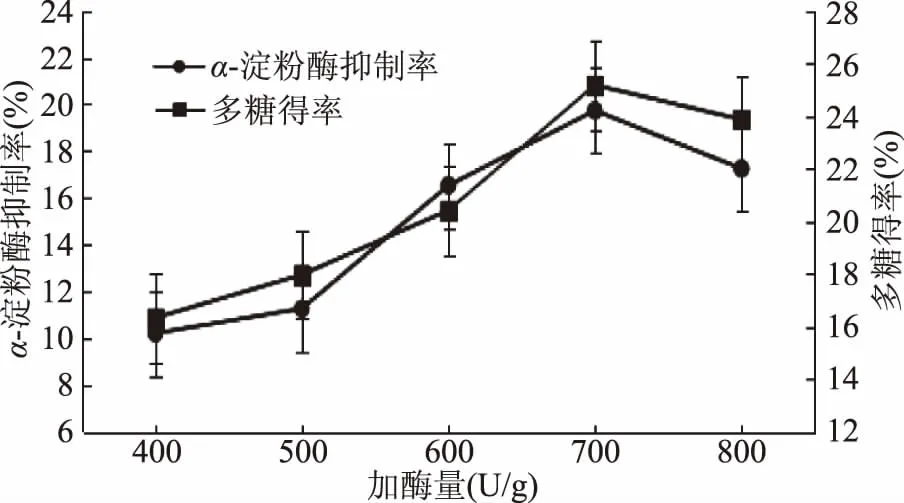
图5 总加酶量对多糖提取效果的影响Fig.5 Effect of total enzyme amounton extraction of polysaccharides
2.5 单因素试验
2.5.1 酶解时间对多糖提取效果的影响 由图6可知,随着酶解时间的延长,多糖α-淀粉酶抑制率与多糖得率均逐渐增加。酶解时间为2 h时提取效果最好,此时多糖α-淀粉酶抑制率达到最大值,为20.82%,综合评分为22.64,达到最高。当酶解时间超过2 h后,α-淀粉酶抑制率与多糖得率均呈下降趋势。所以选择最佳酶解时间为2 h。
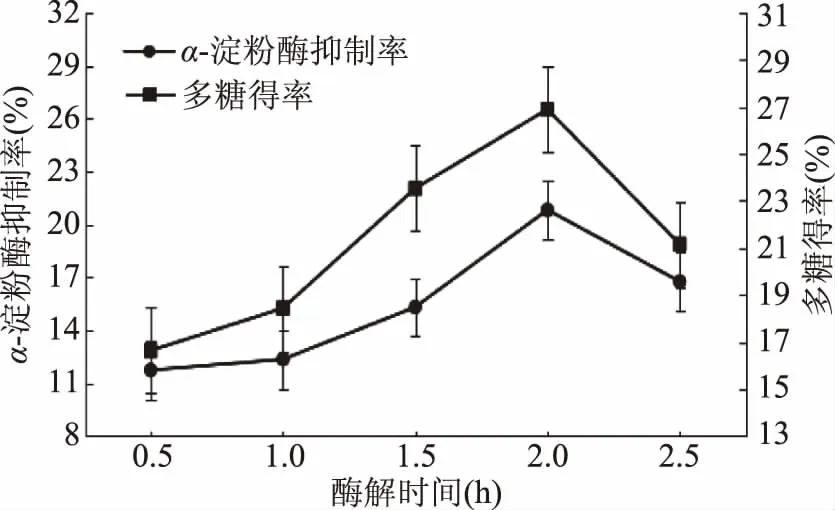
图6 酶解时间对多糖提取效果的影响Fig.6 Effect of enzymatic hydrolysis timeon extraction of polysaccharides
2.5.2 酶解温度对多糖提取效果的影响 由图7可知,α-淀粉酶抑制率随着温度的上升而增加,当温度升到50 ℃时,α-淀粉酶抑制率最高,为23.61%,此时综合评分为24.51,达到最高。当温度继续升高时,α-淀粉酶抑制率与多糖得率均呈下降趋势。所以选择最佳酶解温度为50 ℃。

图7 酶解温度对多糖提取效果的影响Fig.7 Effect of enzymatic hydrolysis temperatureon extraction of polysaccharides
2.5.3 酶解pH对多糖提取效果的影响 由图8可知,伴随着pH的升高,α-淀粉酶抑制率也不断升高,当pH为6.0时,提取效果最好,此时α-淀粉酶抑制率为26.95%,多糖得率为30.28%,综合评分为27.949。当pH继续升高时,两个指标均呈下降趋势。所以选择最佳pH为6.0。

图8 pH对多糖提取效果的影响Fig.8 Effects of pH on extraction of polysaccharides
2.5.4 料液比对多糖提取效果的影响 由图9可知,随着料液比的升高,α-淀粉酶抑制率也逐渐升高,在料液比为1∶60时提取效果最好,此时α-淀粉酶抑制率为27.98%,多糖得率为30.53%,综合评分值为28.75。料液比过高会稀释底物和酶的浓度,因此随着料液比的提高与α-淀粉酶抑制率逐渐下降。所以选择最佳料液比为1∶60。
2.6 正交优化试验
正交试验以α-淀粉酶抑制率和多糖得率为双指标,通过综合得分衡量酶解效果,试验结果如表5。

表5 正交试验结果Table 5 Results and analysis of orthogonal experiments

图9 料液比对多糖提取效果的影响Fig.9 Effect of ratio of material to liquidon extraction of polysaccharides
表5正交试验结果中,由极差R分析表明,各影响因素对综合得分的影响大小的顺序为:C>B>A>D,即时间>pH>料液比>温度。
由表6可知,各影响因素均对其综合得分的影响显著,最优组合为A2B1C1D2,即料液比1∶60、酶解pH5、酶解时间1.5 h、酶解温度50 ℃。由于正交试验中没有该水平组合,因此在此条件下进行验证性试验。验证结果为,木耳多糖的α-淀粉酶抑制率为26.72%,多糖得率为32.57%,综合评分为28.48。
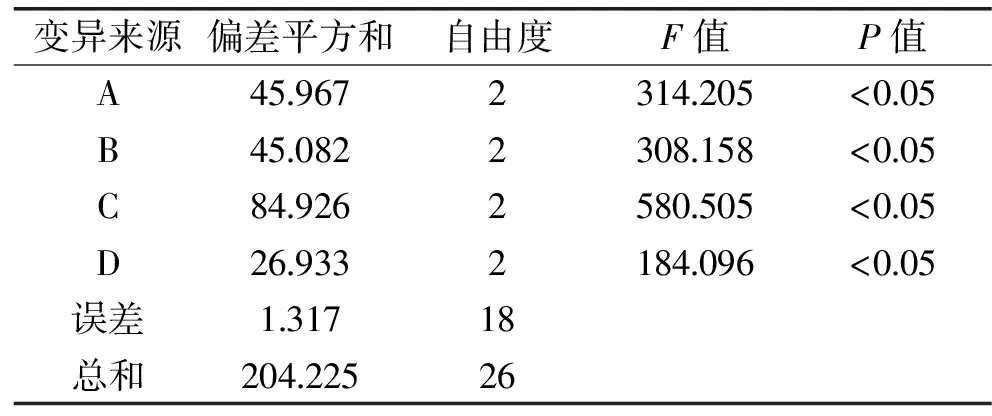
表6 正交试验方差分析表Table 6 Analysis of variance of overall index score
2.7 酶解对多糖分子质量分布的影响
采用HPGPC法检测酶解多糖和非酶解水提多糖的分子质量分布,如图10、图11所示,由于采用了示差检测器,导致信号不稳,导致图中的基线不是水平线,但并不影响色谱峰的观察。以超纯水为流动相进行洗脱,从信号峰的数量可以看出,非酶解水提多糖中有4种多糖组分,而酶解多糖中,多糖组分增多,尤其是非酶解水提多糖中保留时间为13 min的多糖组分可以明显观察到在酶解多糖中被降解为多个分子量不同的多糖组分。从图中峰面积可以看出,图10中各保留时间对应各个峰的峰面积基本都小于图11中的峰面积,这说明与非酶解水提多糖相比酶解多糖拥有更多聚合度低的小分子多糖。以上现象可能是由于酶解破坏了多糖中的糖苷键,使多糖降解为大小不一的片段[32]。因此通过分析色谱图可知在酶的作用下,黑木耳多糖确实发生了降解。
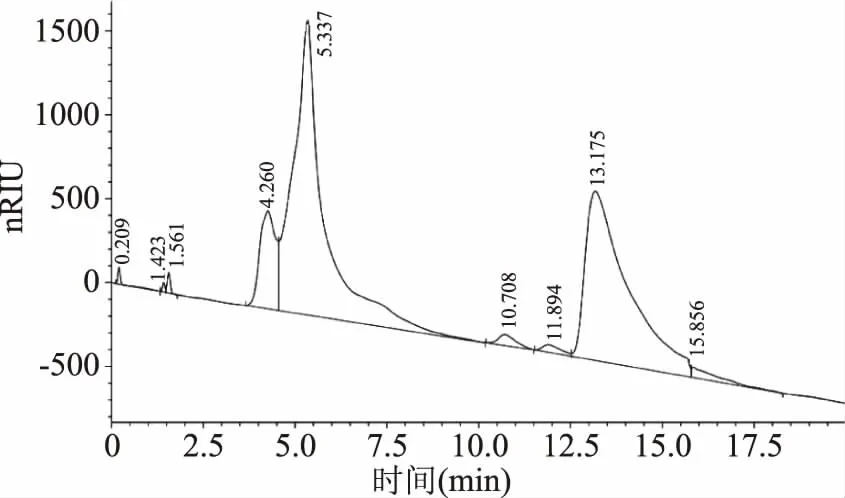
图10 非酶解水提多糖分子质量分布色谱图Fig.10 Molecular mass distribution chromatogram ofnon-enzymatic hydrolyzed polysaccharide
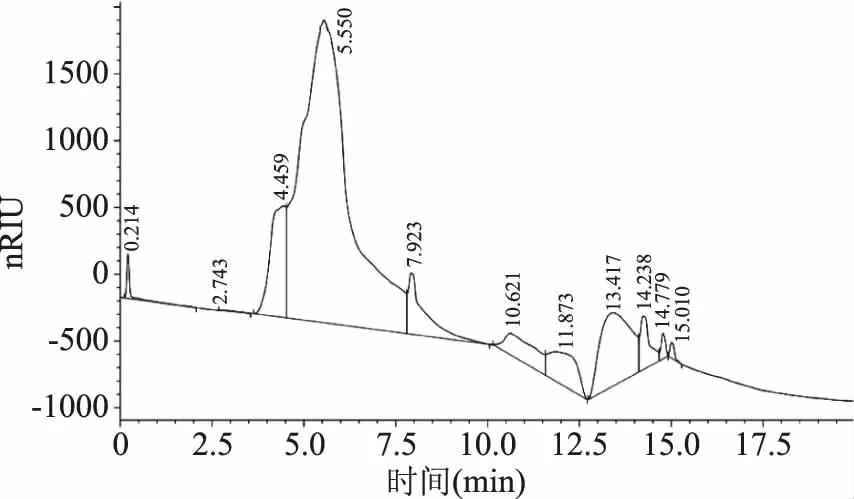
图11 酶解多糖分子质量分布色谱图Fig.11 Molecular mass distributionchromatogram of enzymolysis polysaccharide
2.8 精制黑木耳多糖的得率及降糖活性分析
利用Sevag法除去黑木耳多糖中残留的蛋白,多糖损失率为28.74%。黑木耳多糖提取液为棕黄色,经H2O2法脱色后,提取液颜色变为淡黄色,脱色率为43.15%,多糖损失率为31.27%。
测定精制后的多糖各项指标,将酶解多糖的各项指标与非酶解水提多糖进行比较,结果如表7所示。
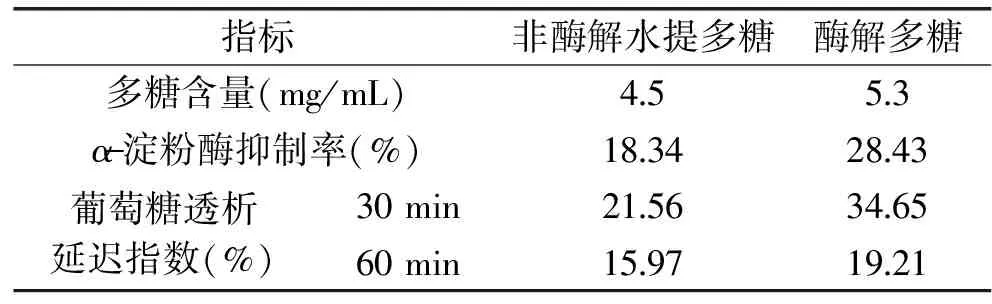
表7 多糖降糖活性及得率分析Table 7 Analysis of hypoglycemic activityand yield of polysaccharides
如表7,热水浸提法得到的木耳多糖的α-淀粉酶抑制率、葡萄糖透析延迟指数均较低,因此判断其降血糖性能较差。而酶法提取的多糖的α-淀粉酶抑制率、葡萄糖透析延迟指数较非酶解水提多糖有明显的提升,这表明利用酶法对黑木耳多糖进行生物转化能有效提高其生物活性,增强其体外降血糖能力。
因此,通过综合分析,木耳经酶处理后,其多糖组分进行了生物分解与转化,这种生物转化能使多糖有更好的生物活性,因此在木耳多糖的应用中,可以利用不同的生物酶进行木耳多糖的生物转化,并进行分离与纯化,以此获得具有良好的生物活性的木耳多糖。
3 结论
本研究以降血糖性能与木耳多糖得率为双指标,得到提取木耳多糖的最适复合酶体系为糖化酶、木瓜蛋白酶与果胶酶。在此基础上进行单因素与正交试验对提取工艺进行优化,得到的最佳提取工艺为:料液比1∶60、pH5、酶解时间为1.5 h、酶解温度为50 ℃,此时转化得到的木耳多糖得率为32.57%,α-淀粉酶抑制率为26.72%。对木耳粗多糖进行脱蛋白、脱色处理后,通过酶解多糖和非酶解水提多糖的降血糖性能分析及分子量分布分析,发现多糖在酶的作用下发生了降解,产生了更多分子量不同的多糖组分,并且其α-淀粉酶抑制率为28.43%,葡萄糖透析延迟指数30 min时是34.65%,60 min时是19.21%。这表明经酶法生物转化的木耳多糖有很好的降血糖性能,并能保持较优的得率,木耳多糖通过生物酶法部分降解达到了改性的作用。因此在多糖的应用中,可以利用不同的生物酶进行多糖的生物转化,以此获得具有良好的生物活性的多糖。
