萱草花类黄酮提取、分析及其抗氧化性研究
2019-11-27
(上海应用技术大学香料香精技术与工程学院,上海 201418)
萱草,别名黄花菜、金针花、鹿葱等,为百合科(Liliaceae)萱草属(Hemerocallis)多年草本植物[1]。萱草作为药食两用花卉,其根、茎、叶、花均可入药,其花苞通过干制得到金针菜,在中国已有2000多年的食用历史[2]。萱草花中含有多种生物活性物质,如类黄酮、内酰胺、类胡萝卜素、生物碱和甾体[3-5]等。类黄酮具有抗氧化、抗抑郁、抑菌消炎等生物活性[6-7]。研究萱草花中类黄酮提取工艺和分析检测抗氧化成分,有利于开发萱草花中类黄酮资源,可提升萱草花经济价值,拉长萱草产业化生产链。
类黄酮的常用提取方法有溶剂提取、微波提取、超声辅助提取、酶解、超临界流体萃取、双水相萃取分离、半仿生提取等[8]。超声辅助提取利用超声的空气化作用和机械震荡作用对细胞壁进行破坏,促进植物细胞中类黄酮溶出[9],可缩短提取时间,提高提取率[10]。李晓军[11]和蒋红芝等[12]利用超声辅助提取分别在金银花和砂糖橘果皮中以较高的提取率提取出了类黄酮。类黄酮分析鉴定方法主要有红外光谱、高效液相色谱、高效液相色谱-质谱联用以及核磁共振等[13]。高效液相色谱具有易操作、灵敏度高和稳定性好等优点。张元梅[14]等采用高效液相色谱法同时检测了柑橘中18种类黄酮物质,孙丽芳等[15]采用该方法分析了芦苇叶中10种类黄酮,均得到较好的分析结果。目前测定抗氧化性多为体外清除自由基实验,如清除DPPH自由基、清除羟自由基、总还原力的测定、清除超氧自由基等。岳秀洁[16]研究了三种辣木叶提取物的抗氧化性,分别测定了清除DPPH和·OH自由基能力,三种辣木叶都有较好的体外抗氧化能力,但都低于对照组VC。孙泽飞[17]的研究发现,牡丹花具有较高的清除DPPH自由基和ABTS自由基能力。目前国内对萱草花的研究主要集中在其药理活性或者色素稳定性研究,对于萱草花中类黄酮提取、分析和抗氧化性的研究较少。
本文拟采用响应面法优化萱草花类黄酮的超声辅助提取工艺,建立分析萱草花类黄酮的高效液相色谱方法,分析不同品种萱草花类黄酮含量,并以DPPH·清除率和·OH清除率为指标分析其抗氧化性。本研究旨在探究萱草花的抗氧化活性和其成分组成,为萱草花中类黄酮的利用提供理论依据。
1 材料与方法
1.1 材料与仪器
萱草花 本研究选用品种为“杜鹃”、“火凤凰”、“极地之光”的萱草花为原料,其颜色分别为黄色、橙红色和紫色,2017年06月采摘在上海应用技术大学植物园采摘上述品种萱草,-70 ℃真空冷冻干燥,粉碎后过40目筛备用;儿茶素、表儿茶素、芦丁、异槲皮素、槲皮素、柚皮素、山奈酚、橙皮素和白杨素(≥98%)标准品 德思特生物技术有限公司;1,1-二苯基-2-三硝基苯肼(DPPH) 分析纯,上海国药集团有限公司;抗坏血酸、七水合硫酸亚铁、水杨酸、甲酸 均为分析纯,上海国药集团试剂有限公司;双氧水(≥30%)、亚硝酸钠、九水合硝酸铝、氢氧化钠、甲醇、乙醇 均为分析纯,上海探索平台试剂公司;乙腈 色谱纯,上海探索平台试剂公司。
高效液相色谱仪Agilent 1260 Infinity、DAD检测器 安捷伦科技有限公司;SB-5200 DTD超声水浴锅 宁波新芝生物科技有限公司;紫外分光光度计UV-2000 上海仪电分析仪器有限公司;FD-2C真空冷冻干燥机 上海比郎仪器制造有限公司;层析柱(22 mm×300 mm) 上海探索平台试剂有限公司;RE-5203旋转蒸发仪 上海亚荣生化仪器厂;500 g摇摆式粉碎机 青州市新航机械设备有限公司。
1.2 实验方法
1.2.1 萱草花类黄酮的提取工艺流程 萱草花粉末→石油醚除去油脂→超声辅助提取→减压旋蒸→萱草花类黄酮提取液
其中,超声辅助提取按照1.2.2中的条件进行,减压旋蒸的压力为0.1 MPa,温度为50 ℃。
1.2.2 响应面法优化超声辅助提取萱草花类黄酮 本文研究超声提取工艺条件对类黄酮提取率的影响,根据前期单因素实验结果,确定超声提取功率、超声时间和乙醇体积分数这三个因素对萱草花类黄酮提取率起显著作用,采用响应面法优化确定最优提取工艺,其因素水平如表1所示。
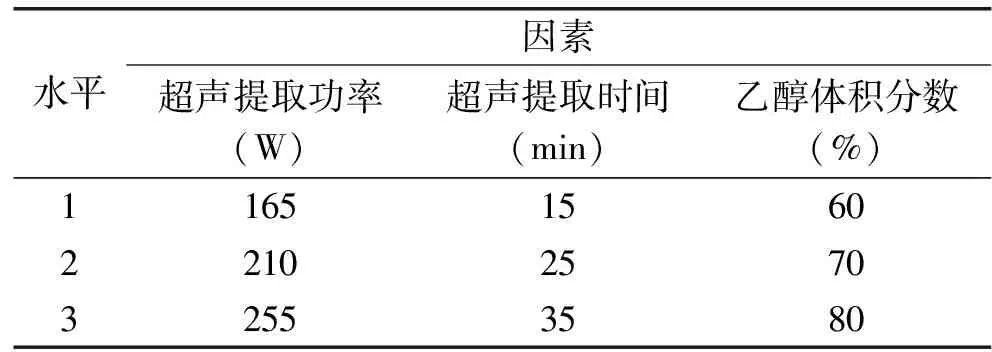
表1 超声辅助提取萱草花类黄酮的响应面试验因素水平表Table 1 Factors and levels table of response surfaceexperiment for the extraction of flavonoids from daylilyflowers by ultrasonic assisted extraction
1.2.3 萱草花类黄酮提取率的测定
1.2.3.1 芦丁标准曲线制作 参考Yang等[18]的方法,并作稍许改动。准确称量0.02 g芦丁标准品,用70%乙醇溶液溶解,定容于100 mL容量瓶中,制得0.2 mg/mL母液。分别从母液中量取1、2、3、4、5、6、7 mL于20 mL具塞试管,加入0.6 mL质量分数为5%的Na2NO2溶液,摇匀后静置6 min,加入0.6 mL质量分数为10%的Al(NO3)3溶液,摇匀后静置6 min,加入5 mL质量分数为10%的NaOH溶液,然后加去离子水定容,摇匀,静置15 min后在510 nm处测定吸光度(OD)值,以70%乙醇溶液作为空白对照。以芦丁浓度为横坐标,吸光度(OD510nm)为纵坐标绘制芦丁标准曲线。
1.2.3.2 类黄酮提取率的计算 参考马小虎等[19]索氏提取马莲种皮总黄酮方法,测定萱草花中总黄酮含量。称取一定量萱草花粉末于索氏提取器中,95 ℃回流,至索氏提取管无色为止。将提取液转移至100 mL容量瓶中,定容,按照1.2.3.1步骤测定吸光度值,计算萱草花中总黄酮含量m1(mg/g)。萱草花类黄酮提取率计算公式为:
萱草花提取液中类黄酮质量m2=(n×C×V)/m
式中,m为萱草花粉末质量(g),m1为萱草花中总黄酮含量(mg/g);m2为萱草花提取液中类黄酮含量(mg/g);n为稀释倍数;C为萱草花提取液浓度(mg/mL);V为萱草花提取液体积(mL)。
1.2.4 萱草花类黄酮提取液成分分析
1.2.4.1 标准溶液的配制 准确称量儿茶素5.5 mg、表儿茶素5.2 mg、芦丁3.9 mg、异槲皮素2.2 mg、槲皮素2.2 mg、柚皮素2.5 mg、山奈酚2.5 mg、橙皮素2.5 mg、白杨素2.2 mg于25 mL棕色容量瓶中,用80%甲醇溶液超声辅助溶解并定容,作为标准储备液,于-20 ℃冰箱保存。
1.2.4.2 高效液相色谱条件 色谱柱为ZORBAX Eclipse XDB-C18(4.6 mm×250 mm,5 μm);流动相A:水(0.1% 甲酸,V/V),B:乙腈,流速为0.8 mL/min,柱温35 ℃,进样体积10 μL;洗脱程序如表2所示。经紫外扫描确定芦丁、异槲皮素、槲皮素、山奈酚、白杨素的检测波长为254 nm;儿茶素、表儿茶素、橙皮素、柚皮素的检测波长为280 nm。
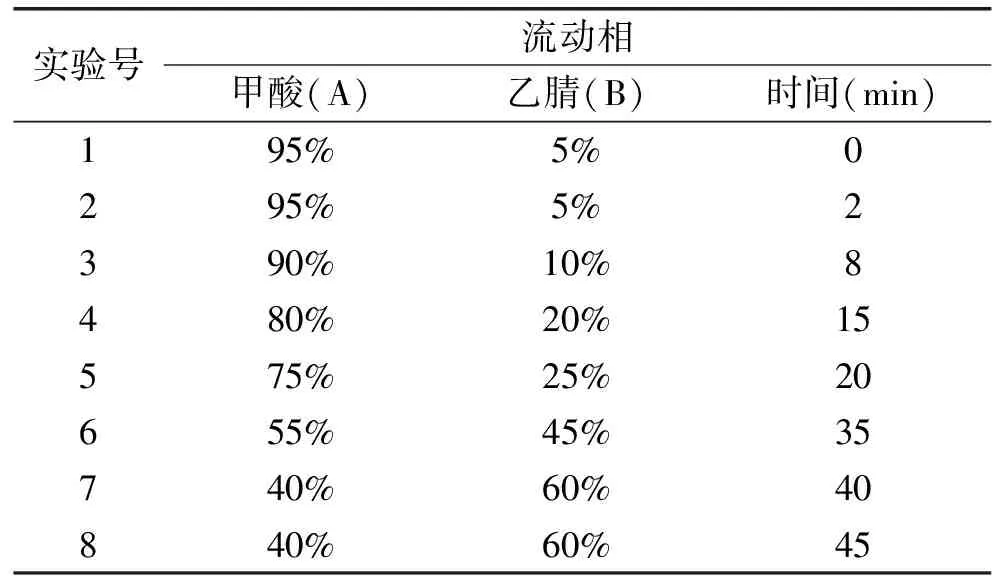
表2 高效液相色谱梯度洗脱程序表Table 2 High performance liquidchromatography gradient elution schedule
1.2.4.3 方法学考察 线性关系:用80%甲醇溶液按照倍数1、2、10、20、50、100逐级稀释并定容到10 mL容量瓶中,配制6个标准液。按照1.2.4.2色谱条件进行分析,以出峰面积为横坐标(X),质量浓度(Y)为纵坐标,绘制标准曲线,计算各个类黄酮标准曲线的线性回归方程及决定系数(R2);精密度:选取低浓度(2 μg/mL)和高浓度(50 μg/mL)两个浓度点的标准品按1.2.4.2色谱条件分别分析6次,用相对标准偏差(relative standard deviation,RSD)表示精密度;回收率:在萱草花类黄酮提取液中,分别添加10 μg/mL和50 μg/mL类黄酮标准液,平行制备三个样品,按照1.2.4.2色谱条件进行分析,根据测定结果中类黄酮成分含量,计算回收率;检出限、定量限测定:将标准液逐级稀释,按照1.2.4.2色谱条件进行分析,测定各个类黄酮的信噪比(S/N),当S/N=3即为检出限(LOD),当RS/N=10即为定量限(LOQ)。
1.2.4.4 样品中类黄酮含量的测定 将萱草花类黄酮提取液过0.22 μm滤膜,按照1.2.4.2色谱条件进行分析,采用外标法计算萱草花中类黄酮含量。
1.2.5 萱草花类黄酮提取液体外抗氧化性测定 本文采用DPPH·清除率和·OH清除率两种方法评价萱草花类黄酮提取液的体外抗氧化性。
1.2.5.1 DPPH自由基清除率测定 参照Wada等[20]的方法并略微修改。取2 mL浓度为0.1 mmol/L的DPPH溶液分别与2 mL样品稀释液和VC溶液(2、5、10、20、50、100 μg/mL)混合,避光反应30 min,在517 nm处测吸光度,记为A1;对照组为2 mL乙醇代替提取液,加入2 mL浓度为0.1 mmol/L的DPPH溶液,摇匀,避光反应30 min,在517 nm处测定吸光度,记为A2;空白对照为取各个浓度类黄酮提取液2 mL,加2 mL乙醇,避光反应30 min,在517 nm测定吸光度,记为A0。萱草花类黄酮提取液的DPPH自由基清除能力利用IC50处的样品和VC浓度折算成VC当量。
1.2.5.2 ·OH清除能力测定 参照Smirnoff等[21]、邓乾春等[22]的方法并略作修改,双氧水和二价铁发生Fenton反应生成·OH,加入水杨酸捕捉·OH并产生有色物质,在510 nm处有最大吸收峰。取2 mL样品稀释液和VC溶液(40、60、80、100、200、400 μg/mL)分别加入0.5 mL浓度为9 mmol/L的水杨酸,然后加入0.5 mL浓度为9 mmol/L的硫酸亚铁,最后加入0.5 mL浓度为8.8 mmol/L双氧水启动反应,反应30 min,在510 nm测定吸光度,记为A1。空白对照用0.5 mL水替代双氧水,测定吸光度记为A0。本底吸收为用水代替类黄酮提取液,测定吸光度记为A2。萱草花类黄酮提取液的·OH清除能力利用IC50处的样品和VC浓度折算成VC当量。
1.3 数据分析
用Design Experet 8.0软件进行响应面试验及分析,数据采用Origin Pro 9.0和SPSS 18.0软件进行数据分析。
2 结果与讨论
2.1 标准曲线建立及总黄酮含量测定结果
把一系列的芦丁浓度(X)和吸光度(Y)做拟合,得到回归方程为Y=11.927X+0.0013,R2=0.9992。通过标准曲线计算得萱草花中总黄酮含量m1为51.69±1.29 mg/g。
2.2 响应面优化萱草花类黄酮提取工艺
2.2.1 响应面试验设计及结果 用Design Experet 8.0软件设计响应面试验,共有17个实验点,其中12个为分析点,5个中心点来评估实验误差。自变量X1为乙醇体积分数(%)、X2为超声功率(W)、X3为超声时间(min),响应值Y为类黄酮提取率(%)。响应面试验设计及结果如表3所示。
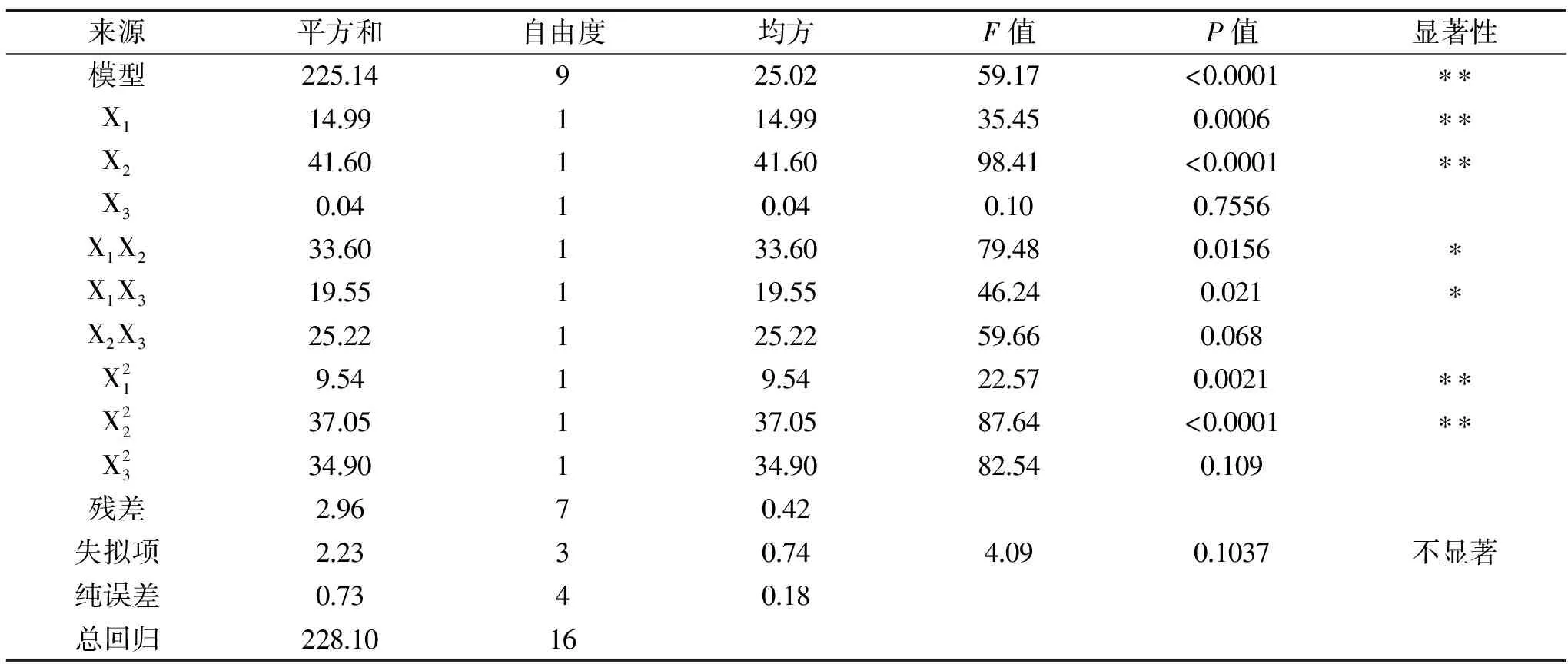
表4 响应面回归模型方差分析表Table 4 ANOVA for response surface quadratic model
注:**表示极显著(P<0.01);*表示显著(P<0.05)。
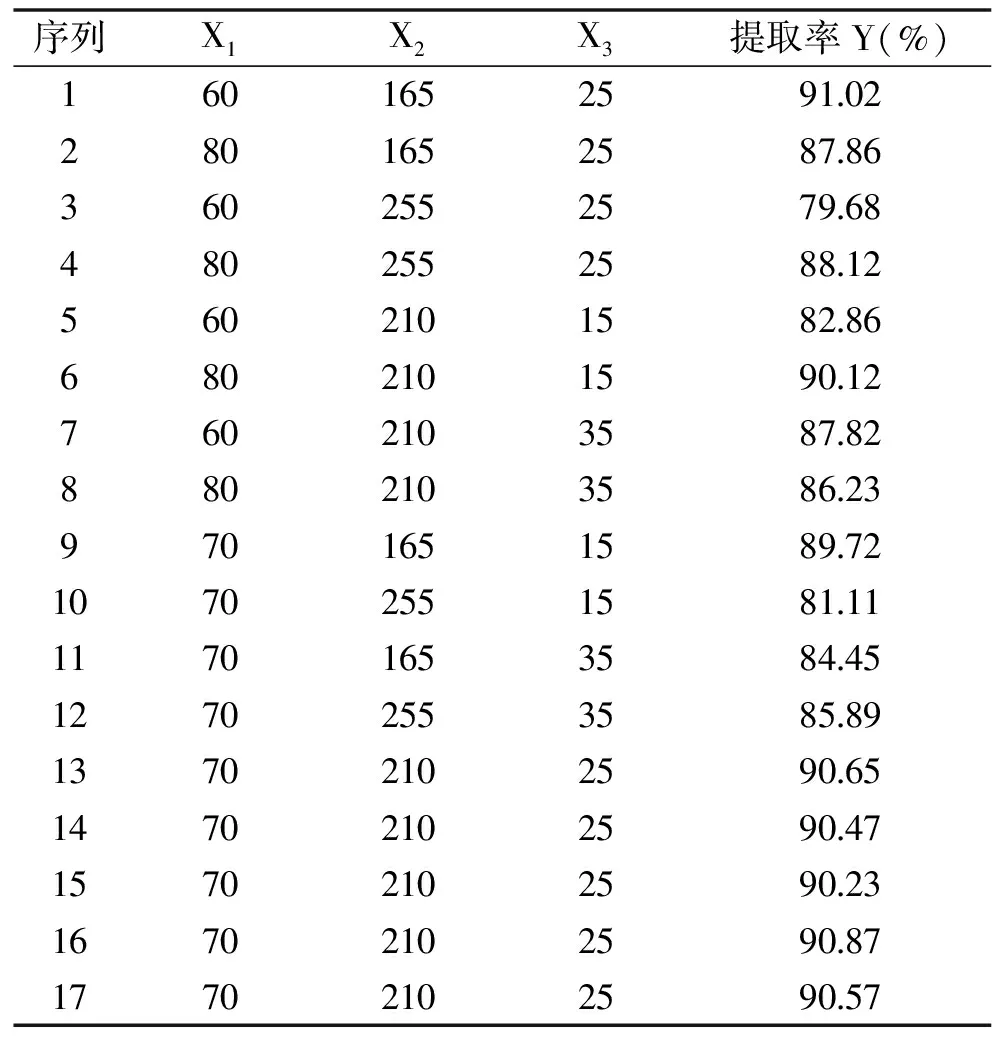
表3 响应面试验设计及结果Table 3 Design and results of response surface experiment
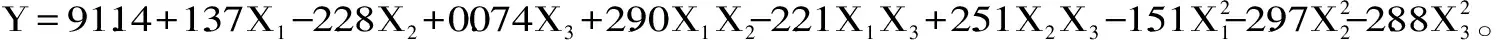

2.2.3 响应曲面分析 通过多元回归模型,进行两因素交互分析,可以得到两因素对类黄酮提取率影响的响应面及等高线图,如图1所示。
对于响应面来说,其坡面越陡峭,则两因素水平改变对响应值影响就越大。等高线图中一条曲线上的数值是相同的,其呈椭圆形或排列紧密,则表明两因素对响值影响较大,其呈圆形或排列疏松,则两因素对响应值影响较小[23-24]。由图1(a)可知,其响应面比较陡峭,乙醇体积分数和超声功率的变化对响应值影响较大,当超声时间处于最佳值时,乙醇体积分数(X1)和超声功率(X2)的等高线呈椭圆形,说明两者交互作用比较显著;由图1(b)可知,其响应面比较陡峭,乙醇体积分数和超声时间的变化对响应值影响较大,超声功率处于最佳值时,乙醇体积分数(X1)和超声时间(X3)的交互曲线呈椭圆形,说明两者交互作用比较显著;由图1(c)可知,超声功率(X2)和超声时间(X3)等高线呈圆形,则两因素交互效果不明显。
2.2.3 最优条件及验证 利用软件Design-Expert 8.0对响应面模型进行解析,得到最优条件为乙醇体积分数为73.16%,超声功率为194.78 W,超声时间为22.44 min,预测类黄酮提取率为91.73%。根据实际操作稍作修改,则最优条件为:乙醇体积分数为75%,超声功率198 W,超声时间23 min,在此工艺条件下,进行3次重复实验,得到实验萱草花中类黄酮提取率为91.15%,相对标准偏差(RSD)为0.686%,与预测值较接近,说明该模型能较好地预测萱草花类黄酮提取率。
2.3 基于HPLC法萱草花类黄酮组分及其含量分析
2.3.1 方法学考察结果
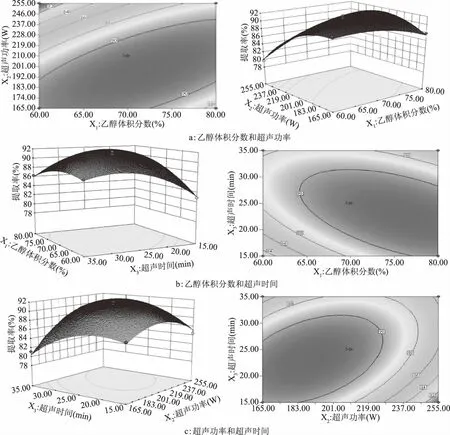
图2 各因素交互作用对萱草花类黄酮提取率影响的响应面和等高线Fig.2 Response surface and contour line of the interaction of various factors on the extraction rate of flavonoids from daylily flowers

表4 响应面回归模型方差分析表Table 4 ANOVA for response surface quadratic model
注:**表示极显著(P<0.01);*表示显著(P<0.05)。
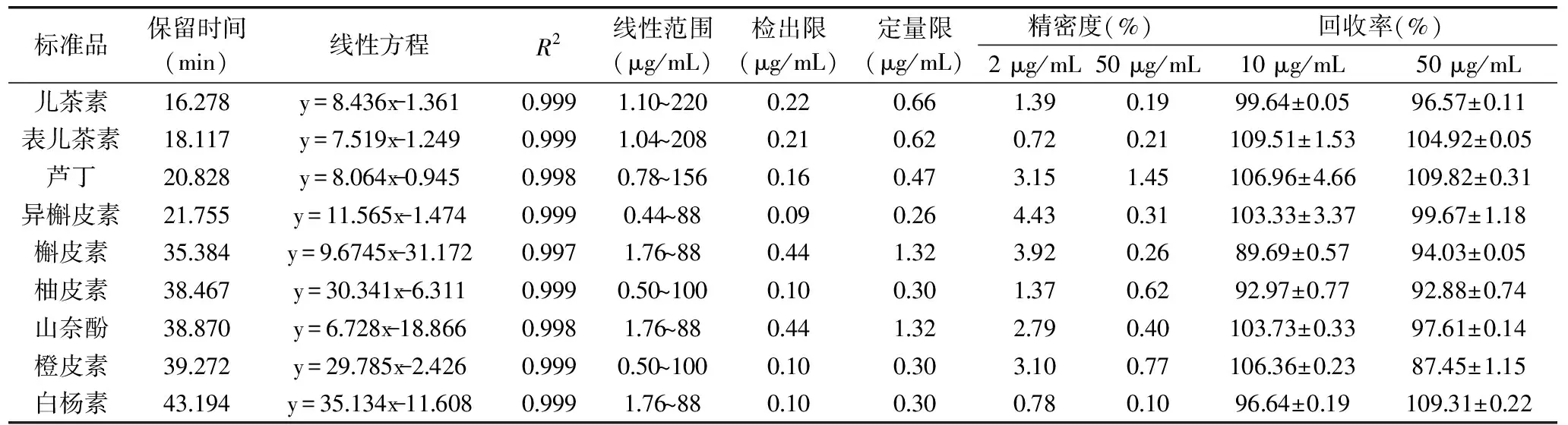
表5 9种标准品的线性方程、线性系数、浓度范围、检出限、定量限、精密度和回收率Table 5 Linear equation,linear coefficient,concentration range,detection limit,quantitative limit,precision and recovery rate of nine standard products

表6 三种萱草花中类黄酮含量Table 6 Flavonoid content in three kinds of daylily flower
注:同列字母不同表示显著性差异(P<0.05)。2.3.1.1 线性范围、检出限、定量限 儿茶素、表儿茶素、芦丁、异槲皮素、柚皮素、槲皮素、橙皮素、山奈酚、白杨素的线性方程如表5所示,结果表明在线性范围内,线性良好。9种类黄酮的检出限和定量限如表5所示,检出限0.09~0.44 μg/mL,定量限为0.26~1.32 μg/mL,其中异槲皮素的检出限和定量限最低,分别为0.09、0.26 μg/mL。
2.3.1.2 精密度实验结果 如表5所示,9种类黄酮检测的相对标准偏差RSD<5%,说明该方法精密度良好。
2.3.1.3 回收率实验结果 计算9种类黄酮的加标回收率,回收率结果如表5所示,除槲皮素在10 μg/mL时的加标回收率为89.69%和橙皮素在50 μg/mL时的加标回收率为87.45%外,其他7种类黄酮的回收率都在90%以上,说明所建立高效液相色谱方法的回收率良好。
2.3.2 三种萱草花类黄酮组成及其含量 将三种萱草花的类黄酮提取液进行高效液相色谱分析,柚皮素含量液相出峰较低,未在图中标出,其液相色谱图见图2,三种萱草花中类黄酮的含量见表6。
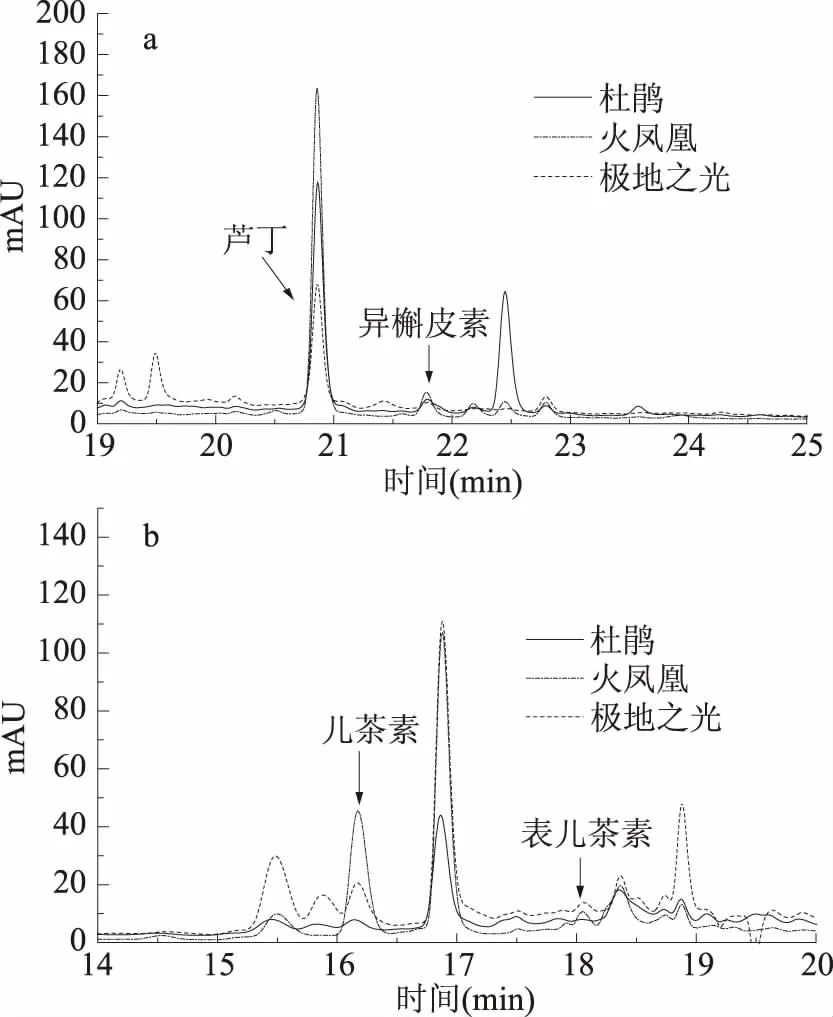
图2 三种萱草花类黄酮提取液的液相色谱图Fig.2 High Performance liquid chromatography offlavonoid extracts from three kinds of daylily flowers注:a、b分别为254、280 nm液相色谱图。
由图2液相色谱图可知,三个品种萱草花中的类黄酮能够清晰分离。通过高效液相色谱法对三个品种萱草花的类黄酮提取液进行分析,结果如表6所示。由表6可知,萱草花中提取液中成分为儿茶素、表儿茶素、芦丁、异槲皮素和柚皮素,其中芦丁和儿茶素含量较多。三种萱草花中芦丁含量最高,对芦丁而言,“火凤凰”的含量最高(5068.93 μg/g),是“杜鹃”含量的1.4倍、“极地之光”的2.2倍;对儿茶素而言,“火凤凰”中儿茶素是“杜鹃”9.5倍、是“极地之光”的8.4倍。
2.3 三种萱草花类黄酮提取液的抗氧化活性
配制三个品种萱草花的不同浓度的提取液,测定DPPH·清除率和·OH清除率,结果如图3所示。由图3a可知,萱草花类黄酮有较强的清除DPPH自由基能力,且在一定浓度范围内萱草花类黄酮对DPPH·清除能力呈显著的量效关系,这与唐巧玉等[25]和张灿等[26]研究类黄酮抗氧化的结论相似。不同品种的萱草花的清除DPPH自由基能力不同,“杜鹃”、“ 极地之光”和“ 火凤凰”这三种萱草花(每g干重)的清除DPPH自由基能力分别等效于10.88、24.22、17.55 mg VC。测定一系列不同浓度的类黄酮和VC的清除·OH自由基能力,分别得出IC50并折算成VC当量,“杜鹃”、 “极地之光” 和“火凤凰”三种萱草花(每g干重)等效于41.97、38.02、35.38 mg VC。在孙泽飞[15]对牡丹花类黄酮研究的过程中发现,植物抗氧化能力不是单独某种化合物的作用,而是存在植物体内所有类黄酮共同作用的结果。类黄酮结构上为多羟基酚类物质,有很强的供氢能力,萱草花类黄酮具有清除DPPH·和·OH能力,可作为一种天然抗氧化剂的原料。
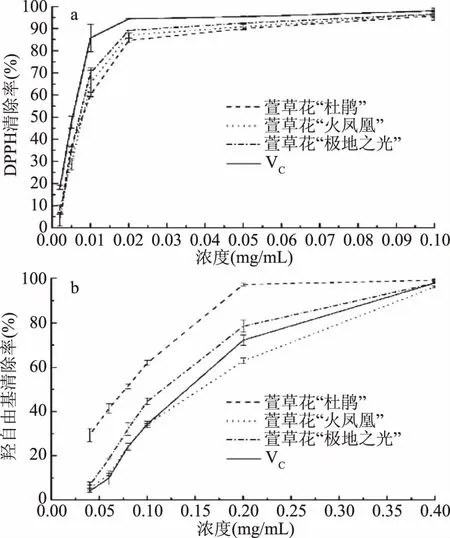
图3 萱草花提取液的抗氧化活性Fig.3 Antioxidant activity of the extracts from daylily flower
3 结论
本研究通过响应面法优化出萱草花类黄酮提取的最佳工艺条件为乙醇体积分数75%、超声功率198 W、超声时间23 min,在此条件下类黄酮的提取率为91.15%。本研究建立的萱草花类黄酮高效液相色谱分析法的回收率在80%~110%之间,相对标准偏差RSD<5%。采用此方法分析三个品种萱草花,得到其主要类黄酮为儿茶素、表儿茶素、芦丁、异槲皮素和柚皮素,其中芦丁和儿茶素含量较多。本研究测定了三个品种萱草花的体外抗氧化性,“杜鹃”、“ 极地之光”和“ 火凤凰”三种萱草花(每g干重)DPPH·清除能力等效于10.88、24.22、17.55 mg VC,·OH清除能力等效于41.97、38.02、35.38 mg VC,表明萱草花可作为一种天然抗氧化剂资源被深度开发利用。
