冠突散囊菌发酵杜仲茶的工艺优化
2019-11-27,*
,*
(1.郑州轻工业大学食品与生物工程学院,河南郑州 450002;2.食品生产与安全河南省协同创新中心,河南郑州 450002;3.河南省冷链食品质量安全控制重点实验室,河南郑州 450002)
杜仲(EucommiaulmoidesOliv.)是我国特有的经济树种和名贵中药材,具有调血压、降血糖、抗菌、调血脂、抗病毒、抑制肿瘤细胞生长等功能,能够延缓衰老、滋阴补肾、美容养颜和强壮筋骨[1]。研究表明,杜仲叶含有丰富的营养成分,其中绿原酸、桃叶珊瑚苷等主要活性物质含量是皮中含量的数倍。并且,在降血压、抗衰老、补肝肾、助减肥等方面,杜仲叶的功效比杜仲皮更优[2]。
杜仲茶是以杜仲叶为原料,经传统的茶叶生产工艺制作而成的健康饮品。目前,杜仲茶的研究主要集中在工艺优化、品质分析、功能性分析等方面,王太霞等[3]研究了不同加工工艺所生产的杜仲茶的化学成分,探索出提高活性成分含量的最优工艺。Dong等[4]研究了微波干燥对杜仲雄花茶功能性成分的影响,发现通过微波干燥技术制成的杜仲雄花茶茶汤橙黄明亮,滋味醇厚。周继荣等[5]比较了炒青、蒸青、烫青和微波杀青4种杀青技术对杜仲绿茶品质的影响,发现微波杀青效果较好。黄友谊等[6]通过研究发现杜仲茶含有丰富的营养成分和功能活性成分,并具有显著保健功能。刘梦培等[7]研究了发酵对杜仲茶活性成分及抗氧化性能的影响,结果表明发酵可以提高杜仲叶茶的品质性能。相关研究表明,采用混合型高脂血症动物模型研究杜仲茶的辅助降血脂功能,发现杜仲茶辅助降血脂功能显著[8]。
冠突散囊菌是茯砖茶中有益微生物,又被称作金花菌,“金花”的数量和质量往往直接决定了茯砖茶的品质[9]。其代谢产物能有效地调节人体新陈代谢,并有较强的降脂、降压、调节糖类代谢的功效,对人体无毒无害[10]。肖文军等[11]研究了速溶茯茶对雌雄大鼠的毒理特性,结果表明茯茶对雌雄大鼠无明显毒副作用,属实际无毒物。王志刚[12]用卤虫生物法对冠突散囊菌进行毒性实验,在蔗糖酵母浸汁培养基上培养,结果10株冠突散囊菌菌体提取物均未发现明显产毒,从而进一步证实了冠突散囊菌无毒。近年来,关于冠突散囊菌发酵茶的研究很多,主要在冠突散囊菌的发酵条件,发酵作用等方面。欧阳梅[13]选用炒青绿茶作为茶坯,人工接种冠突散囊菌,制成一种新型的黑散茶。Chenkai等[14]选用冠突散囊菌发酵普洱茶,研究发酵作用对茶叶化学成分及降脂作用的影响,结果表明经发酵后的茶叶的茶多酚和氨基酸含量显着降低,而黄酮类总量显着增加,且降脂作用显著增强。秦俊哲等[15]利用冠突散囊菌发酵剂制作茯砖茶,发现茶多糖、水浸出物和茶褐素含量上升,感官评定结果显示“发花”对茯砖茶的品质形成有促进作用。Yao等[16]研究分析了不同发酵温度下茯砖茶的没食子酸含量和抗氧化性能,发现适当提高发酵温度使发酵后的茶叶没食子酸含量和抗氧化特性显著升高。
目前,杜仲茶的制作工艺大多采用传统制茶工艺,加工方法较为单一,口感多有青草的涩味;而采用人工接种冠突散囊菌发酵工艺制作杜仲茶的研究未见报道,本文拟通过接种冠突散囊菌于杜仲绿毛茶上,制成冠突散囊菌发酵茶,并对发酵关键工艺进行优化,得到富含活性成分的杜仲茶,为以后的应用提供一定的实践指导意义。
1 材料与方法
1.1 材料与仪器
杜仲叶 在河南泡桐中心院内进行的采摘,进行实验的叶子是经过挑选的无斑点,无枯萎状的杜仲叶;冠突散囊菌(Eurotiumcristatum2650) 中国工业微生物菌种保藏管理中心;PDA琼脂培养基 北京奥博星生物技术责任有限公司;绿原酸对照品 上海源叶生物科技有限公司;无水乙醇、甲醇 天津市富宇精细化工有限公司。
JJ223BC型电子天平 常熟市双杰测试仪器厂;MB23红外水分测定仪 奥豪斯仪器(常州)有限公司;LDZX-50KBS立式压力蒸汽灭菌锅 上海申安医疗器械厂;HZQ-F160型全温震荡培养箱 江苏太仓试验实验设备厂;M1-L201B微波炉 广东美的厨房电器制造有限公司;101-2型电热鼓风干燥箱 天津市泰斯特仪器有限公司;T6新世纪紫外可见分光光度计 北京普析通用仪器有限责任公司;HWS型恒温恒湿箱 上海精宏实验设备有限公司;DNP-9052A培养箱 上海鸿都电子科技有限公司;KQ-700DE型超声波清洗机 昆山市超声仪器有限公司。
1.2 实验方法
1.2.1 冠突散囊菌孢子悬液的制备 将在PDA培养基中保存的菌种在28 ℃下培养4 d,用接种环挑取菌落溶于有10 mL无菌水且带有玻璃珠的三角瓶内,于28 ℃,150 r/min条件下振荡培养30 min,制得均匀的孢子悬液,浓度为(1~10)×103cfu/mL。
1.2.2 发酵茶的工艺流程[17-18]原料选择→一次汽蒸→渥堆→调节含水量→二次汽蒸→接种→培养发花→干燥→成品
工艺要点:一次汽蒸:将挑选好的茶叶在立式压力蒸汽灭菌锅中121 ℃下汽蒸10 min;渥堆:将湿热状态下的茶叶在特定温湿度的恒温恒湿培养箱中进行渥堆;调节含水量:向渥堆后的茶叶加蒸馏水以调节水分含量,用红外水分测定仪测定水分含量;二次汽蒸:将调节好水分含量的茶叶以10 g分装,用立式压力蒸汽灭菌锅在121 ℃下汽蒸20 min;接种:在无菌操作台上将灭菌后的茶样冷却后,接种冠突散囊菌孢子悬浮液;培养发花:将接种后的茶叶置于28 ℃,75%湿度的恒温恒湿培养箱培养。
1.2.3 单因素实验
1.2.3.1 发酵天数对茶叶的影响 将10 g绿毛茶经过一次汽蒸10 min后,50 ℃渥堆2 h,含水量控制为35%,搅拌均匀后封口,灭菌后进行无菌接种,菌种的接种量是原料重量的20%,在28 ℃条件下发酵。发酵天数分别设定在6、7、8、9、10 d,对茶叶的发花情况以及冠突散囊菌孢子数量进行检测,并对茶叶中绿原酸的含量进行测定。
1.2.3.2 含水量对茶叶的影响 将10 g绿毛茶经过一次汽蒸10 min后,50 ℃渥堆2 h,将含水量分别调至25%、30%、35%、40%、45%。搅拌均匀后封口,灭菌后进行无菌接种,菌种的接种量是原料重量的20%,在28 ℃条件下发酵。发酵7 d后对茶叶的发花情况以及冠突散囊菌孢子数量进行检测,并对茶叶中绿原酸的含量进行测定。
1.2.3.3 接种量对茶叶的影响 将10 g绿毛茶经过一次汽蒸10 min后,50 ℃渥堆2 h,将含水量控制为35%,搅拌均匀后封口,灭菌后进行无菌接种,菌种的接种量是分别为原料重量的17%、18%、19%、20%、21%。在28 ℃条件下发酵。发酵天数7 d后对茶叶的发花情况以及冠突散囊菌孢子数量进行检测,并对茶叶中绿原酸的含量进行测定。
1.2.3.4 渥堆温度对茶叶的影响 将10 g绿毛茶经过一次汽蒸10 min后,分别在30、35、40、45、50 ℃渥堆2 h,将含水量控制为35%,搅拌均匀后封口,灭菌后进行无菌接种,菌种的接种量是原料重量的20%。在28 ℃条件下发酵。发酵天数7 d后对茶叶的发花情况以及冠突散囊菌孢子数量进行检测,并对茶叶中绿原酸的含量进行测定。
1.2.3.5 渥堆时间对茶叶的影响 将10 g绿毛茶经过一次汽蒸10 min后,50 ℃下分别渥堆1、2、3、4 h后,将含水量控制在35%,搅拌均匀后封口,灭菌后进行无菌接种,菌种的接种量是原料重量的20%。在28 ℃条件下发酵。发酵天数7 d后对茶叶的发花情况以及冠突散囊菌孢子数量进行检测,并对茶叶中绿原酸的含量进行测定。

表2 发酵天数对茶叶孢子数和绿原酸含量的影响Table 2 Effect of Fermentation Days on the Number of Spores and Chlorogenic Acid Content of the tea
注:同一列不同字母表示有显著差异(P<0.05)。1.2.4 正交试验 在单因素试验基础上,选用对发花影响因素较大的4个因素(接种量、含水量、渥堆时间和渥堆温度),以冠突散囊菌孢子数以及绿原酸含量为指标,对发花工艺参数进行优化。由于2个指标对冠突散囊菌发酵茶叶品质的贡献不一样,采用多指标加权综合评分法进行分析[19]。因此,将孢子数、绿原酸含量的权重系数分别设定为0.6、0.4,最高100分,最低0分,综合评分=(孢子数)×0.6+(绿原酸含量)×0.4,以综合评分进行统计分析。因素水平表如表1所示。
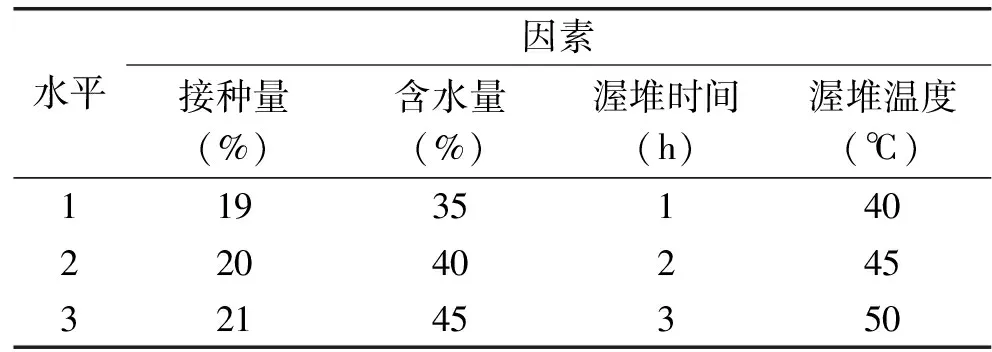
表1 L9(34)正交试验因素水平表Table 1 L9(34)Factor level table of orthogonal test
1.2.5 指标测定
1.2.5.1 孢子数的检测 发酵结束后,按照GB/T 9833.3-2013《茶取样》[20]的规定取样。每组每个接种量取1个样品,每个样品取1.00 g茶叶浸于装有玻璃珠的100 mL灭菌蒸馏水中,在恒温振荡器中150 r/min振摇45 min混匀,使冠突散囊菌的孢子能够均匀的扩散,对冠突散囊菌进行计数[21]。
1.2.5.2 绿原酸含量的测定[22]对照品溶液的制备:精密称取绿原酸对照品2.5 mg,置于100 mL棕色容量瓶中,加入70%甲醇溶液定容至刻度,制成浓度为25 μg/mL的绿原酸对照品溶液。
样品溶液的制备:精密称取样品0.1000 g于10 mL离心管,加入3 mL 70%甲醇提取,在超声功率70%下超声30 min,取出上清液,残渣再用3 mL 70%甲醇提取,合并两次提取液,在7000 r/min下离心15 min,取出上清液,用70%甲醇定容到50 mL容量瓶中。
标准曲线的绘制:精密吸取绿原酸对照品溶液0、0.5、1.0、1.5、2.0、2.5 mL,分别置于10 mL离心管中,加70%甲醇定容到刻度,配成不同质量浓度的绿原酸标准品溶液,用紫外分光光度计选取绿原酸最大吸收波长327 nm下测其吸光度,70%的甲醇溶液为空白对照,以吸光度为纵坐标,绿原酸标准液浓度为横坐标,绘制标准曲线。
样品液含量的测定:吸取样品溶液0.5 mL置于10 mL离心管中,用70%甲醇定容,70%甲醇为空白对照,于327 nm下测量吸光度,计算绿原酸的含量。
1.3 数据分析
每个试验测定3次,测定结果以平均值±标准差表示。采用SPSS 22统计软件进行数据处理,P<0.05表示差异显著。
2 结果与分析
2.1 发酵天数对茶叶冠突散囊菌孢子数及绿原酸含量的影响
冠突散囊菌的生长受发酵天数的影响,由表2可知,随着发酵天数的增长,冠突散囊菌孢子数呈增加趋势,且发花情况逐渐变好。但8 d后,孢子数增长速率降低并趋于平缓,之后进入生长平缓期,说明此时冠突散囊菌的有性繁殖能力降低,生化等活动能力下降。
由表2可知,发酵第6 d时绿原酸含量最高,第8天次之,呈降低趋势。可能是因为冠突散囊菌在生长旺盛时分泌多酚氧化酶,而绿原酸是由咖啡酸(Caffeic acid)与奎尼酸(Quinicacid)生成的缩酚酸,与儿茶素等酚酸类物质有相似的官能团,所以导致绿原酸含量的减少[23]。随着发酵时间的增长,氧气逐渐减少,又减缓了氧化反应的发生,所以绿原酸含量出现浮动。综合考虑,且为了减少发酵的时间成本,故选择8 d发酵结束。
2.2 含水量对茶叶冠突散囊菌孢子数及绿原酸含量的影响
含水量是微生物生长繁殖和进行代谢活动的重要媒介,也是冠突散囊菌生长繁殖所必需的条件[24]。由表3可知,当含水量低于35%时,冠突散囊菌生长情况较差,颗粒不够饱满,颜色较浅,孢子数量较少,说明含水量过少,不利于冠突散囊菌的生长繁殖。当含水量高于45%时,冠突散囊菌生长茂盛,分布均匀,但滋生杂菌,且孢子数减少。

表3 含水量对茶叶孢子数和绿原酸含量的影响Table 3 Effect of water content on the number of spores and the content of chlorogenic acid of the tea
注:同一列不同字母表示有显著差异(P<0.05)。

表4 接种量对茶叶孢子数和绿原酸含量的影响Table 4 Effect of inoculum quantity on the number of spores and chlorogenic acid content of the tea
注:同一列不同字母表示有显著差异(P<0.05)。

表5 渥堆温度对茶叶孢子数和绿原酸含量的影响Table 5 Effect of stacking temperature on the number of spores and chlorogenic acid content of the tea
注:同一列不同字母表示有显著差异(P<0.05)。
含水量对绿原酸含量的影响显著,含水量为25%时,绿原酸含量最高,且随着含水量的增加,绿原酸含量呈降低趋势,含水量45%时,绿原酸含量最低。可能由于随着含水量的升高,冠突散囊菌大量繁殖,分泌多酚氧化酶,大量消耗底物,导致绿原酸含量的降低[25]。
2.3 接种量对茶叶冠突散囊菌孢子数量及绿原酸含量的影响
接种量是影响冠突散囊菌发花情况的一个重要指标,接种量的多少直接影响到发花的好坏。接种量越多,越易形成优势菌种,生成特有的成分。但由于底物是有限的,若接种量过大,则会影响微生物的生长繁殖。由表4可知,随着接种量的增加,孢子数呈增加的趋势,且发花情况越来越好,当接种量为20%时,冠突散囊菌生长情况较好,金花颗粒饱满,颜色金黄,分布均匀,且孢子数较多。而当接种量为21%时,冠突散囊菌孢子数的增加量是减少的,说明此时微生物对茶叶底物的利用已经达到饱和,微生物自身的生长繁殖也受到限制。
茶叶中多酚类物质在氧气和多酚氧化酶的作用下氧化成邻醌类,可能是由于在发花过程中,由于环境的封闭,导致氧气逐渐减少,从而减缓氧化反应的发生,减少绿原酸含量的降解[26]。所以随着接种量的增加,绿原酸含量有些许增加。
2.4 渥堆温度对茶叶冠突散囊菌孢子数及绿原酸含量的影响
渥堆的温度不仅影响茶叶中微生物的生长代谢速率与酶的活性,还影响着茶叶微生物的种群与数量,从而导致茶叶内含成分的差别。由表5可知,当低于45 ℃时,冠突散囊菌的数量随着渥堆温度的增加而增加,且发花情况越来越好,可能是当渥堆温度较高时,能够使叶片更好地保持湿热作用,且促进微生物的新陈代谢[27];当温度高于45 ℃时,孢子数数量是增加的,但增长速率降低,说明此时已不能为微生物的生长提供较好的环境。
由表5可知,随着渥堆温度的升高,绿原酸含量逐渐升高。可能是因为较高的渥堆温度抑制了茶叶中多酚氧化酶的活性,减少了茶叶内物质的转化[28],但在发花期间,冠突散囊菌也会分泌多酚氧化酶,会使绿原酸的含量有所降低。综合两种作用之后对于绿原酸含量的升高,其机理有待进一步研究。
2.5 渥堆时间对茶叶冠突散囊菌孢子数及绿原酸含量的影响
渥堆时间的长短是影响茶叶的物质转化的重要影响因素。

表6 渥堆时间对茶叶孢子数和绿原酸含量的影响Table 6 Effect of stacking time on the number of spores and chlorogenic acid content of the tea
注:同一列不同字母表示有显著差异(P<0.05)。
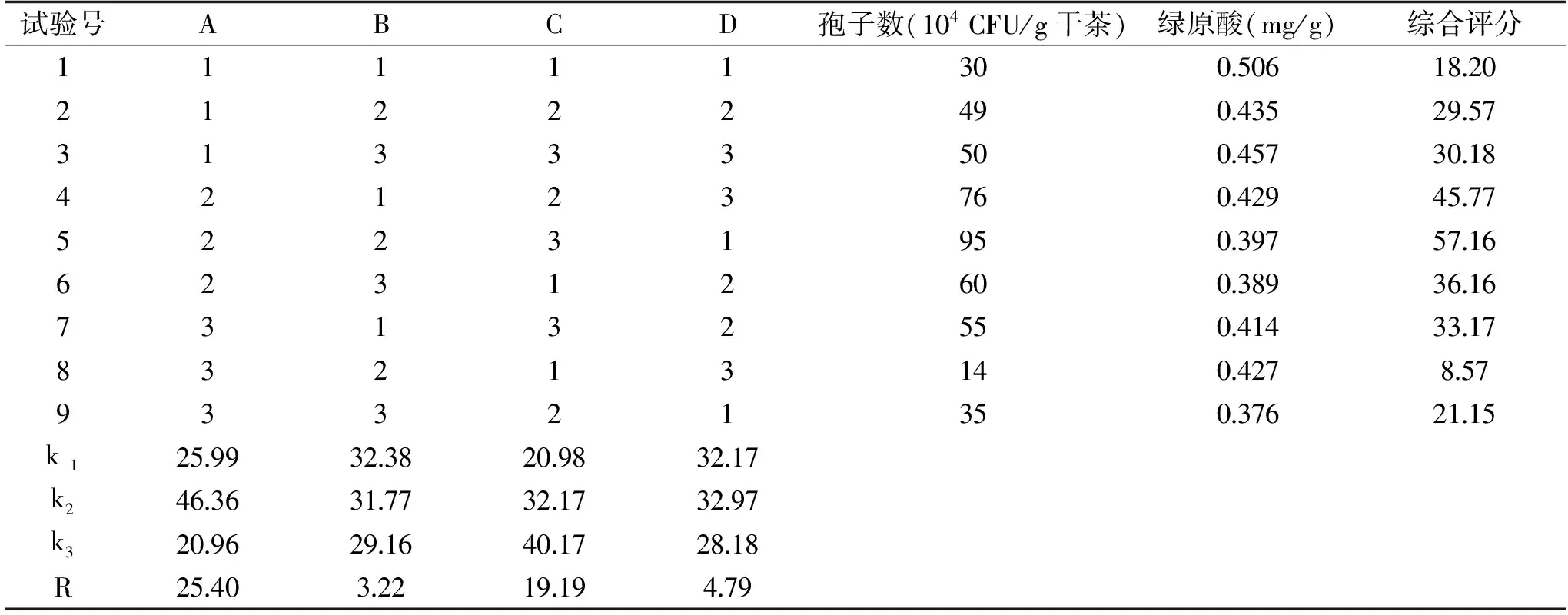
表7 L9(34)正交试验设计编码及结果Table 7 L9(34)The design coding and results of orthogonal test
渥堆时间短,高分子物质成分降解不充分,则冠突散囊菌生成量少,茶叶的菌香味淡,成色成味物质欠缺;渥堆时间过长;茶叶中的高分子物质成分降解过度,则霉菌等大量繁殖,导致茶叶菌香味减少,酸、霉等异味增加[29];由表6可知,随着渥堆时间的增长,孢子数呈先上升后下降的趋势。2 h时孢子数达到最大,且冠突散囊菌生长茂盛,分布均匀,颗粒金黄饱满。可能是由于杀青、一次汽蒸之后,茶叶本身的多酚氧化酶活性被钝化[30],所以,绿原酸的降解变少,虽在发花期间孢子数增多,分泌的多酚氧化酶增多,绿原酸开始降解,但综合两种作用,绿原酸含量呈现升高的趋势;随着渥堆时间的延长,由于茶叶自身的湿热作用,多酚氧化酶活性逐渐升高,绿原酸逐渐降解,在发花期间,即使冠突散囊菌孢子数逐渐降低,分泌的胞外酶随之减少,但可能由于渥堆后期对绿原酸的降解作用,使之最后表现为降低的趋势。关于渥堆过程中绿原酸含量的变化及其原因,有待进一步研究。
2.6 正交试验结果
对优化结果采用直观分析法和方差分析,从表7的极差值大小可以得出,影响因素的主次顺序为接种量>渥堆时间>渥堆温度>含水量。由表8方差分析结果可知,接种量、渥堆时间对茶叶的品质影响显著(P<0.05),含水量、渥堆温度对茶叶的品质无显著影响(P>0.05)。说明接种量对茶叶品质影响最大,含水量最小。各因素的最优水平组合为A2B1C3D2,即接种量为20%、含水量为35%、渥堆时间为3 h和渥堆温度为45 ℃。
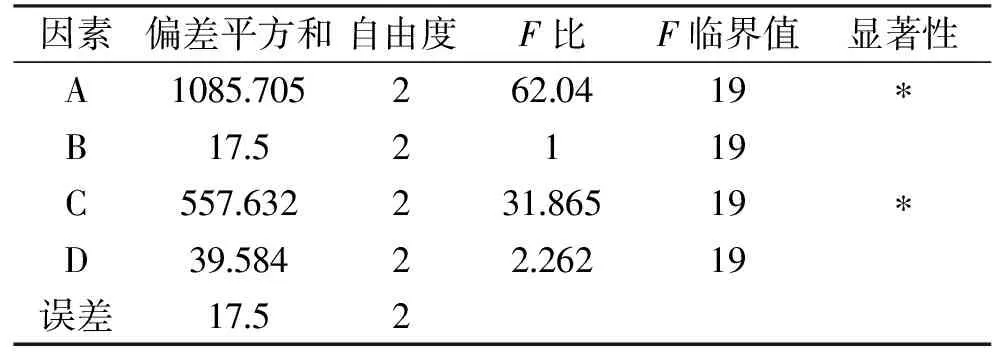
表8 正交试验结果方差分析Table 8 Variance analysis of orthogonal test results
2.7 验证试验
在最佳组合A2B1C3D2条件下进行3次试验求取平均值,孢子数为1.13×106CFU/g干茶,绿原酸含量为0.478 mg/g,且金花茂盛,颗粒饱满,有浓郁的香气。
3 结论
通过单因素及正交试验确定了杜仲叶发酵茶叶的加工工艺,得到最佳的发花工艺条件为:即接种量20%,含水量35%,渥堆时间3 h和渥堆温度45 ℃,在此条件下,发酵茶叶孢子数为1.13×106CFU/g干茶,绿原酸含量为0.478 mg/g,且金花茂盛,颗粒饱满,有金花香气,气味浓郁。
