一种检测杂环胺类化合物的酶联免疫检测方法的建立
2019-11-27
(天津科技大学食品工程与生物技术学院,食品营养与安全国家重点实验室,天津 300457)
杂环胺(Heterocyclicaromaticamines,HAAs)是富含蛋白质的物质在进行热加工时形成的一种物质[1]。截至目前已经在熟食中分离出了约30种诱变型杂环胺[2]。这些杂环胺可以分为氨基咪唑氮杂芳烃类(AIA)与氨基咔啉类[3]。肉类在日常饮食中必不可少,家庭条件下对肉类的烹调温度一般在170~230 ℃[4],而两类杂环胺中的氨基咪唑氮杂芳烃类的形成温度范围为100~300 ℃[5],所以,日常肉制品中易形成该类杂环胺。相关研究表明,如果长时间摄入含有杂环胺的食品,患癌的几率将会增加,尤其是结肠、乳腺以及肝脏方面的癌症[6]。为确保食品安全,实现对杂环胺的快速而准确的检测具有十分重要的意义。
目前,杂环胺的检测手段主要有高效液相色谱[7]、液相色谱-质谱法[8-10]、气相色谱、气相色谱-质谱法[11]以及荧光检测[12]等方法,这些检测方法都有着灵敏度高、准确性好的特点,但对仪器、操作过程以及财力的要求较高[13-15]。免疫分析方法对仪器的要求较低,并且具有检测速度快、检测结果灵敏准确等特点。目前关于采用免疫分析方法检测杂环胺的报道较少,Martin等人[16]制备了PhIP的四种结构类似物PhIP-1,-2,-3和-4的抗体,并对4种抗体之间的特异性和选择性进行了研究;Sheng等人[17]制备了IQ的抗体并建立了直接竞争酶联免疫分析方法(dc-ELISA),这些方法只能够针对杂环胺中的一种物质进行检测,而杂环胺在肉制品中的含量较低,所以建立一种可以同时检测肉制品中多种杂环胺的检测方法具有重要意义。
本文主要针对广谱性多克隆抗体的制备开展研究,以杂环胺2-氨基-3,4-二甲基咪唑[4,5-f]喹喔啉(MeIQx)为原料,将其与丁二酸单甲酯酰氯(MCO)反应合成杂环胺半抗原,通过活化酯法将半抗原与蛋白偶联制备免疫原进一步制备多克隆抗体,最终建立间接竞争酶联免疫分析方法(ic-ELISA)。旨在建立能够同时检测多种杂环胺的酶联免疫分析方法,为加工肉制品中杂环胺的检测和监控提供有用的工具。
1 材料与方法
1.1 材料与仪器
2-氨基-3,4-二甲基咪唑[4,5-f]喹喔啉(MeIQx)、2-氨基-3-甲基咪唑[4,5-f]喹啉(IQ)、2-氨基-3,4-二甲基咪唑[4,5-f]喹啉(MeIQ)、2-氨基-3-甲基咪唑[4,5-f]喹喔啉(IQx)、2-氨基-3,4,8-三甲基咪唑[4,5-f]喹喔啉(4,8-DiMeIQx)、2-氨基-3,7,8-三甲基咪唑[4,5-f]喹喔啉(7,8-DiMeIQx)、2-氨基-3,4,7,8-四甲基咪唑[4,5-f]喹喔啉(4,7,8-TriMeIQx)、2-氨基-1-甲基-6-苯基咪唑[4,5-b]吡啶(PhIP)、2-氨基-9H-吡啶[2,3-b]吲哚(AαC)、1-甲基-9H-吡啶[3,4-b]吲哚(Harman)、9H-吡啶[3,4-b]吲哚(Norharman)、丁二酸单甲酯酰氯(MCO)、钥孔血蓝蛋白(KLH)、卵清蛋白(OVA)、弗氏完全佐剂、弗氏不完全佐剂 美国Sigma公司;N,N-二甲基甲酰胺(DMF) 美国Sigma公司;1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC) 美国Sigma公司;无水二氯甲烷 美国Sigma公司;甲醇(分析纯) 国药集团化学试剂有限公司;新西兰大白兔 月龄3个月,体重1.5 kg左右,北京兴隆实验动物养殖场。
NGC蛋白纯化仪 美国BIO-RAD公司;96孔酶标板 丹麦Nunc公司;F200 PRO酶标仪 美国Thermo公司。
1.2 试验方法
1.2.1 半抗原合成 在氮气环境下,向20 mL溶解有0.1 mmol的2-氨基-3,4-二甲基咪唑[4,5-f]喹喔啉(MeIQx)的无水二氯甲烷溶液中,逐滴加入0.3 mmol浓度为50.29 mmol/L的丁二酸单甲酯酰氯(MCO)-无水二氯甲烷溶液,冰浴反应5 h后,室温反应过夜[18],薄层色谱(Thin layer chromatography,TLC)监测(展开剂组分及比例为二氯甲烷∶无水甲醇∶氨水=9∶1∶0.1,V/V/V[19])。反应完成后,用饱和NaHCO3溶液去除产物中的氢离子,并用无水Na2SO4干燥,过滤后60 ℃减压旋蒸,获得MeIQx半抗原。
1.2.2 偶联蛋白及抗体制备 称取1.0 mg半抗原和1.2 mg二亚胺盐酸盐(EDC)溶于0.1 mL的N,N-二甲基甲酰胺(DMF)中,将其加入4 mL溶解有20 mg钥孔血蓝蛋白(KLH)的碳酸氢钠溶液中,室温搅拌5 h后,加入0.6 mg EDC,4 ℃反应过夜[18]。将所得反应溶液在4 ℃下用pH7.4的0.01 mol/L的磷酸盐缓冲液(PBS)透析3 d,得到杂环胺免疫原MeIQx-KLH。以上述同样的方法合成包被原MeIQx-OVA,通过紫外扫描(200~550 nm)进行鉴定。采用多点皮下注射法免疫新西兰大白兔,最后一次免疫后采用股动脉采血法采集全血[20]。4 ℃进行离心(10000 r/min,10 min),收集血清,通过ProteinA-Sepharose 4B亲和柱层析法纯化抗体。
1.2.3 间接竞争酶联免疫分析方法(ic-ELISA)的建立
1.2.3.1 间接竞争酶联免疫分析(ic-ELISA)方法步骤 将包被原(100 μL/well)包被在96孔板上,4 ℃条件下过夜;用PBST洗板3次后,加入200 μL/well封闭液在37 ℃下封闭1 h;用PBST洗板3次后,加入标准品或样品溶液(50 μL/well)和抗体(50 μL/well),在37 ℃环境中孵育1 h;用PBST洗板4次后,加入酶标二抗(15000倍稀释,100 μL/well),37 ℃孵育30 min;用PBST洗板5次后,加入底物溶液,37 ℃下显色15 min;加入硫酸(1.25 mol/L,50 μL/well)终止反应,利用酶标仪在波长450 nm下读取吸光度值,计算抑制率[21]。
1.2.3.2 包被抗原及抗体稀释度的确定 选取0.01、0.05和0.1 μg/well的包被抗原量和不同稀释倍数的抗体进行组合,建立标准曲线,测定不同条件下的OD值,并计算相应的抑制率和IC50值,选取吸光度值在1.0左右、IC50值最低时的条件为最佳包被量和抗体稀释比例。
1.2.3.3 封闭液选择及浓度优化 确定包被量及抗体稀释比例后,分别用0.5%和1%的明胶溶液、0.5%和1%的BSA溶液以及0.5%和1%的脱脂乳粉溶液作为封闭液进行ELISA测定,最终选取吸光度值在1.0左右、IC50值最低时对应的封闭液用于后续实验。

表1 MeIQx质谱信息Table 1 Mass spectrum information of MeIQx
1.2.3.4 甲醇对间接竞争酶联免疫分析方法(ic-ELISA)的影响 考虑到进行样品检测时需要用甲醇对提取物进行复溶,本实验使用含0、1%、3%、5%、10%、20%、40%的甲醇的PBS缓冲液,建立标准曲线,考察甲醇对ELISA方法的影响,最终选择能够完全溶解样品提取物且与甲醇含量为0时的IC50值相近的甲醇-PBS混合液为样品提取液。
1.2.3.5 杂环胺间接竞争ELISA标准曲线的建立 在上述优化条件下,梯度稀释MeIQx标准品,进行间接竞争ELISA测定,得到不同浓度MeIQx所对应的吸光度值,通过吸光度值计算抑制率,以MeIQx浓度为横坐标,抑制率为纵坐标绘制标准曲线,通过进行拟合得到S型标准曲线,通过曲线计算得到本方法的灵敏度(IC50)和检测限(IC15)。
1.2.4 杂环胺抗体特异性测定 实验选取与杂环胺MeIQx结构类似的喹啉类杂环胺IQ、MeIQ,喹喔啉类杂环胺IQx、4,8-DiMeIQx、7,8-DiMeIQx、4,7,8-TriMeIQx,吡啶类杂环胺PhIP以及氨基咔啉类杂环胺AαC、Norharman和Harman进行抗体特异性测定,以MeIQx的IC50和结构类似物的IC50之比的百分数为交叉反应率。
1.2.5 样品前处理方法 将牛肉切成碎末,制成直径4 cm、厚0.5 cm的薄饼,在200 ℃下油炸2 min[22],然后将油炸过的牛肉和购买的肉松在-80 ℃、0.35 Mpa的条件下进行冻干处理(24 h),取冻干后的样品1 g,放入50 mL离心管中,加入5 mL乙酸乙酯、2 mL氢氧化钠溶液,震荡后超声萃取10 min,8000 r/min离心10 min,取上清,3 mL乙酸乙酯再次提取,合并上清,46 ℃氮吹至干,1 mL甲醇复溶[23],再加入1 mL正己烷,涡旋混合5 min,8000 r/min离心,取下层清液,46 ℃氮吹至干,用1 mL含有5%甲醇的甲醇-PBS混合液复溶得到样品提取溶液。
1.2.6 提取液稀释倍数优化 将1.2.5方法处理得到的样品提取溶液用PBS分别进行2、4、8、16倍稀释,通过对比建立的基质曲线和标准曲线,选取基质影响基本消除的稀释倍数进行后续实验。
1.2.7 添加回收实验 向油炸牛肉和肉松样品中分别添加60、100、300 μg/kg的MeIQx标准品,用方法1.2.5处理样品,用建立的ic-ELISA方法进行测定并计算回收率。
1.2.8 液相色谱串联质谱法(LC-MS/MS)验证 参照林翠萍等[10]的液相色谱-串联质谱联用分析法进行验证。液相条件:色谱柱:Zorbax Eclipsw Plus C18柱,2.1 mm×100 mm,3.5(m;流速:0.2 mL/min;柱温:25 ℃;进样量:1(L;分析时间:23 min;流动相:A:10 mmol/L甲酸水(pH3.5,甲酸调节);B:乙腈;流动相梯度洗脱程序:0~12 min,90% A,10% B;12 min,40% A,60% B;14 min,90% A,10% B。
质谱参数:离子化模式:电喷雾电离正离子模式(ESI+);质谱扫描方式:多反应监测(MRM);雾化气和碰撞气:N2;雾化气压力:40 psi;毛细管电压:4000 V;干燥器温度:350 ℃;干燥器流量:10 L/min;目标物质MeIQx的监测离子对信息见表1。
1.3 数据处理
本文中,酶联免疫检测方法中所有实验数据均为重复3次的实验结果。采用Origin 9.1软件统计分析数据,计算标准误差并绘制标准曲线。
2 结果与分析
2.1 半抗原和完全抗原的鉴定
杂环胺MeIQx的分子质量为213.24,MCO分子量为150.56,经1.2.1反应生成分子量为327.34的产物,图1显示有很明显的328.53加氢峰即[M+H]+,MS(ESI)数据与化合物的分子量(327.24)吻合,合成产物为目标化合物。将合成的半抗原分别偶联KLH和OVA,得到免疫原MeIQx-KLH和包被原MeIQx-OVA。由图2可以看出,二者的紫外最大吸收峰分别在274、271 nm处,在MeIQx半抗原的影响下,相对于纯蛋白KLH和OVA的最大吸收峰位置(278 nm)均向左发生了偏移[23],后期产生的相应抗体和建立的检测方法也充分证明,免疫原MeIQx-KLH和包被原MeIQx-OVA偶联成功。

图1 MeIQx半抗原的质谱分析图Fig.1 Mass analysis diagram of hapten MeIQx

图2 MeIQx-KLH免疫原和MeIQx-OVA包被原的紫外扫描图Fig.2 Ultraviolet spectrum of immunogenMeIQx-KLH and MeIQx-OVA
2.2 包被量及抗体稀释度的确定
包被量及抗体稀释度的优化结果如图3所示。由图3可以看出,包被量相同时,随着抗体稀释倍数的增大,IC50值减小。针对不同包被量,当包被量为0.05 μg/well、抗体稀释倍数为1∶10000时对应的IC50值最小,但此时的OD值小于0.8,不利于检测。而当包被量为0.05 μg/well、抗体稀释倍数为1∶9000时,对应的OD值在1.0左右且IC50值较小,所以最佳包被量确定为0.05 μg/well,最佳抗体稀释倍数为1∶9000。

图3 包被量和抗体稀释倍数的优化Fig.3 Optimization of the amout of immobilizedcoating-antigen and antibody concentration
2.3 封闭液的优化
由图4可以看出,封闭液的种类及其浓度对ELISA方法均有影响,当用BSA和明胶溶液进行封闭时,IC50值均大于用乳粉溶液封闭时的IC50值,且用乳粉溶液进行封闭时OD值在1.0左右,相对于1%乳粉作封闭液,0.5%乳粉作为封闭液时对应的IC50值最小,因此选择0.5%的乳粉封闭液用于后续实验。

图4 封闭液的优化Fig.4 The optimization of blocking solution
2.4 甲醇含量对间接竞争酶联免疫分析(ic-ELISA)方法的影响
为了将样品提取物充分溶解,需要用含有一定量甲醇的甲醇-PBS混合液对提取物进行复溶,但是甲醇会对ELISA方法的灵敏度产生影响。如图5所示,甲醇含量为1%、3%及5%时的IC50值与甲醇含量为0时的IC50值比较接近,可见该范围内的甲醇含量对ELISA方法的影响不明显;当甲醇含量达到10%时,IC50值开始变大,并且随着甲醇浓度的增大,OD值开始下降、IC50值明显增大,说明10%以上的甲醇含量会对ELISA方法产生影响。但鉴于甲醇含量越多,越有助于样品提取物的溶解,所以本实验选取含有5%甲醇的PBS缓冲液复溶样品提取物。

图5 甲醇含量对间接竞争酶联免疫分析(ELISA)方法的影响Fig.5 The influence of methanol concentration on ic-ELISA
2.5 杂环胺间接竞争ELISA标曲的建立
经过上述一系列的优化,所建立的MeIQx杂环胺间接竞争酶联免疫分析方法(ic-ELISA)的最优工作条件为:0.05 μg/well包被抗原、1∶9000稀释抗体、0.5%乳粉作为封闭液。在上述条件下,按照1.2.3.1方法建立标准曲线,通过四参数拟合得到S型标准曲线如图6所示,
曲线方程为y=95.11452+(-1.38549-95.11452)/[1+(x/70.25321)0.9012](R2=0.99984),通过计算得出本方法的灵敏度IC50=81.16±3.15 μg/L,检测限IC15=12.07±1.43 μg/L。

图6 间接竞争酶联免疫分析方法标准曲线Fig.6 Standard curve of MeIQx by ic-ELISA
2.6 杂环胺抗体特异性测定
配制与MeIQx结构类似的其他几种杂环胺(IQ、MeIQ、IQx、MeIQx、4,8-DiMeIQx、7,8-DiMeIQx、4,7,8-TriMeIQx、PhIP、AαC、Norharman和Harman)的标准溶液,用建立的ELISA进行检测,测定IC50值并计算交叉反应率,考察所制备的杂环胺抗体对其他杂环胺的识别能力,由表2可以看出,MeIQx抗体可以对喹啉类杂环胺(IQ、MeIQ)、喹喔啉类杂环胺(IQx、MeIQx、4,8-DiMeIQx、7,8-DiMeIQx、4,7,8-TriMeIQx)以及吡啶类杂环胺(PhIP)进行识别,与上述各种杂环胺的交叉反应率均在93%以上;而对氨基咔啉类杂环胺(以AαC、Norharman和Harman为例)没有明显的识别能力。说明本实验所制备的MeIQx抗体能够识别大部分氨基咪唑氮杂芳烃类杂环胺,具有很好的广谱性,所建立的方法可以对食品中的喹啉类杂环胺、喹喔啉类杂环胺以及吡啶类杂环胺的总量进行检测。

表2 交叉反应测定结果Table 2 The result of cross-reactivity
2.7 提取液稀释倍数优化

续表
基质曲线与标准曲线基本吻合,基质影响消除,因此,油炸牛肉样品提取液经4倍稀释后可以用来进行ELISA检测;不同稀释倍数的肉松样品提取液所对应的基质曲线如图7(B)所示,由图7(B)可以看出,2倍稀释肉松样品提取液时,基质曲线偏离标准曲线较远,说明此时的基质影响比较明显,对提取液稀释4、8及16倍时,基质曲线与标准曲线基本吻合,基质影响消除,因此,肉松样品提取液经4倍稀释后可以用来进行ELISA检测。

表3 ELISA和LC-MS/MS的回收试验结果Table 3 The recovery experiment results of ELISA and LC-MS/MS(n=3)
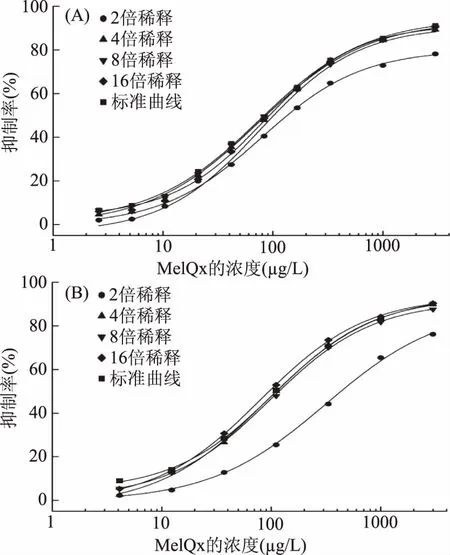
图7 油炸牛肉样品(A)和肉松样品(B)的稀释度优化Fig.7 Dilution optimization of fried beef sample(A)and dried meat floss(B)
2.8 添加回收实验结果
以本文建立的间接竞争酶联免疫分析方法(ic-ELISA)为检测手段,对油炸牛肉样品和肉松样品进行添加回收实验,结果如表3所示。由表3可知,ic-ELISA测得的添加回收率在91.18%~98.64%之间,LC-MS/MS法测得的添加回收率在86.69%~91.11%之间。对ic-ELISA测得的添加回收率与LC-MS/MS法测得的添加回收率进行线性回归分析见图8。由图8可以看出,两种方法的检测结果有较好的一致性(R2=0.9927)。此外,对间接竞争酶联免疫分析方法(ic-ELISA)和LC-MS/MS法的检测结果进行比对可以发现,间接竞争酶联免疫分析方法(ic-ELISA)的回收率高于LC-MS/MS法,其原因可能在于ELISA方法的样品前处理方法简单,不需要经过固相萃取等复杂的提取步骤,样品中的杂环胺标准品损失较少,由此可见,用ic-ELISA在对杂环胺进行检测时,操作简单且结果较为准确。

图8 油炸牛肉样品和肉松样品ELISA和LC-MS/MS回收试验结果的一致性分析Fig.8 Consistency analysis of ELISA and LC-MS/MS recovery experiment results of fried beef samples and dried meat floss
3 结论
本文通过合成杂环胺半抗原,制备了杂环胺免疫原并获得了广谱性杂环胺多克隆抗体,本文利用该抗体建立了间接竞争酶联免疫分析方法(ic-ELISA),方法灵敏度(IC50,以MeIQx计)为81.16 μg/L,检测限(IC15)为12.07 μg/L。该抗体能够广谱识别喹啉类杂环胺(IQ、MeIQ)、喹喔啉类杂环胺(IQx、MeIQx、4,8-DiMeIQx、7,8-DiMeIQx、4,7,8-TriMeIQx)以及吡啶类杂环胺(PhIP),交叉反应率均在93%以上;此外,本文建立的ic-ELISA对油炸牛肉和肉松样品中杂环胺(MeIQx)的添加回收率均在91.18%以上,并且该方法的检测结果与LC-MS/MS法检测结果具有较好的一致性(R2=0.9927)。综上,本文所建立的杂环胺酶联免疫检测方法可以对加工肉制品中喹啉类、喹喔啉类以及吡啶类杂环胺的总量进行准确、快捷的检测,可以为安全的饮食提供保障。在以后的研究中,还可以利用该抗体能够识别喹啉类、喹喔啉类以及吡啶类杂环胺这一广谱性特点,可以开展更广泛的应用,建立更加快速、更加灵敏的新型检测方法。
