储存红细胞输注增强细菌感染引发的肝损伤研究*
2019-11-27张秋丽张艳春史荣辉付秋霞詹林盛
吴 涛 陈 震 张秋丽 晋 晶 张艳春 史荣辉 付秋霞 詹林盛
机体各重要器官,尤其是肝脏,在脓毒血症的发生发展过程中具有重要作用。同时,肝脏在衰老红细胞悬液(red blood cell suspension,RBCs)的清除中也发挥着重要的作用,是快速清除RBCs和铁循环的主要器官。虽然,悬浮RBCs输注可能挽救一部分患者的生命,但在不同的脓毒血症及脓毒性休克患者中,RBCs输注可能增加患者的病死率[1-2]。根据肝脏在脓毒血症及RBCs清除中的调节活性及“储存红细胞诱导创伤后炎症并增强感染”的理论[3]推测:储存RBCs输注增强细菌感染并引发脓毒血症,可能与储存RBCs输注加重细菌感染引发的肝损伤密切相关。为对上述推测进行验证,本研究将基于可视化监测技术监测储存RBCs促进脓毒血症并引发肝损伤的作用过程。
1 材料与方法
1.1 实验动物
选用雄性C57BL/6小鼠50只,6~8周龄,体重为18~22 g,购自军事医学科学院实验动物中心,在军事医学科学院实验动物中心无特定病原体(specific pathogen free,SPF)饲养间进行饲养。
1.2 仪器设备
采用IVIS 50型活体荧光成像仪(美国Caliper公司);TBA-200FR型血清生物化学分析仪(日本Toshiba公司);VIP-6型脱水机(日本樱花公司);KD-BM型包埋机(科迪仪器设备有限公司);RM2016型病理切片机(德国莱卡公司);KD-P型组织摊片机(科迪仪器设备有限公司);KPJ-14型烤片机(天津爱华公司);DH3600型恒温箱(天津泰斯特仪器有限公司);Nikon Ci-S型显微镜(日本尼康公司);DS-FI2型成像系统(日本尼康公司);THZ-C型恒温振荡器(江苏太仓实验设备厂);BCD-165C型冰箱(韩国三星公司);3K15型台式冷冻离心机(美国Sigma公司)。
1.3 试剂及材料
甲醛溶液、二甲苯、石蜡(济宁百川化工有限公司);无水乙醇(国药集团化学试剂有限公司);异氟烷(山东科源制药有限公司);188105载玻片及盖玻片(江苏世泰实验器材厂);50 ml Falcon离心管(美国BD公司);24 G、26 G注射器(江苏海门公司)。
1.4 细菌感染
用小鼠固定器分别固定6只小鼠,用酒精对鼠尾进行消毒。用注射器吸取准备好的细菌溶液。选择进针点,注射器针头穿刺入尾静脉,向前推进约2~3 mm。通过尾静脉注射细菌200 μl感染每只实验小鼠。注射结束后将小鼠放回笼中继续饲养。
1.5 小鼠单个组织器官活体成像
在注射细菌后0.5 h、1 h、2 h、4 h、12 h和24 h,使用1%~3%异氟烷麻醉小鼠,断颈处死小鼠,迅速将小鼠解剖,摘取小鼠的心脏、肺、肝脏、脾脏、肾脏和肠,置于活体成像仪中成像1~5 min(发光强弱决定成像时间)。
1.6 RBCs输血和细菌感染
将20只小鼠分4组,每组5只,用小鼠固定器分别固定小鼠,用酒精对鼠尾进行消毒。用注射器吸取准备好的细菌溶液。选择进针点,注射器针头穿刺入尾静脉,向前推进约2~3 mm。通过尾静脉注射细菌200 μl感染每只实验小鼠。RBCs悬浮液稀释调整至血红蛋白浓度为17.0~17.5 g/dL。将400 μl RBCs通过异氟烷麻醉小鼠的眼后静脉丛输注。注射结束后将小鼠放回笼中继续饲养。
1.7 小动物活体成像
将实验动物放入气体麻醉箱中,打开麻醉气体开关,用1%~3%异氟烷麻醉。待实验动物停止活动后,将其放入活体成像仪中,打开麻醉气体开关,并保持1%~2%的异氟烷持续麻醉。根据注射细菌数量不同,选取自动活体成像模式,1~5 min不等,成像结束后,将实验动物放回动物饲养箱中。
1.8 肝功能测定
通过尾静脉注射细菌200 μl感染每只实验小鼠。将400 μl(新鲜或储存RBCs)通过异氟烷麻醉小鼠的眼后静脉丛输注。注射结束后将小鼠放回笼中继续饲养。在不同时间点用毛细吸管于小鼠眼眶取血。血液凝固后,离心取血清用于检测。血清生物化学分析仪测定血清丙氨酸转氨酶(alanine aminotransferase,ALT)和谷草转氨酶(aspartate transaminase,AST)。
1.9 肝脏苏木精-伊红(HE)染色
解剖并完整取出小鼠肝组织,于10%甲醛溶液中固定72 h以上。肝组织块用流水冲洗,用低到高浓度的乙醇浸泡,逐级脱水,二甲苯渗透。上机切取石蜡包埋的组织块,获得厚度为5 μm的组织切片。切片脱蜡后,浸入磷酸缓冲盐溶液(phosphate buffer saline,PBS)中,再将切片浸入苏木精染液中染色,10~30 min取出,用流水冲洗去掉浮色。切片浸入0.1%盐酸酒精中数秒,流水冲洗至变蓝,随后再将切片浸入1%伊红染液中复染2 min,洗去残存染料。将切片经由低浓度到高浓度顺序,用乙醇逐级脱色。将切片浸入100%的乙醇15 min,再浸入二甲苯+100%乙醇(1∶1)中,透明5~10 min,最后经二甲苯透明5 min后中性树脂固片。使用CI-S型显微镜和DS-FI2型成像系统(Nikon)捕获图像。
1.10 统计学方法
数据资料采用SPSS17.0统计学软件进行统计学分析,计量资料用均数±标准差()表示,两两比较采用t检验。多组比较,组间方差齐时采用单因素多水平设计定量资料方差分析;组间方差不齐时,采用非参数检验,以P<0.05为差异有统计学意义。
2 结果
2.1 活体荧光成像观察细菌感染后的器官分布
铜绿假单胞菌感染C57BL/6小鼠的生物发光成像(bioluminescence imaging,BLI),显示细菌的器官分布情况。小鼠注射2×108CFU细菌,并在注射后指定的时间点成像。感染的器官包括心脏、肺、肝脏、脾脏、肾脏和肠在解剖后单独成像。由于信号的差异,在每种情况下使用相同的辐射标度。见图1和图2。

图1 C57BL/6感染小鼠的器官分布情况

图2 C57BL/6感染小鼠的BLI
2.2 储存RBCs输注增强铜绿假单胞菌诱导的肝损伤
铜绿假单胞菌感染C57BL/6小鼠,储存RBCs输注诱导增加肝脏损伤。在指定的感染后1 h、2 h、3 h和8 h时间点,收获肝样品和血清(5只/组)。检测血清AST和ALT水平。所显示的数据代表平均值±均值的标准误差(standard error of mean,SEM),新鲜红细胞和储存红细胞的AST与ALT水平比较差异有统计学意义(t=4.833,P<0.05),见图3。
铜绿假单胞菌感染C57BL/6小鼠,不同储存时间RBCs输注诱导对肝脏损伤的影响。在指定的时间点,收获肝样品和血清(5/组)。检测新鲜RBCs及储存3 d、7 d和14 d的RBCs输注小鼠血清中的ALT和AST水平。所显示的数据代表平均值±SEM,不同储存时间RBCs输注后ALT与AST水平比较差异有统计学意义(t=7.432,P<0.05),见图4。

图3 感染C57BL/6小鼠及不同储存时间RBCs输注小鼠血清中的ALT和AST水平

图4 C57BL/6感染小鼠及3 d、7 d和14 d储存时间RBCs输注小鼠血清中的ALT和AST水平
铜绿假单胞菌感染C57 BL/6 小鼠,输血后CPDA-1输注对肝脏损伤的影响。小鼠输血后早期和晚期输注CPDA-1的ALT和AST血清水平。所显示的数据代表平均值±SEM(5只/组),见图5。

图5 感染C57BL/6小鼠输血后CPDA-1输注对小鼠输血后早期和晚期血清ALT和AST水平的影响
铜绿假单胞菌感染C57BL/6小鼠,在小鼠脓毒血症早期和晚期输血对肝脏损伤的影响。在小鼠脓毒血症早期和晚期输血的ALT和AST的血清水平。所显示的数据代表平均值±SEM(5只/组),见图6。
RBCs输注铜绿假单胞菌感染C57BL/6小鼠的组织学检查。小鼠肝脏切片的HE染色显示肝损伤的组织学检查见图7。
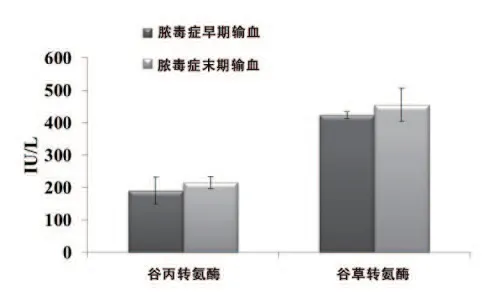
图6 C57BL/6感染小鼠在脓毒血症早期和晚期输血后血清ALT和AST水平

图7 正常C57BL/6小鼠及新鲜与储存RBCs输注C57BL/6感染小鼠的组织学检查(×200)
3 讨论
为了更好地理解感染期间铜绿假单胞菌的生物分布和器官积聚,小鼠静脉内注射铜绿假单胞菌,然后通过生物发光成像分析荧光素酶阳性器官。数据表明铜绿假单胞菌注射诱导的荧光素酶信号在肝区域中最强,随后是肺和脾,在肠中可以检测到相当少的铜绿假单胞菌,而在心脏和肾脏中检测到的更少。这些观察结果与以前的报道一致,表明注射给动物的细菌在注射后不久可能被肝脏捕获。本研究证实,肝脏是铜绿假单胞菌沉积的主要组织,脓毒血症后的肝功能障碍是脓毒血症诱导死亡的独立危险因素,项目组探讨加重的脓毒血症和降低的存活率是否依赖于储存RBCs输注诱导肝损伤的增加。新鲜RBCs输注的小鼠中ALT和AST的血清水平增加,但与储存RBCs输注的小鼠相比显著降低。储存3 d的RBCs血清ALT和AST水平与储存7 d的差异无统计学意义。在输血后输注CPDA-1早期和晚期的ALT和AST水平的差异无统计学意义。在脓毒血症开始和之后输血的ALT和AST的差异无统计学意义(图6)。肝切片的组织学检查显示一致的结果,新鲜RBCs输注的小鼠肝仅观察到肝小叶结构完整,肝束排列整齐,肝窦狭窄,肝细胞可见轻度退行性改变,其中胞核空泡变性明显,部分可偶见灶性坏死及炎细胞浸润。而储存RBCs输注的小鼠肝显示出大量坏死,肝窦狭窄,肝细胞可见轻度退行性改变,部分可见灶性坏死及炎性细胞浸润,星星细胞反应性增生明显。本研究结果表明,储存RBCs的输注增强铜绿假单胞菌诱导的体内肝损伤,并且肝损伤加剧脓毒血症的严重性。
一项回顾性研究报道,对RBCs长期储存(长达42 d)后的输血效力和安全性方面进行了探索,结果表明,与输入“新鲜”RBCs(例如少于14 d的储存期)相比,输注“老”RBCs(例如储存期大于28 d)与多种并发症相关,包括脓毒血症、肺炎、多器官功能衰竭、心肌梗死、急性肾功能衰竭、血栓形成和病死率增加[4-5]。输血患者的临床结果受到血液储存持续时间的影响。因此,储存RBCs输注后的作用存在一定的不确定性,在输注时应权衡其利与弊。虽然通过血液到达肝脏的大多数病原体被局部的先天性和获得性免疫应答消除或控制,但一些病原体可逃避免疫控制并持续存在于肝细胞中。病原体和宿主因素之间相互作用,促进病原体消除和维持器官完整性或允许病原体持久存在,从而导致发病率和病死率持续上升[6-7]。肝脏受到的损害从活动性肝细胞功能障碍发展到肝损伤,进展为肝衰竭。减少肝损伤及恢复肝功能可降低脓毒血症患者的发病率和病死率。在脓毒血症开始前或开始后的肝损伤对脓毒血症患者的严重程度及转归发挥了重要的作用[8-10]。
有研究表明,脓毒血症后肝脏功能异常是引起脓毒血症患者死亡的独立危险因素,在脓毒血症中,肝脏因病原体、毒素或炎症介质而受损。肝功能障碍是指肝细胞功能的轻微改变,例如合成降低或清除功能降低,肝损伤定义为对肝细胞的不可逆损伤,肝衰竭被定义为持续、严重的肝损伤和80%~90%的肝细胞功能丧失,肝损伤通过临床检查和实验室测定难以量化。肝功能障碍常发生于早期脓毒血症,动物通常在盲肠结扎和穿刺后1.5 h,临床患者在脓毒血症诊断当天(疾病发病后<24 h)由于炎症和灌注不足而发生肝功能障碍[11-13]。经过炎症和低灌注的过程可导致肝损伤和肝衰竭。脓毒血症引起的肝脏损伤由于肝细胞凋亡、坏死和嗜中性粒细胞积聚,可发生分子、生化和生理变化,病灶部位出现门静脉炎、中心小叶坏死、小叶炎症、肝细胞凋亡、胆管炎、脂肪变性、胆汁淤积和肝细胞损伤。急性肝损伤在严重脓毒血症中很常见,可增加死亡的风险。肝功能异常或肝衰竭的脓毒血症患者的病死率为54%~68%,高于呼吸系统功能异常或衰竭(脓毒血症最常见的器官衰竭)的脓毒血症患者[14-16]。减少肝损伤及恢复肝功能可降低脓毒血症患者的发病率和病死率。
阐明储存RBCs输注引起的对脓毒血症的炎症性致病作用机制,尤其是其致肝损伤的机制,对于预防储存RBCs引发的这一不良效应具有重要意义,因此,本研究将继续探索输注储存RBCs后加重细菌感染并促进肝损伤的作用机制。
