高分辨核磁预测症状性颅内动脉粥样硬化性狭窄患者短暂性脑缺血风险的价值*
2019-11-27孟凯龙刘彭华
王 宽 孟凯龙 刘彭华
颅内动脉粥样硬化为缺血性卒中关键病理生理学基础,流行病学调查显示,1周内发生短暂性脑缺血(transient ischemic attack,TIA)发作的患者大约46.6%存在症状性颅内动脉粥样硬化性狭窄(symptomatic intracranial atherosclerotic stenosis,sICAS),其中最为常见的是大脑中动脉(middle cerebral artery,MCA)受累[1]。既往报道称传统检查方式如数字减影技术、CT造影技术、核磁造影技术等,虽可评估动脉血管腔是否存在狭窄堵塞,但无法全面评估血管壁病灶并确定管腔狭窄原因,这与颅内动脉自身解剖生理特征有关[2]。而高分辨率核磁(high resolution MRI,HRMRI)血管壁成像技术可解决这一问题,在核磁共振血管造影定位基础上,对动脉异常处行高分辨率断层扫面,可精准显示颅内动脉管壁结构,准确分析动脉粥样硬化斑块及斑块成分[3]。利用HRMRI技术,经图像、数据测量对评估卒中风险具有重要价值,但目前鲜有关于其预测sICAS患者TIA风险的相关报道[4]。基于此,本研究对76例sICAS患者开展回顾性研究,旨在探讨HRMRI技术预测sICAS患者TIA风险的价值。
1 资料与方法
1.1 一般资料
回顾性选取2016年10月至2018年10月邯郸市第一医院收治的76例sICAS患者临床资料,其中男性58例,女性18例;年龄18~78岁,平均年龄(52.78±10.21)岁。所有患者均符合《症状性颅内动脉粥样硬化性狭窄血管内治疗中国专家共识》[5]中相关诊断标准,血管造影证实颅内动脉狭窄率为50%~99%;MCA供血区伴低灌注;美国国立卫生研究院卒中量表(National Institute of Health Stroke Scale)评分<9分,或已行药物治疗,但90 d内出现短暂性脑缺血发作或脑梗死,症状属病变血管所致。本研究获医院医学伦理委员会批准。
1.2 纳入与排除标准
(1)纳入标准:①存在1个或多个动脉粥样硬化危险因素,如高血脂、高血压、肥胖等;②年龄≥18岁,症状性颅内动脉粥样硬化性中、重度狭窄者,均耐受HRMRI检查;③至少近12个月内未行他汀类药物治疗;④获所有患者知情同意。
(2)排除标准:①伴房颤病史、心肌梗死、心脏瓣膜病变、病窦综合征、各种类型心肌病、急或亚急性细菌性心内膜炎等心源性栓子来源风险;②非动脉粥样硬化性颅内动脉狭窄;③患者磁共振检查时制动差,图像伪影较重;④凝血功能异常。
1.3 仪器与药物
采用GE Signa EXCITE 3.0T HD核磁共振扫描仪(美国GE公司);钆喷酸葡胺注射液(德国柏林化学股份有限公司)。
1.4 检查方法
1.4.1 HRMRI扫描
(1)扫描前充分呼吸运动训练,减少呼吸运动伪影。采用GE Signa EXCITE 3.0T HD核磁共振扫描仪,接收线圈采用8通道头线圈,以钆喷酸葡胺注射液为对比剂,高压注射器为Spectris Solsris。检查时,禁止患者随身携带金属物品。先行头颅常规三维时间飞跃法(three-dimension time of flight,3D-TOF)MRA扫描。以头颅横轴面为基线,平行于前后联合连线予以定位,扫描范围上至扣带回,下至枕骨大孔水平。采用后续工作站,处理3D-TOF原始像,于MCA狭窄处垂直于血管走行定位,扫描血管横断面,包括快速自旋回波T1加权成像(T1weighted imaging,T1WI)、快速自旋回波T2加权成像(T2weighted imaging,T2WI)、质子密度加权成像(proton density weighted image,PDWI),3个序列扫描定位一致,扫描序列及参数见表1。
(2)无狭窄侧仅行T2WI扫描,MCA斑块侧行对比增强T1WI扫描,利用高压注射器静脉注射钆喷酸葡胺注射液0.2 mmol/kg,2 ml/s,之后使用15 ml生理盐水冲管。

表1 症状性颅内动脉粥样硬化性狭窄患者各扫描序列相关参数
1.4.2 HRMRI图像处理及形态学指标测量
(1)HRMRI图像处理。由两名神经影像学专家采用双盲法阅片,分析影像学特征:①采用CMR tools软件,测量动脉最狭窄层面管腔内径(最小管径)、最狭窄处管壁外径、狭窄近心端正常管壁外径、斑块厚度,计算管腔重塑率=最狭窄处管壁外径÷狭窄近心端正常管壁外径;②取MCA狭窄程度最严重层面HRMRI图像,在相邻正常参考处(狭窄处近端正常动脉最宽处,若狭窄近端发生病变,则取该动脉段内狭窄远端正常动脉最宽处,若狭窄累及整个动脉段,则取该动脉段供血上级动脉最远端处)高分辨率图像上测量最狭窄处血管面积、管腔面积及管壁面积,其中最狭窄处血管面积为管腔面积与管壁面积之和。
(2)增强图像处理。手动勾画T2WI最狭窄层面管腔内外壁轮廓,拷贝至同层面T1WI、增强T1WI图像中,以轮廓间平均信号强度分别作为斑块T1平扫信号强度、增强信号强度,计算斑块强化率=(斑块T1平扫信号强度-增强信号强度)÷斑块T1平扫信号强度。
(3)形态学指标测量。斑块负荷=(管壁总面积-管腔面积)÷管壁总面积,血管狭窄程度=(1-狭窄处管腔面积÷相邻参考处管腔面积)×100%,血管重构率=狭窄处血管壁面积÷参考处血管壁面积。正性重构模式:血管重构率>1.05;负性重构模式:血管重构率<0.95;中性重构模式:0.95~1.05;非正性重构:即指中性、负性重构。
1.5 观察指标
按TIA检出情况,将所有患者分为TIA阳性组和TIA阴性组,对比两组动脉最小管径、斑块厚度、斑块负荷、管腔重塑率、斑块强化率。按照24 h内TIA发生次数,将TIA阳性病例分为频发组(TIA≥2次)和非频发组(TIA<2次),分析两组最狭窄处管腔面积、参考处管腔面积、血管狭窄程度、最狭窄处管壁面积、参考处管壁面积、重构率及血管重构模式。
1.6 统计学方法
采用SPSS19.0软件对数据进行处理,计数资料以百分率(%)表示,组间行x2检验;计量资料符合正态分布特点,以()表示,采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 影像学分析
HRMRI检查结果显示,76例sICAS患者中,检出TIA阳性35例(46.05%),检出51个斑块,T1WI和T2WI序列均呈等、低或混合信号斑块,DWI序列示脑组织无梗死灶(图1);TIA阴性41例(53.95%)。而35例TIA患者中,频发组19例(54.29%),非频发组16例(45.71%)。
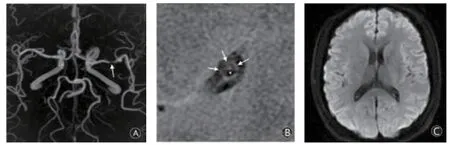
图1 sICAS患者左侧MCA的M1段3种检查图像
2.2 TIA阳性组和TIA阴性组HRMRI形态学指标比较
TIA阳性组斑块厚度、斑块负荷、斑块强化率显著大于TIA阴性组,最小管径显著低于TIA阴性组,其差异有统计学意义(t=3.997,t=3.839,t=3.346,t=3.545;P<0.05),见表2。
2.3 TIA频发组和非频发组MCA斑块形态学指标比较
TIA频发组MCA最狭窄处管壁面积及重构率显著大于TIA非频发组(t=15.646,t=4.407;P<0.05),见表3。
2.4 TIA频发组和非频发组血管重构模式比较
TIA频发组发生正性重构所占比例显著高于TIA非频发组,负性重构所占比例显著低于TIA非频发组,其差异有统计学意义(x2=12.600,x2=6.311;P<0.05),见表4。
表2 两组TIA患者HRMRI形态学指标比较()
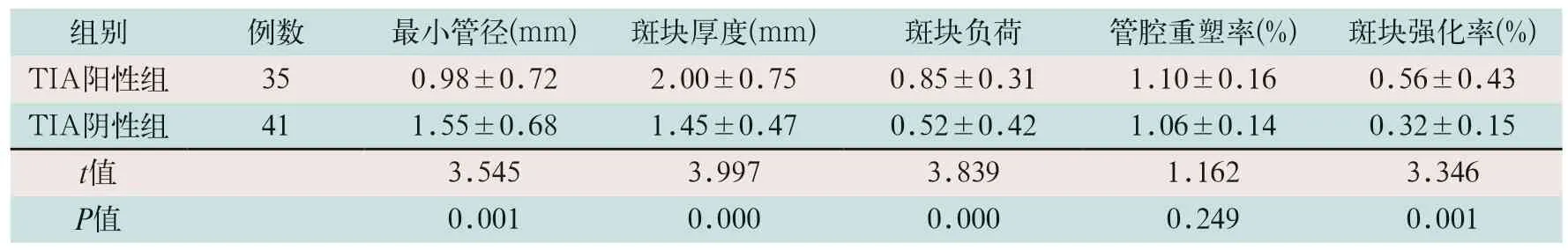
表2 两组TIA患者HRMRI形态学指标比较()
表3 TIA频发组和非频发组患者颅内动脉斑块强化情况比较()
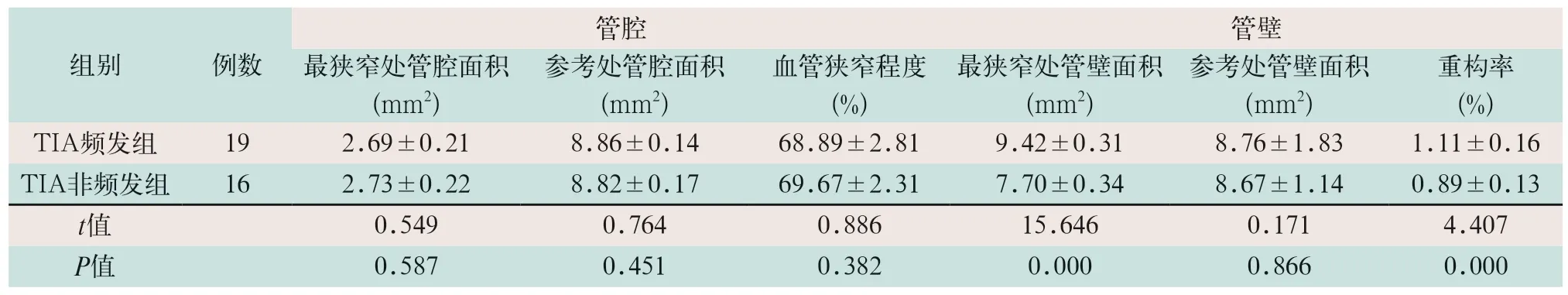
表3 TIA频发组和非频发组患者颅内动脉斑块强化情况比较()

表4 TIA频发组和非频发组血管重构模式比较[例(%)]
3 讨论
目前,sICAS发病机制尚未完全清楚,既往检查方法如数字减影技术、CT造影技术[6]、核磁造影技术等,虽能显示动脉血管管腔情况,但评价动脉血管管壁形态存在一定局限性。而国内文献报道,HRMRI技术是对颅内动脉数字减影技术、CT造影技术、核磁造影技术等检查手段的有效补充,能实现动脉管壁清晰成像,准确显示颅内动脉管壁结构并发现动脉粥样硬化斑块,并可分析斑块成分(如斑块内脂核、钙化、纤维帽、出血等),经图像、数据测量对评估卒中风险具有重要价值[7]。
本研究中HRMRI检查结果显示,76例sICAS患者中TIA阳性检出率46.05%,24 h内TIA发生次数≥2次占54.29%,这与赵迪等[8]研究结论相似。吕晋浩等[9]通过利用HRMRI技术检测颅内动脉粥样硬化性斑块强化预测缺血性脑血管事件,发现42例sICAS患者中TIA阳性检出率为45.20%,这与本研究结论相似。HRMRI技术应用于颅内动脉时采用“亮血”“黑血”技术,能有效降低流动所致伪影,清晰显示血管管壁和管腔狭窄情况。其中,采用3D-TOF序列,因其独特“亮血”技术,可清晰观察动脉管腔内情况,便于HRMRI扫面有效定位;FSE-T1WI序列信噪比较高,成像时间较长,属于对T2WI的补充,便于血管壁动态增强扫描;FSE-T2WI序列分辨率及信噪比高,成像时间短,能早期发现动脉粥样硬化斑块;DWI序列采用活体组织内水分子扩散运动特征,便于责任血管病变定位。本研究表明,利用HRMRI技术可实现对活体动脉粥样硬化斑块结构、成分的无创性成像,有助于评估脑血管事件发生风险。
本研究结果显示,TIA阳性组动脉斑块厚度、斑块负荷及斑块强化率明显大于TIA阴性组,最小管径显明显低于TIA阴性组,提示相对较小的管腔伴较大的斑块与TIA的发生密切相关。颅内动脉粥样硬化疾病病变表现多样,自轻度管壁增厚、非狭窄性斑块至管腔重度狭窄、闭塞,基于持续炎症反应、纤维化、脂质沉积、斑块内出血、原位血栓形成等因素影响下,会加重颅内动脉粥样硬化疾病管腔狭窄程度,导致动脉病变同侧新发脑缺血事件[10]。而因颅内血管炎症抑制因子减少、外弹力层缺失、促炎水解酶过度表达等影响,导致颅内动脉粥样硬化疾病易受炎症反应干扰,存在斑块失稳现象。单勇等[11]认为,症状性MCA狭窄常伴斑块强化,且发病后数个月仍可见强化。陈潇祎等[12]报道,颅内动脉粥样硬化斑块对比增强与TIA等缺血事件有关,可作为斑块稳定性判断指标;而近期同侧脑血管缺血事件与外膜强化程度增加相关。本研究中,TIA阳性组斑块强化率高于TIA阴性组,表明多数sICAS患者MCA斑块均伴不同程度强化,而斑块强化率较高,TIA发生风险越高。
本研究结果显示,TIA频发组血管管腔狭窄程度较TIA非频发组无明显变化,提示管腔狭窄程度并非TIA发生的决定性因素;但TIA频发组MCA最狭窄处管壁面积及重构率明显大于TIA非频发组,表明MCA血管壁正性重构生长模式与TIA的发生密切相关,证实HRMRI技术使颅内动脉管壁成像成为可能。但也有报道称MCA管腔狭窄程度与TIA发作频率、严重程度有关,这与本研究结论不相符,可能与样本量偏小等因素有关[13-14]。血管重构为狭窄血管自身代偿选择,管壁增厚明显时,会引起重塑以维持原本管腔大小(正性重构),而动脉粥样硬化所致动脉本身出现负性重构,加重病变管腔狭窄。本研究中,TIA频发组发生正性重构所占比例明显高于TIA非频发组,负性重构所占比例明显低于TIA非频发组,表明频发组患者MCA伴高正性重构、低负性重构特征,证实正性重构为易损斑块表现,易诱发临床脑血管事件;而血管负性重构属稳定斑块特征性表现,与冠状动脉、颈动脉斑块研究结果相符。究其原因,伴正性重构的动脉粥样硬化斑块脂质核心较大,炎症成分多,纤维帽薄弱,伴斑块内出血、血管新生,故稳定性较差;而伴负性重构的动脉管腔狭窄程度虽严重,但动脉粥样硬化斑块脂质成分较少,纤维成分较多,重构部位动脉内膜较厚,稳定性相对较高[15]。目前,血管重构发生机制尚未完全明确,但有资料显示,其可能与动脉粥样硬化斑块释放金属蛋白酶有关,大量释放金属蛋白酶会降低动脉粥样硬化斑块稳定性,导致斑块破溃,诱发栓子形成,促使远端分支动脉堵塞,最终引起TIA等事件的发生[16]。可见,利用HRMRI技术,能实现动脉管壁清晰成像,准确发现动脉粥样硬化斑块并显示颅内动脉管壁结构,早期确诊颅内动脉血管狭窄性质,对防治临床脑血管事件具有重要意义。
HRMRI血管壁成像技术在预测sICAS患者TIA风险中具有重要应用价值,临床上应引起足够重视。但本研究由于样本量偏小,未涉及远期随访观察,且未与病理结果进行对照,再加上未探讨HRMRI技术对易损斑块和稳定斑块的评价,故研究结果可能存在一定偏差,有待今后深入调查研究。
