猪PLA2G4A 基因单核苷酸多态性及其与饲料报酬性状的关联分析
2019-11-27汪楷庭周榆淞黄上真孟庆利马小军丁向东
汪楷庭,周榆淞,黄上真,蒋 尧,付 璐,孟庆利,马小军,丁向东*
(1.中国农业大学动物科学技术学院,农业农村部动物遗传育种与繁殖重点实验室,国家畜禽工程实验室,北京 100193;2.北京中育种猪有限责任公司,北京 102200)
猪肉是世界第一大肉类消费品,中国是全世界生猪生产量及消费量最大的国家。当前我国生猪生产中饲料成本占总成本的60% 以上[1],猪对饲料的利用情况与生产者的经济效益密不可分。当前饲料价格不断上涨,饲料原料资源日趋紧张,通过提高猪的饲料报酬对降低成本十分重要,同时可减少我国的饲料用粮,缓解人畜争地、争粮的困境。饲料报酬评定经历了2 个发展阶段:20 世纪后期常用饲料转化率(Feed Conversion Ratio,FCR)、平均日增重(Average Daily Gain,ADG)、平均日采食量(Average Daily Feed Intake,ADFI)等作为衡量饲料报酬性状的指标,2000 年以后因电子饲喂设备的更新和采食量测定技术的发展,1963 年Koch 等[2]提出的剩余采食量(Residual Feed Intake,RFI)指标逐渐被广泛采用。多项研究表明饲料报酬性状具有遗传性,大白猪和杜洛克猪的FCR 的遗传力为0.15~0.41,而RFI 的遗传力为0.14~0.38[3]。遗传学家和育种工作者逐步发现了与饲料报酬有关的基因,如黑素皮质素受体4[4]、瘦素基因[5]、增食欲素基因[6]、脂肪和肥胖相关基因[7]等。
PLA2G4A(PhospholipaseA2,Group IVA)又 叫cPLA2、PLA2G4、cPLA2-alpha,属于胞浆型的磷脂酶A2,是由至少10 组亚型组成的一族膜磷脂选择性水解酶,是磷脂生成花生四烯酸的关键酶。近年来,作为介导花生四烯酸生成的关键酶基因PLA2G4A,因其在生长性状方面的重要表现和在早期脂肪细胞分化和肥胖中发挥重要作用而得到较多学者关注。Qiu 等[8]在研究黄姑鱼的遗传连锁图谱时,发现PLA2G4A是生长相关QTL 区域的重要生长基因。Harris 等[9]在对猕猴抗肥胖研究中,发现磷脂酶A2(PLA2G4A)与体重的持续稳定和胰岛素敏感性显著相关。Hartiala 等[10]在研究PLA2G4A 与心机梗死的关系时发现,PLA2G4A 通过饮食中摄入的脂肪酸来影响疾病发生。Vogel 等[11]在研究肥胖相关基因时发现,磷脂酶PLA2G4A 在肥胖受试者的脂肪组织中高表达。鉴于PLA2G4A 在生长性状方面的重要表现,本实验小组前期使用猪80K SNP 芯片进行的全基因组关联分析(未发表),发现猪PLA2G4A基因与饲料报酬性状存在相关,为此本研究选择猪PLA2G4A基因作为猪饲料报酬性状的候选基因进行深入分析。
本实验以166 头来自北京中育种猪有限责任公司的大白猪作为实验材料,通过PCR 扩增PLA2G4A的部分片段,并且使用双脱氧核苷酸对目的片段进行测序和分子生物学软件进行序列比对的方法寻找SNPs,最后分析其与饲料报酬性状的关系,旨在为猪饲料报酬性状的遗传改良工作提供科学依据。
1 材料与方法
1.1 实验材料 本实验以2016 年出生于北京中育种猪有限责任公司的166 头大白猪为材料。基因组提取所采用材料均为猪耳组织,耳组织样保存于70% 乙醇中,-20℃冻存。饲料报酬性状为ADFI、FCR、RFI、ADG,由奥斯本自动饲喂系统110 kg 左右结束测定后处理获得。
1.2 方法
1.2.1 猪基因组DNA 的提取及质量检测 猪基因组DNA 通过血液/组织/细胞基因组DNA 提取试剂盒(离心柱型)进行提取,由北京天根生物科技公司提供试剂盒。根据核酸分子中的碱基具有共轭双键,能够吸收紫外光的原理,用紫外分光光度计分别测定OD260nm、OD280nm值。用Nanodrop2000 仪器检测。根据测定出的DNA 样品浓度,取1~2 μL 基因组DNA 于配置好的1% 琼脂糖凝胶进行电泳以检测DNA 质量,用灭菌水将DNA 浓度统一稀释至100 ng/μL。最后在70% 乙醇中,-20℃保存备用。
1.2.2 引物的设计与合成 登陆Ensembl 网站(http://asia.ensembl.org/index.html)Gene 数据库,获得猪的PLA2G4A基因序列,序列号为ENSSSCG00000023351。利用软件Primer 5.0 进行自动搜索并用软件Oligo 7.0 进行分析,共使用24 对引物(表1)。
1.2.3 PCR 反应体系和条件 15 μL PCR 扩增反应体系(用于酶切反应之前的PCR 扩增):DNA 1 μL,10×Buffer 1.5 μL,25 mmol/L MgCL21.5 mL,10 mmol/L DNTP 0.3 μL,10 μmol/L 上、下游引物分别0.15 μL/条,5 U/μL Taq 酶0.2 μL,H2O 补 至15 μL。20 μL PCR 扩增反应体系(混池测序扩增体系):去离子水1 μL,Taq 酶10 μL,上、下游引物各1 μL,模板DNA 1 μL。
1.2.4 混池测序 将所提DNA 混合进行PCR 扩增,本实验采用20 μL PCR 扩增反应体系。PLA2G4A基因引物顺序号为1、2、3、10、12、17、19、23 的扩增反应条件:96℃预变性3 min;98℃变性10 s,57.2℃退火15 s,72℃延伸10 s,34 个循环;72℃延伸5 min,最后4℃保存。PLA2G4A基因引物顺序号为4、5、6、7、8、9、11、13、14、15、16、18、20、21、22、24 的扩增的反应条件:96℃预变性3 min;98℃变性10 s,56℃退火15 s,72℃延伸10 s,34 个循环;72℃延伸5 min,最后4℃保存。PCR 产物均用1%琼脂糖凝胶电泳检测,并送交上海生物工程股份有限公司进行测序。
1.2.5 基因型分型 在进行酶切之前首先进行PCR 扩增,采用15 μL 的PCR 扩增反应体系。PLA2G4A基因 PCR 扩增反应条件:94℃预变性3 min;94℃变性15 s,55℃退火15 s,72℃延伸30 s,35 个循环;72℃延伸3 min,最后4℃保存。PCR 产物取3 μL 用ExoI和FastAP 纯化,主要是用ExoI 去除反应产物中的剩余引物,用FastAP 去除反应中剩余的DNTP。37℃ 15 min,80℃ 15min,纯化好后进行延伸反应,预先混好延伸引物。延伸反应条件为96℃预变性1 min;96℃变性10 s,52℃退火5 s,60℃延伸30 s,30 个循环;后取1 μL延伸产物,加9 μL 上样HIDI,95℃变性3 min,立即冰水浴,上测序仪。7 μL PCR 酶切反应体系:PCR 产物3 μL,20 U/μL ExoI 0.2 μL,1 U/μL FastAP 0.8 μL,ExoI Buffer 0.7 μL,H2O 补至7 μL。6 μL 延伸反应体系:PCR 产 物2 μL,Snapshot Mix 试 剂1 μL,延 伸 引 物(10 μmol)0.1 μL,水补至6 μL。
1.2.6 饲料利用相关性状测定 利用奥斯本自动饲喂系统获得北京中育种猪有限责任公司166 头大白公猪采食量和增重及饲料利用信息。初测体重范围为29.3~35 kg,初测时间在2016 年4 月26 日—2017 年2 月4 日,结测平均体重为96.98 kg,平均测定饲养天数为68 d,共计4 个批次。计算ADFI、FCR、RFI 和ADG(表2)。
其中,RFI 为实际采食量与预测采食量之差[12]。预测采食量通过多元线性回归的方法得到:在饲养期间准确记录每只猪的干物质采食量(DMI)和ADG,饲养试验结束后利用得到的DMI、试验期中间阶段的代谢体重和ADG 结果进行线性回归分析,计算出猪的预期采食量。根据预期采食量模型,若模型方程的截距显著,则可根据此模型计算出预期采食量[13]。
1.3 统计分析
1.3.1 基因频率(Gene Frequency)和基因型频率(Genotype Frequency)根据基因型判定结果,计算第i 个基因频率:

其中,Di为第i 个基因的纯合子频率,Hij为第i 个基因与第j 个基因组成的杂合子频率。
检验位点是否处于Hardy-Weinberg 平衡,采用卡方适合性检验:
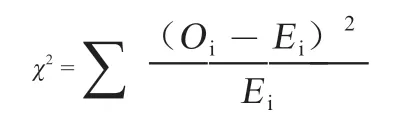
其中,Oi是第i 种基因型的实际观察数,Ei为第i 种基因型的理论频数。

表1 PLA2G4A 基因扩增的引物序列
1.3.2 关联分析 使用Rstudio 程序对PLA2G4A基因外显子和内含子的多态性与猪的饲料报酬性状进行关联分析。模型:表型=批次+基因型+残差。
由于166 头猪都在北京中育种猪有限责任公司采用奥斯本自动饲喂系统测定,其他因素几乎一致,在分析中不再考虑。
2 结果与分析
2.1PLA2G4A基因多态性检测 DNA 样本进行混池测序后用DNAMAN 软件对经PCR 扩增的PLA2G4A基因各段扩增序列进行比对分析寻找SNP 位点。通过对本研究中24 对引物的扩增片段进行逐个分析,共发现9 个SNP 位点,依次记为SNP1、SNP2、SNP3SNP4、SNP5、SNP6、SNP7、SNP8、SNP9(表3)。
基因型频率和基因频率及Hardy-Weinberg 平衡检验结果见表4。在SNP1 位点检测到CC、CT、TT 3 种基因型,且CC 型为优势基因型;在SNP2 位点检测到AA、AC、CC 3 种基因型,AC 为优势基因型;在SNP3 位点检测到AA、AT、TT 3 种基因型,AT 为优势基因型;在SNP4 位点检测到GG、GT、TT 3 种基因型,GG 为优势基因型;在SNP5 位点检测到CC、TC、TT 3 种基因型,且CC 为优势基因型;SNP6 位点检测到AA、AG、GG 3 种基因型,且GG 为优势基因型;在SNP7 位点检测到AA、AG、GG 3 种基因型,且AG 为优势基因型;在SNP8 位点检测到CC、TC、TT 3 种基因型,且TC 为优势基因型;在SNP9 位点检测到AA、AC、CC 3 种基因型,且AA 为优势基因型。SNP1~9 多态位点分别以C、C、A、G、C、G、A、C、A 为优势基因。哈代温伯格平衡检验表明,SNP 1、4、5、6、8、9 严重偏离哈代温伯格平衡,表明该群体可能受到了选择等影响。
2.2 猪PLA2G4A基因多态性与饲料报酬性状的关联分析如表5 所示,SNP3 对ADG 有极显著影响(P=0.000 3),而其他SNP 对这4 种性状均没有显著影响。
3 讨 论
本研究结果显示,猪PLA2G4A基因与ADG 显著相关,与饲料报酬的性状关联不密切。这与Qiu 等[8]在研究黄姑鱼的遗传连锁图谱时发现PLA2G4A是生长相关QTL 区域的重要生长基因相一致。与Harris 等[9]在对猕猴抗肥胖的研究中发现,磷脂酶A2(PLA2G4A)与体重的持续稳定和胰岛素敏感性显著相关等研究结果一致,说明PLA2G4A基因在生长增重方面的作用。
不同物种的PLA2G4A基因结构和位置并不相同。猪PLA2G4A基因[14]定位在第9 号染色体上,由29个外显子28 个内含子构成,长约311 kb,共转录9 条mRNA,转录区域的相对位置为1~108、410~493、1249~1430、1858~2001、3337~3480、3600~3716、5115~5286。而人PLA2G4A基因[15]位于1 号染色体,长度约160 kb,包含19 个外显子和18 个内含子,编码689 个氨基酸,在肾上腺和膀胱中表达较多,在肝脏中表达较少,目前已经发现1 298 个多态性位点。从信号通路来看,PLA2G4A基因产物在磷脂代谢通路Phospholipid→Arachidonic acid→PGH2的第一步起磷脂酶的作用,该通路第二步由PTGS2/COX-2基因产物催化,COX-2 产物可作为评价机体能量代谢的重要指标,可反映棕色脂肪组织的功能状态,与降低体脂率也有密切关系[16]。COX-2基因在能量代谢方面的重要作用在一定程度上也可以证明PLA2G4A可能与ADG性状相关。

表2 166 头大白猪测定期间饲料报酬性状描述

表3 猪PLA2G4A 基因中的SNP 位点
本研究结果显示,与ADG 极显著相关的SNP 位于内含子16,可为近些年来对内含子功能的研究提供材料。从位置上可以看到,该内含子16 的SNP 位点与外显子16 距离很近,该SNP 突变可能因为影响了转录后的剪切而发挥作用;这与目前一些疾病突变集中在内含子与外显子的交界致使外显子缺失或内含子未被剪切而引发突变,最终导致疾病的研究结果相似[17],需要后续进一步研究。
除了与增重有关,PLA2G4A基因在疾病方面的研究也比较充分。Brooke 等[18]在研究人狭窄性肠炎溃烂的遗传因素时,发现与PLA2G4A纯合子4 bp(g.155574_77delGTAA)的缺失相关。张志瑁等[19]研究发现,PLA2G4A基因AA 基因型可能是印度人精神分裂症发病的危险因素;Wei 等[20]报道,在英国人中PLA2G4A基因与精神分裂症相关联。Gosenca 等[21]认为,HERV-Ec1 的转录会有效促进cPLA2 表达,从而促进肿瘤发生。Mcgowen 等[22]发现,鼠中PLA2G4A的单独缺失与妊娠后期的并发症显著相关。这些研究结果说明PLA2G4A基因功能比较复杂,值得深入研究。
综上,本文的研究结果可为PLA2G4A 在饲料报酬方面的作用以及内含子功能的研究提供依据,但本实验也存在样本数量较小、结果受批次影响较大的问题,导致PLA2G4A 与FCR、RFI 等性状不存在显著关联。后续研究将扩大测定数量,并采集疾病数据,综合生长、饲料报酬和疾病,进一步研究PLA2G4A 的代谢过程和分子机理,为养殖业生产和人畜疾病治疗做出贡献。
4 结 论
本实验发现,猪PLA2G4A基因位于内含子16,具体位置为猪9 号染色体128126157 的SNP 位点与猪的ADG 有极显著相关,而其他8 个SNP 位点与这4 种饲料报酬性状均无显著相关。
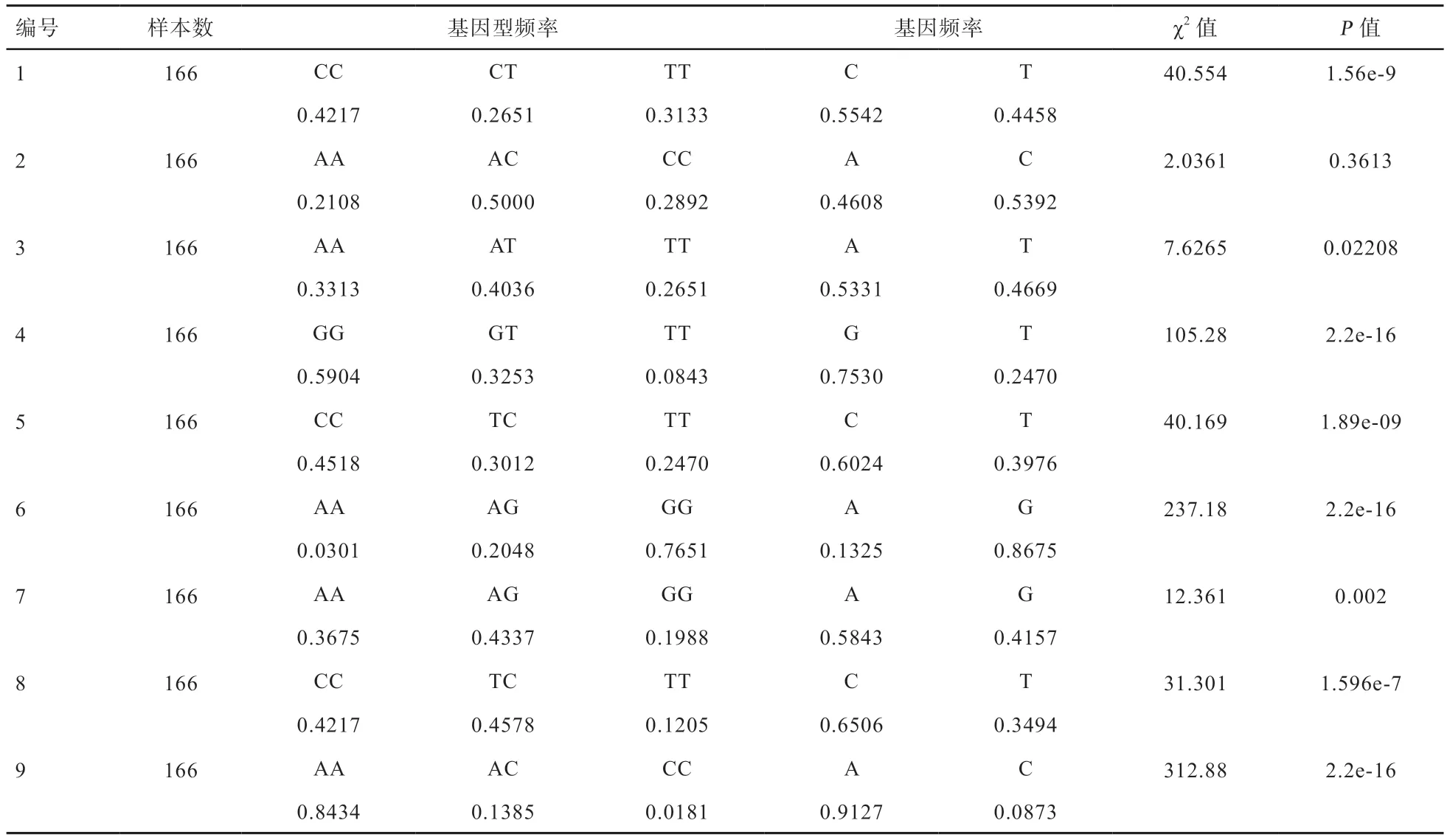
表4 PLA2G4A 基因SNP 突变位点的哈代温伯格平衡检验

表5 猪PLA2G4A 基因多态性与饲料性状的关联分析
