活化蛋白C通过降低炎症因子表达减轻大鼠缺血性脑损伤研究
2019-11-26王金桥杨晓晓饶高峰
王金桥,杨晓晓,饶高峰
卒中因其高发病率、高死亡率和高致残率,给社会和家庭均带来了沉重的经济负担。近年来,缺血性卒中已成为严重威胁人类健康的主要疾病之一[1-2]。过去的20年间,仅有一种药物被美国食品及药物管理局批准用于急性缺血性卒中的治疗,即rt-PA[3]。然而,rt-PA具有很多限制其广泛应用的局限性,包括相对较短的治疗时间窗、大血管闭塞的血管再通率较低及颅内出血的风险[4]。近几年,机械取栓术在急性缺血性卒中治疗中的作用明显增加,但取栓术后功能独立的可能性与血管再通率仍然很低。神经血管单元(neurovascular unit,NVU)由脑微血管、细胞外基质、星形胶质细胞终足、周细胞、神经细胞及其轴突和其他支持细胞(小胶质细胞、少突胶质细胞等)等组成的动态结构,是维持中枢神经系统正常功能的基本单位,主要功能是调节脑营养物质的供应和生物信号的转导,防止血液内的有害成分进入脑内,保护大脑。炎症反应是局灶性脑缺血继发性损伤的关键机制之一,贯穿于局灶性脑缺血损伤的整个过程[5]。在因血栓形成或栓塞而阻断脑血流后,炎症反应参与脑缺血损伤,引起NVU损伤、神经细胞活动与脑血流的解偶联及神经细胞的死亡。
活化蛋白C(activated protein C,APC)是一种血浆丝氨酸蛋白酶,具有抗血栓形成、抗炎、抗凋亡和细胞信号传导功能,研究发现APC可阻止大脑细胞的程序性死亡,促进神经细胞再生,并减轻神经炎症反应,目前临床缺血性卒中实验正在对其疗效进行研究[4]。关于APC的作用机制尚不十分明确,尤其是其对炎症反应参与的脑保护作用尚无相关报道,本实验将在整体动物水平观察APC对局灶性脑缺血/再灌注后炎症反应引起的脑损伤的作用。
1 研究对象与方法
1.1 研究对象与分组 本研究经温州医科大学附属温岭医院实验动物伦理委员会审查通过。研究采用雄性Spraque-Dawley(SD)大鼠,体重300~330 g,3月龄,无特定病原体(specific pathogen free,SPF)级,将大鼠随机分为3组,每组6~8只:①假手术组:生理盐水1 mL/kg;②溶剂对照组:生理盐水1 mL/kg;③APC组:APC(批号090m01549v,P2200,Sigma-Aldrich,美国)2 mg/kg。在造模后6 h以单次给药方式经腹腔注射给予各组药物,药物在1 min内注射完毕。
1.2 制模方法和成功标准 大鼠按400 mg/kg剂量腹腔注射10%水合氯醛麻醉,以仰卧位放置在37℃恒温板上。采用线栓法制作右侧大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)模型[6]。具体方法为,在手术显微镜下经颈正中切口,暴露双侧颈外动脉和颈内动脉。线栓经颈外动脉断端进入颈内动脉,向内延伸约20 mm直到感到抵触感,此时线栓的头部越过大脑中动脉的起始端,并阻断大脑中动脉的血流。脑缺血2 h后线栓被拔出至颈外动脉的断端,再灌注22 h。假手术组线栓在颈外动脉断端处被结扎,不再向颈内动脉延伸,其余手术过程与另两组相同。以制模后提尾出现左前肢屈曲为制模成功。本研究共使用60只大鼠,其中24只大鼠用于神经功能评分、氯化2,3,5-三苯基四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)染色和梗死体积测量,16只大鼠用于血脑屏障通透性检测,TTC染色与血脑屏障通透性检测共用一组假手术组动物,18只大鼠用于炎症因子表达的检测。模型组大鼠全部造模成功,其中假手术组和APC组无死亡,溶剂对照组大鼠在制模后24 h死亡2只。
1.3 实验方法
1.3.1 神经功能行为评分 24只大鼠随机分为3组,每组8只,在缺血后24 h和72 h,采用Jieli Chen等[7]的改良神经功能缺损评分表(modified neurological severity score,mNSS)对3组大鼠进行神经功能行为评分,该评分包括一些特定反射的存在及完成运动和行为学任务,如木板行走试验、木板平衡试验和自主运动试验,总分为18分。该评分由一位分组盲法的实验者完成。
1.3.2 TTC染色及梗死体积测量 3组大鼠在神经功能行为评分后,假手术组用于血脑屏障通透性检测,溶剂对照组合模型组在缺血后72 h,按400 mg/kg剂量腹腔注射10%水合氯醛麻醉后,断头处死。迅速取出脑组织,检查并确定没有蛛网膜下腔出血。将脑组织切为2 mm厚的冠状切片,在37℃水浴中与1%TTC(Sigma-Aldrich,美国)溶液避光孵育20 min,再于10%福尔马林溶液中固定10 min。将TTC染色后的6张脑片照相后保存,以进行损伤区域的测量。采用ImageJ软件计算未被TTC染色的区域,即脑缺血损伤区域。总梗死体积的计算方法为6张脑片未染色的面积总和乘以脑片厚度。
5.动词不定式复合结构做后置定语,它和动词不定式短语一样,均只能放在被修饰成分的后面,做后置定语。例如:
1.3.3 血脑屏障通透性检测 另取16只大鼠随机分为溶剂对照组和模型组,每组8只,在缺血2 h,再灌注70 h时,与假手术组一起以10%水合氯醛400 mg/kg剂量麻醉,按2 mL/kg剂量经股静脉注射3%伊文氏蓝(Evan’s blue,EB)溶液,平衡2 h后经心脏灌注生理盐水,留取缺血部位脑组织。将脑组织放入玻璃小瓶内,称重并加入5 mL甲酰胺,室温避光孵育72 h,吸取萃取液于4℃,12 000 g离心15 min,将上清液移至96孔板,用多功能酶标仪检测荧光强度,检测指标为吸收光波长620 nm,激发光波长683 nm。萃取后的组织放入烤箱,120℃烤干24 h,再次称重。组织的EB含量通过EB标定的标准曲线计算,以μg/g组织表示。
1.3.4 免疫印迹法检测炎症因子表达 另取18只大鼠随机分为3组,每组6只,在脑缺血后72 h,动物以10%水合氯醛麻醉,断头处死,迅速取出脑组织。留取距额极前端3 mm的冠状脑片,脑片厚度为4 mm,然后在中线右侧2 mm处纵行切开,留取右侧半球的脑组织。所留的脑组织进行匀浆,使用细胞核蛋白和胞浆蛋白制备试剂盒(北京普利莱基因技术有限公司,P1200)分离组织胞浆和胞核蛋白,组织蛋白含量使用BCA(bicinchoninic acid)试剂盒(北京普利莱基因技术有限公司,P1511)检测。40 μg蛋白上样到聚丙烯酰胺凝胶,电泳电流15 mA/25 mA(浓缩胶/分离胶),时间2 h;100 mA电转1.5 h至聚偏二氟乙烯膜(ImmobilonTM,Millipore,USA),以3%脱脂奶粉封闭1 h,加入一抗[核转录因子-κB(nuclear transcription factorκB,NF-κB)p65抗体,1∶2000,Abcam 16502;核因子κB抑制蛋白(inhibitor of nuclear transcription factor-κB,IκB)抗体,1∶1000,Abcam 32518;肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)抗体,1∶500,Abcam 6671;IL-1β抗体,1∶5000,Abcam 9722;β-actin抗体作为胞浆的内参蛋白,1∶5000,Abcam 8226;TATA盒结合蛋白(TATA binding protein,TBP)抗体作为胞浆的内参蛋白,1∶1000,Abcam 63766],4℃过夜孵育后,洗膜3次,加入辣根过氧化酶偶联二抗(1∶4000,Abcam 6728;Abcam 6721),室温孵育1 h,洗膜后以化学发光法检测胞浆和核NF-κB p65、IκB蛋白及胞浆TNF-α、IL-1β蛋白表达(北京普利莱基因技术有限公司)。蛋白条带采用Imagelab软件分析,结果以目的蛋白与内参蛋白的体积比表示。
1.4 统计方法 神经功能行为评分结果以中位数(四分位数)表示,其他数据以表示。使用SPSS 19.0软件,神经功能行为评分数据用非参数Kruskal-Wallis分析和Dunn's多重比较检验,其余各组之间比较采用独立样本t检验或单因素方差分析及Newman-Keuls多重比较检验。P<0.05为差异有统计学意义。
2 结果
2.1 活化蛋白C改善大鼠局灶性脑缺血再灌注后的神经功能评分 大鼠缺血前,缺血后24 h和72 h的神经功能评分结果见表1。假手术组大鼠表现为正常的神经功能评分,缺血再灌注后3组大鼠的神经功能评分差异有统计学意义(KW=41.00,P<0.001)。与假手术组相比,溶剂对照组大鼠在缺血再灌注后24 h和72 h的评分明显升高(D=-30.06,P<0.001;D=-29.44,P<0.001),APC组大鼠缺血再灌注后24 h的神经功能评分升高(D=-22.25,P<0.05),APC组大鼠72 h时评分与假手术组差异无统计学意义(D=-11.63,P>0.05);与溶剂对照组相比,缺血再灌注后24 h时,APC组大鼠的神经功能评分有下降趋势,但差异无统计学意义(D=7.813,P>0.05),而72 h的神经功能评分明显改善(D=20.31,P<0.05)。
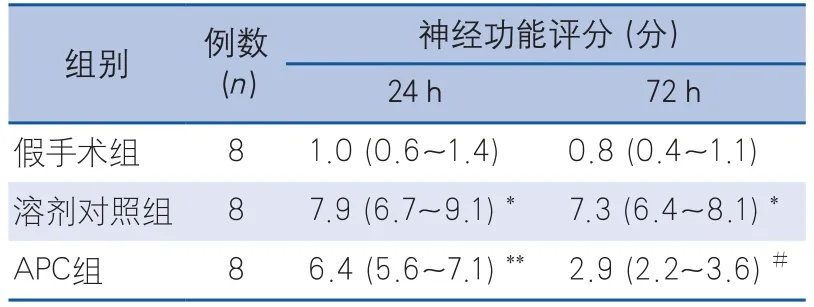
表1 活化蛋白C改善大鼠局灶性脑缺血再灌注后的神经功能评分
2.2 活化蛋白C降低大鼠局灶性脑缺血再灌注后的梗死体积 缺血后72 h,溶剂对照组和APC组大鼠的TTC染色结果见图1A,两组大鼠的脑梗死体积分别为(181.00±19.37)mm3和(132.90±9.25)mm3(图1B),与溶剂对照组相比,APC治疗后能显著降低大鼠局灶性脑缺血再灌注后的梗死体积(t=2.242,P=0.042)。
2.3 活化蛋白C降低大鼠局灶性脑缺血再灌注后的血脑屏障通透性 结果显示,脑缺血后72 h假手术组、溶剂对照组和APC组大鼠的脑组织EB含量分别为(1.37±0.41)μg/g,(18.12±1.53)μg/g,(13.86±1.19)μg/g。3组大鼠的血脑屏障通透性差异具有统计学意义(F=58.13,P<0.001)(图2);与假手术组比较,溶剂对照组和APC组的EB含量明显增加(q=14.67,P<0.001;q=10.94,P<0.001);与溶剂对照组相比,APC组的脑组织EB含量明显降低(q=3.736,P<0.05)。
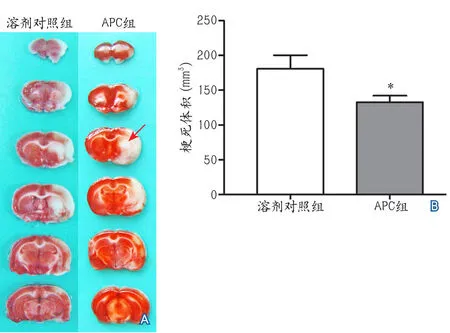
图1 活化蛋白C对大鼠局灶性脑缺血再灌注后梗死体积的影响
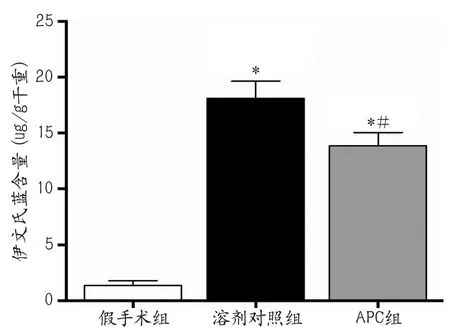
图2 活化蛋白C对大鼠局灶性脑缺血再灌注后血脑屏障通透性的影响
2.4 活化蛋白C减少大鼠局灶性脑缺血再灌注后炎症因子的表达 缺血后72 h,胞浆和胞核部分NF-κB p65与胞浆IκB蛋白表达有明显变化(F=9.353,P=0.002;F=9.837,P=0.002;F=5.630,P=0.015)(图3A~图3C)。与假手术组相比,溶剂对照组胞浆NF-κB p65表达明显降低(q=6.012,P<0.01),IκB蛋白表达减少(q=4.639,P<0.05),而胞核部分NF-κB p65表达升高(q=6.268,P<0.01);与溶剂对照组相比,APC组的胞浆NF-κB p65和IκB蛋白表达增加(q=3.983,P<0.05;q=3.185,P<0.05),而胞核部分NF-κB p65表达减少(q=3.344,P<0.05)。胞浆TNF-α和IL-1β蛋白表达结果差异具有统计学意义(F=4.853,P=0.024;F=9.119,P=0.003)(图3D~图3E,)。与假手术组相比,溶剂对照组TNF-α和IL-1β蛋白表达均明显升高(q=4.284,P<0.05;q=6.037,P<0.01);而APC组TNF-α和IL-1β蛋白的表达比溶剂对照组明显降低(q=3.032,P<0.05;q=3.181,P<0.05)。各组蛋白相对内参蛋白的表达量结果见表2。
3 讨论
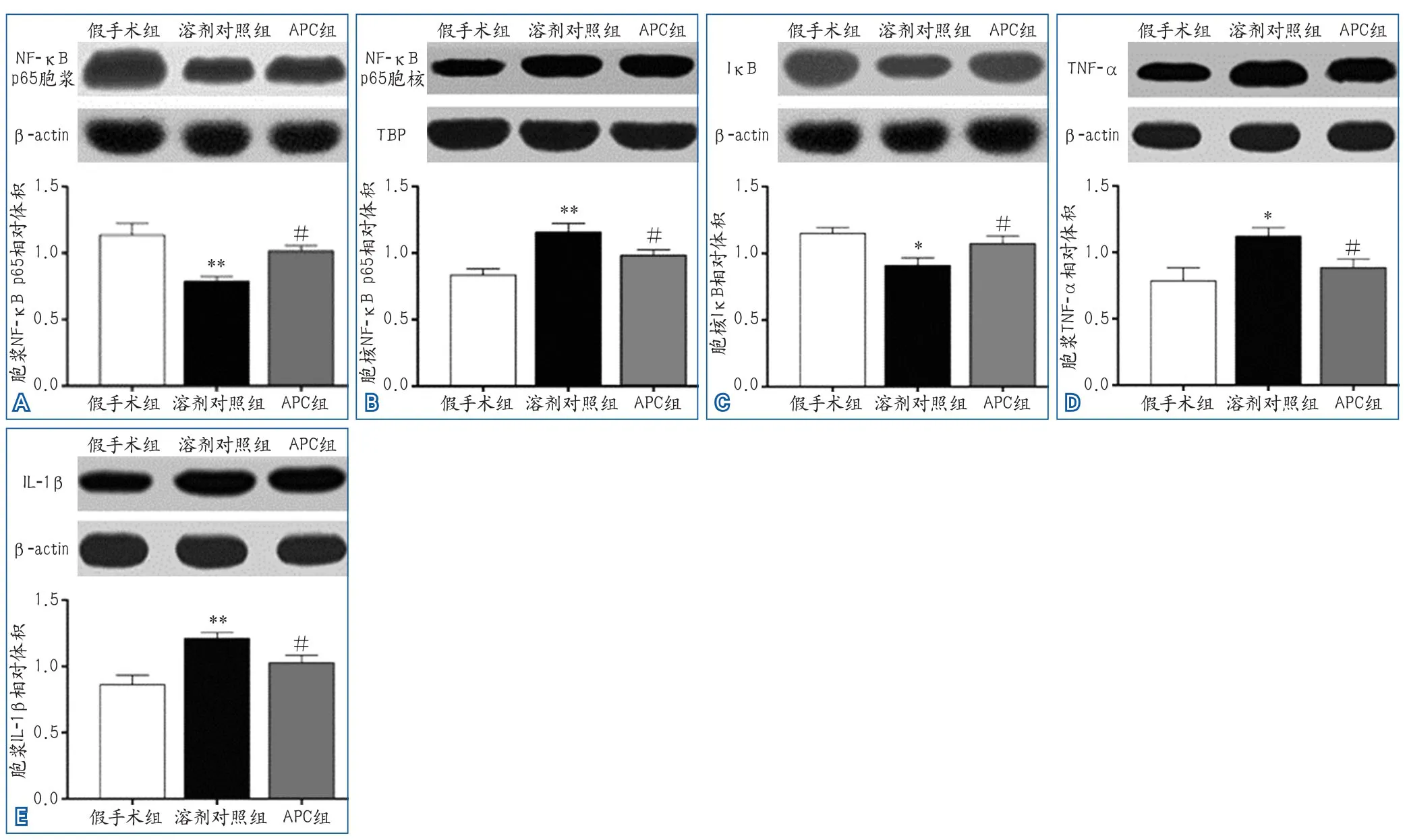
图3 活化蛋白C对大鼠局灶性脑缺血再灌注后炎症因子表达的影响
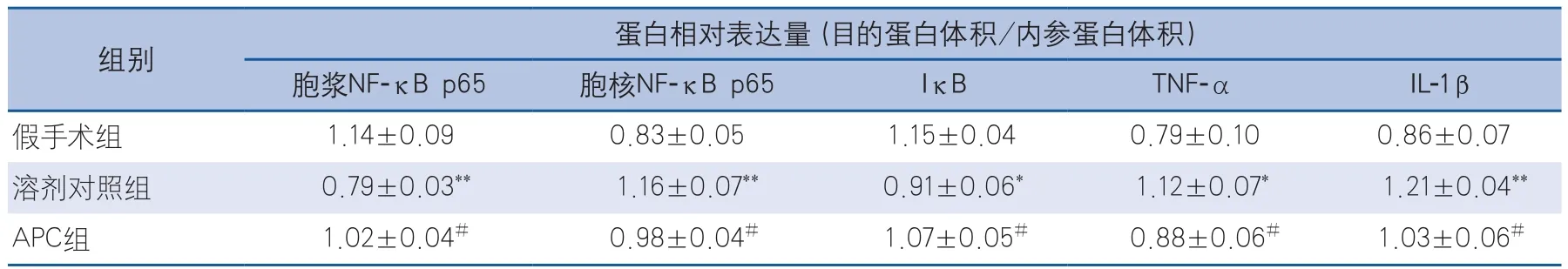
表2 活化蛋白C改善大鼠局灶性脑缺血再灌注后炎症因子的相对表达量
APC能发起驱动多重、多样化、独立形式细胞活动的信号传导,其中很多被称为细胞保护性活动,包括抗凋亡和抗炎活动、基因表达的有利改变和内皮细胞屏障的稳定,其启动有益的细胞信号传导的能力是目前研究的热点话题[8-10]。APC的神经保护作用首次在小鼠MCAO模型中发现,缺血前及缺血后即刻给予APC可以改善脑血流,减少梗死体积、脑水肿和中性粒细胞浸润。近年来,一些体内外的研究已验证了在缺血性卒中的恢复过程中,APC在直接的内皮细胞保护,血脑屏障的稳定性,神经元的保护作用,神经再生和新血管形成方面起到重要作用,而APC作为一种新型的多靶点药物,已完成Ⅰ期临床试验,其治疗急性缺血性卒中的Ⅱ期临床试验也正在进行[11-14]。
本研究中,APC能明显降低大鼠脑缺血再灌注后72 h的神经功能评分和梗死体积,提示APC对缺血性脑损伤具有神经保护作用。本研究同时观察了缺血后24 h和72 h的神经功能评分,发现随着时间的进展,溶剂对照组的评分有下降趋势,考虑是大鼠自身恢复的结果;APC组72 h的评分结果要明显低于24 h,提示APC存在一定的长期疗效。
局灶性脑缺血触发炎症反应后,活化的炎症细胞堵塞毛细血管,同时释放的炎症因子能增加微血管的通透性,引起脑微血管的痉挛和脑组织的水肿,造成缺血脑区再灌注后的无复流现象,加重脑组织的缺血损伤;同时,炎症介质可下调星形胶质细胞、内皮细胞基质黏附受体的表达,降低星形胶质细胞、内皮细胞与细胞外基质的相互作用,增加血脑屏障通透性。
有研究发现,在培养的大鼠皮质和海马神经元内,APC能抑制NF-κB p65蛋白易位入神经元胞核。本研究同时观察了胞浆和胞核NF-κB p65蛋白及胞浆IκB蛋白的表达,结果提示脑缺血再灌注后胞浆NF-κB p65蛋白易位入胞核,同时抑制性蛋白IκB水解增加,而APC可以抑制NF-κB p65的活化过程。此外,研究证实NF-κB p65介导了脑缺血后许多炎症介质的表达,如TNF-α、IL-1β、ICAM-1、E-选择素、基质金属蛋白酶、环氧化酶-2、一氧化氮合酶等,并且下调NF-κB p65的促转录活性可降低局灶性脑缺血损伤[15]。本研究中,APC能明显抑制脑缺血再灌注后TNF-α和IL-1β的蛋白表达,因此,推测APC可能通过抑制NF-κB p65的活化和核异位,从而下调炎症因子的转录表达,降低血脑屏障通透性,对血脑屏障的损伤起保护作用。
本研究结果显示APC能有效减轻血脑屏障通透性,从而对大鼠局灶性脑缺血再灌注损伤发挥神经保护作用,其机制可能通过抑制NF-κB p65的活化和核易位,降低炎症因子TNF-α和IL-1β蛋白的水平,表明APC在炎症反应参与的缺血性脑损伤中具有保护作用。但是本研究仅仅初步探索了APC在炎症反应参与脑缺血引起血脑屏障损伤中的作用,而局灶性脑缺血引起的组织损伤是由一系列发生在血液-微血管-脑实质细胞之间的病理生理事件引起,最终导致神经元的死亡,本研究没有从神经细胞、脑微血管、神经胶质细胞等一个功能整体层面进行分析APC的作用,在今后的研究中,可进一步侧重观察APC对NVU中各组分的影响和相互作用,观察其对脑微环境内血液供应和神经细胞能量需求之间的精细平衡的影响,以更加完善APC作用机制的研究,明确其降低神经功能缺损和神经细胞的死亡,促进神经功能的恢复的确切机制。
【点睛】活化蛋白C能减轻血脑屏障损伤保护大鼠脑缺血损伤,可为神经保护药物作用靶点的研究提供实验证据。
