合并脑梗死的肥厚性硬脑膜炎1例
2019-11-26李矜玥于美玉焦卓敏张雪梅
李矜玥,于美玉,焦卓敏,张雪梅
肥厚性硬脑膜炎(hypertrophic cranial pachymeningitis,HCP)是硬脑膜的一种非特异性的炎症反应,病理表现为硬脑膜的慢性纤维炎性增厚。HCP的发病率较低,可累及硬脑膜的不同区域,因此临床表现呈多样性,症状包括:头痛、癫痫、无力、感觉障碍及颅神经麻痹。其发病过程和许多疾病密切相关。临床上最终确诊HCP较难,误诊率极高。若未能早期给予治疗,HCP的症状将会在数月内迅速加重,神经系统累及的范围进一步扩大,患者的生活质量明显受累,由此可见HCP的早期诊治是十分重要的。以下为1例合并脑梗死的HCP的病例报道。
1 病例介绍
患者,女性,46岁,因“头痛伴恶心呕吐4月余,服药后认知障碍2日”于2017年5月19号入院。患者2017年1月无明显诱因出现双侧颞部搏动样头痛,呈持续性,伴有恶心呕吐,自述呕吐为喷射样,呕吐物为胃内容物,服止痛药可缓解。2017年2月在当地医院进行检查,未发现明显异常,予静脉点滴对症支持治疗,头痛未见好转,反而加重,口述分级评分(verbal rating scale,VRS)可达10分。2个月间反复因头痛住院治疗,但未发现明确病因。2017年4月行头部CT检查示小脑幕缘密度增高,考虑蛛网膜下腔出血(图1)。行MRI增强扫描可见:大脑镰、小脑幕有增强效应(图2)。MRA检查显示:左侧颈内动脉动脉瘤(图3)。后行动脉瘤介入手术,术后头痛症状略好转。术后10 d余,头痛症状再次加重,此次为双侧枕部胀痛,再次入院。患者因长期恶心呕吐,进食少,体重进行性下降,入院时体重约为60 kg。PET-CT检查显示:脑动脉瘤术后改变,左侧颈内动脉区可见结节状致密影;大脑镰、小脑幕内均可见均匀略高密度影。余双侧大、小脑半球、基底节区及丘脑等CT影像学及18F-氟代脱氧葡萄糖分布未见异常。给予消炎补液治疗。患者入院2 d前自行口服“老鼠药”,后出现精神症状,就诊于我院。病程中,患者食欲下降,饮食量少,4个月来体重下降至50 kg,其他一般状态尚可。
既往史:既往无其他疾病病史。无吸烟、饮酒史。家族无类似疾病病史。
体格检查:体温37.7 ℃,血压135/74 mm Hg,心率50次/分,呼吸16次/分。心肺腹未见明显异常。神经系统检查:谵妄状态,查体不能配合,慢性消耗病容,双眼各向活动自如,双侧瞳孔等大同圆约3.0 mm,转头转颈自如,四肢肌力肌张力粗测正常,反射、感觉、共济查体等不能配合。颈强阳性,克尼格征及布鲁辛斯基征阴性。
实验室检查:
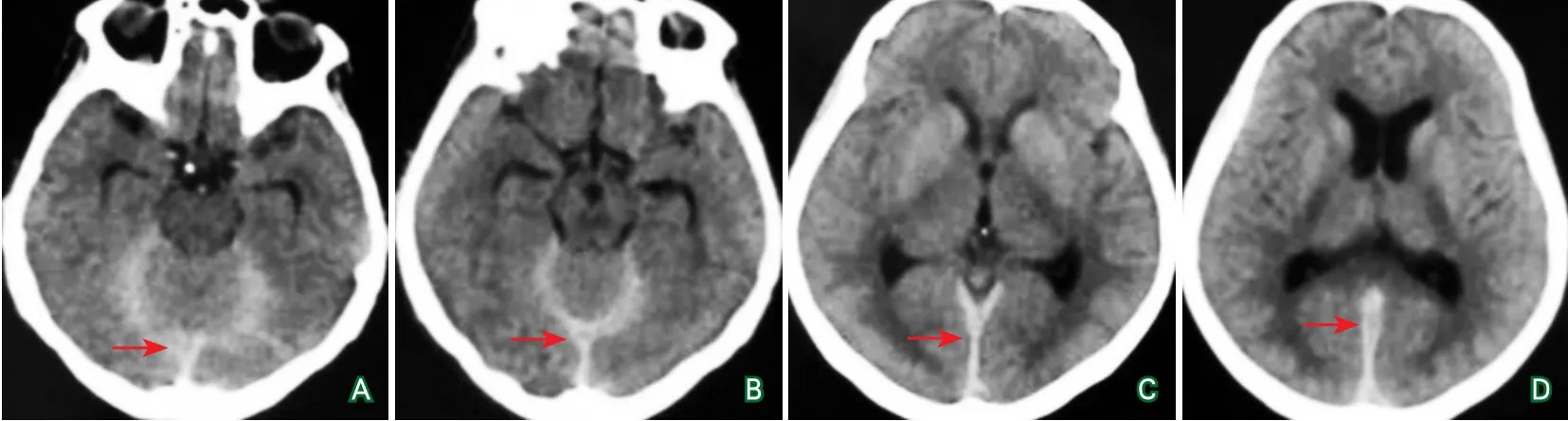
图1 患者头颅CT结果(2017年4月)

图2 患者头颅增强MRI结果(2017年4月)

图3 患者头颅MRA结果(2017年4月)
丙氨酸氨基转移酶104 U/L,天冬门氨酸氨基转移酶165 U/L,胆碱酯酶4368 U/L,肌酸激酶268 U/L,乳酸脱氢酶280 U/L,血钾2.4 mmol/L,血氯90 mmol/L,白细胞计数10.5×109/L,中性粒细胞百分比82.8%,淋巴细胞百分比10.5%,血红蛋白106 g/L,红细胞计数3.32×109/L,叶酸3.1 mmol/L,维生素B12883 mmol/L,抗核酸抗原抗体(antinuclear antibody,ANA)谱阴性,抗中性粒细胞胞浆抗体(anti-neutrophil cytoplasmic antibodies,ANCA)阴性,乙肝病毒表面抗体(+),乙肝病毒核心抗体(+)。抗甲状腺过氧化物230.13 IU/mL,抗甲状腺球蛋白抗体35.34 IU/mL,hs-CRP为13.87 mg/L。腰穿检查:颅内压270 mm Hg,外观无色透明,潘氏试验弱阳性,细胞计数30个,脑脊液氯离子117 mmol/L,脑脊液总蛋白778 mg/L,脑脊液免疫球蛋白G指数为1.71。
入院诊断:
肥厚性硬脑膜炎?
药物中毒?
左颈内动脉动脉瘤栓塞术后
低钾血症
治疗经过:入院后因患者低钾血症立即给予静脉补钾及灌肠补钾。考虑精神症状为“鼠药”中毒及全身消耗性状态的结果,但家属未能提供鼠药成分,且服药时间过长,此时毒理学检查敏感性及特异性较低,未行毒理学检测。密切监测患者生命体征,给予患者促毒物排泄、静脉营养治疗。患者发热及血象高可能是系统性疾病所致,但也不能除外感染可能,所以给予患者抗感染治疗。
入院第2天,患者突发右上肢无力,上肢不能抬举,下肢可以行走。查体:意识朦胧,查体不能完全配合,右上肢肌力2+级,右下肢肌力4级,余查体无变化。结合患者症状及查体,定位于上行网状激活系统及左侧皮质脊髓束,考虑患者可能发生脑梗死,急行头部CT检查,结果显示双侧脑室旁低密度影,小脑幕缘密度增高,脑沟裂变浅(图4)。头部DWI示左侧大脑半球多发片状弥散受限信号,诊断皮质下型分水岭区缺血性脑梗死(图5)。结合患者长期营养不良状态及较差的进食情况,考虑低血容量性病因可能性大,给予双重抗血小板、扩容、改善脑循环、保护脑组织治疗。
入院第3天时患者意识恢复,右侧肢体无力症状改善,上肢可抬举,下肢可行走。查体:神志清楚,言语流利,右上肢肌力3+级,右下肢肌力4级,左侧肢体肌力正常,右侧肌张力略高,左侧肌张力正常,腱反射活跃对称,未见明显感觉异常,共济查体正常。脑膜刺激征阴性。
由于患者头部CT上小脑幕高密度持续了1个月以上,腰穿脑脊液非血性,可以排除蛛网膜下腔出血的诊断,结合长期头痛史,考虑可能为HCP。相关检查及化验未能发现继发性病因(感染、自身免疫性疾病等),考虑特发性可能性较大。立即给予甲泼尼龙250 mg/d静脉点滴3 d,120 mg/d静脉点滴5 d,患者头痛症状明显减轻。考虑患者有抑郁倾向,给予患者文拉法辛75 mg口服,每日1次。之后甲强龙80 mg/d静脉点滴5 d后,改为泼尼松50 mg/d口服治疗。
出院时患者头痛及右侧肢体无力症状均明显改善,VRS为0分。查体:神志清楚,言语流利,双眼各向活动自如,双侧瞳孔等大同圆,直径约3.0 mm,转头转颈自如,右侧肢体肌力5-级,左侧肢体肌力正常,右侧肌张力略高,左侧肌张力正常,腱反射活跃对称,未见明显感觉异常,共济查体正常。脑膜刺激征阴性。出院时复查头部MRI增强扫描,可见硬脑膜病灶增强效应减轻,硬脑膜肥厚情况改善(图6)。出院后嘱患者早期以每周减10 mg泼尼松的速度进行激素减量,后期减慢撤药速度,最后以2片泼尼松长期维持治疗。
出院诊断:
特发性肥厚性硬脑膜炎
脑梗死
左侧颈内动脉系统
低灌注
左颈内动脉动脉瘤栓塞术后
抑郁状态
低钾血症
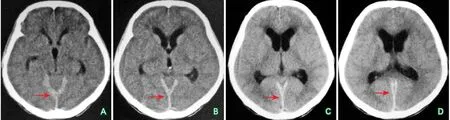
图4 患者头颅CT结果(2017年5月)

图5 患者头颅DWI结果(2017年5月)
出院后随访,当激素减量至40 mg时头痛症状再次复发。再次就诊,给予激素120 mg静脉点滴治疗,症状未缓解。转入上级北京协和医院进一步治疗,再次进行头部CT及增强MRI检查(图7~图8),并行硬脑膜活检,病理显示为致密纤维结缔组织,有较多淋巴细胞、浆细胞浸润。相关检查强烈提示为HCP的诊断。给予甲泼尼龙1000 mg每日1次静脉点滴3 d,之后减量为500 mg每日1次静脉点滴3 d后,改为口服泼尼松龙片60 mg每日1次,头痛症状明显缓解。出院后嘱咐患者2周减1片(5 mg),直至完全停药。半年后随访,患者恢复良好,无症状反复。
2 讨论
肥厚性硬膜炎(hypertrophic pachymeningitis,HP)是与硬膜炎性纤维增生相关的一类罕见疾病。虽然随着科学技术的快速发展,疾病的诊断手段进一步精进,但从1869年J.M.Charcot等[1]首次报道HP直至现在,世界范围诊断HP的病例仍然非常少。据日本Tomomi Yonekawa等[2]统计,2005-2009年全世界诊断的HP患者仅有159名,发病率约为0.949/10万,平均发病年龄是(58.3±15.8)岁。至今为止已发表的HP相关文章也仅有数百篇。
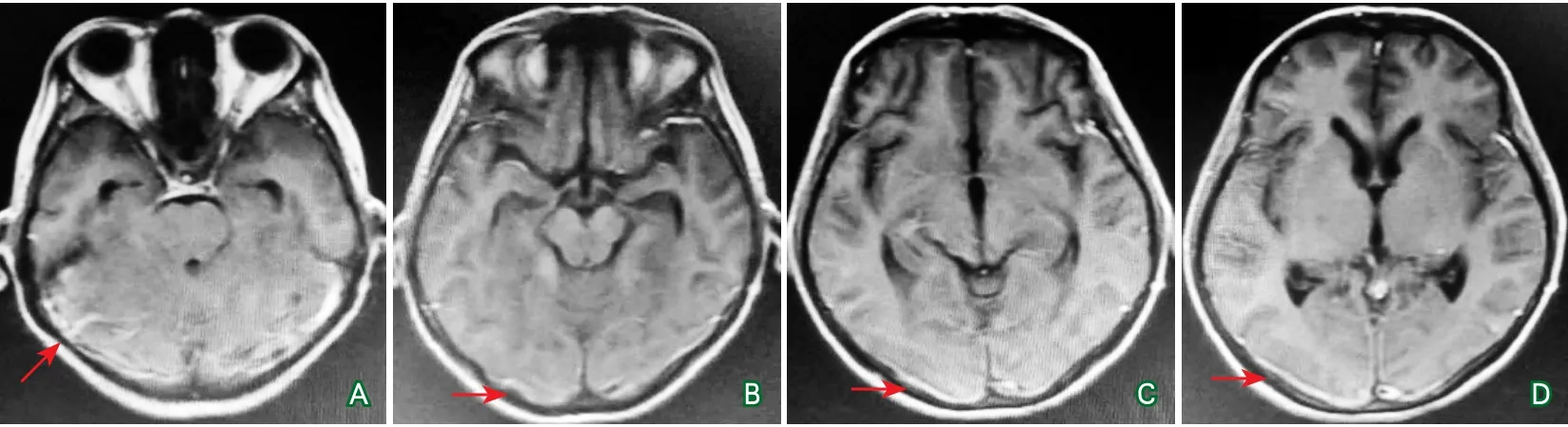
图6 患者头颅增强MRI结果(2017年5月)
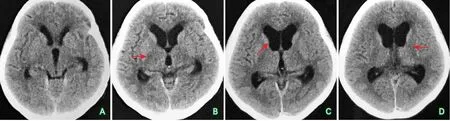
图7 患者头颅CT结果(2017年7月)
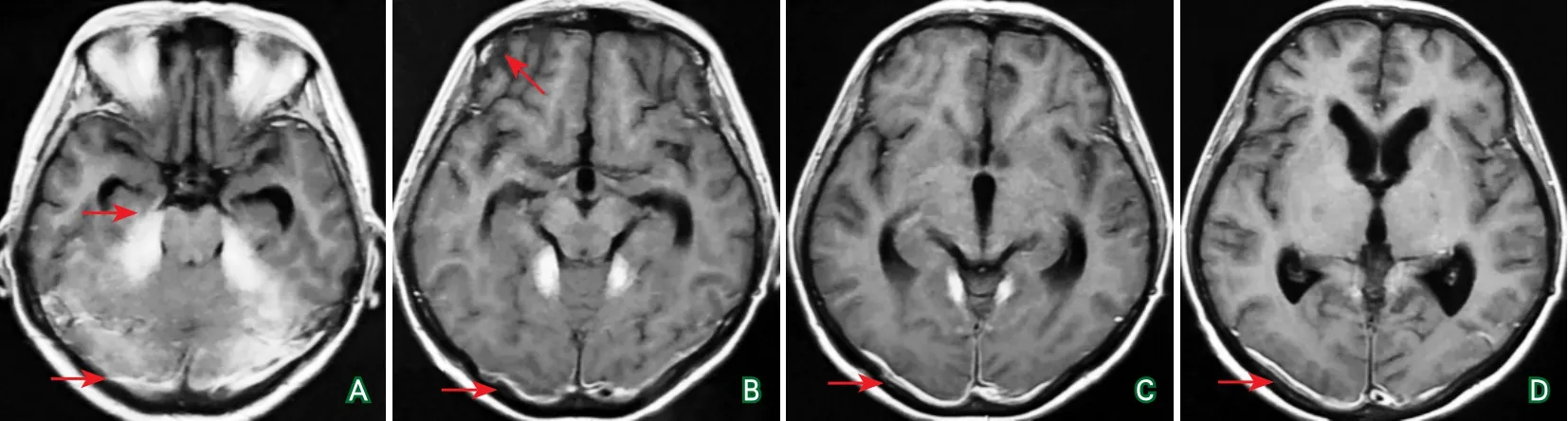
图8 患者头颅增强MRI结果(2017年7月)
根据硬膜累及的部位可以将其分为颅脑型、脊柱型及颅脑脊柱共患型。临床上报道较多的为HCP,颅脑、脊柱两部位同时累及的HP罕见报道[3]。根据病因可将HP分为两类:原发性HP及继发性HP。继发性HP,即有明确的合并疾病或诱因,包括感染(莱姆病、梅毒、结核分枝杆菌、真菌、脑囊虫病、人体T细胞白血病病毒、假单胞菌导致的恶性外耳道炎等)、外伤、自身免疫性疾病(韦格纳肉芽肿病、类风湿性关节炎、系统性红斑狼疮、结节病、白塞综合征、颞动脉炎等)、肿瘤(转移癌、淋巴瘤、脑膜瘤等)、其他混杂因素如血液透析、黏多糖病、鞘内药物注射等[4-5]。但绝大多数HP患者未能发现明确的致病原因,即原发性HP,又称特发性肥厚性硬膜炎(idiopathic hypertrophic pachymeningitis,IHP)[6]。IHP的女性发病率高于男性,平均发病年龄在(54.8±16.5)岁[2,7]。作为HP中最常见的类型,IHP的诊断需要排除其他继发性因素的可能。
头痛及颅神经损伤是HCP患者最常见的临床症状。Ian F.Parney等[8]发现,头痛、颅神经麻痹、共济失调的症状在颅脑型HP患者中分别占88%、62%及32%。头痛多局限于枕部,可作为唯一症状持续数年[9]。其他症状有癫痫、记忆力丧失、精神症状、意向性震颤、痛性眼肌麻痹、垂体功能紊乱、听力减退等。普遍认为头痛是由于局部或弥漫性的硬脑膜炎症导致,也有人推测可能是硬脑膜肥厚导致颅内压增高、脑水肿或脑积水所致。据Duangnapa Roongpiboonsopit等[7]统计,单纯以头痛起病的HCP患者约占12.5%。当硬脑膜严重肥厚压迫颅神经发出部位,会表现为颅神经麻痹症状。Ⅰ~Ⅻ颅神经损伤的病例均有报道。最常累及的颅神经是外展神经及动眼神经,其次是视神经、三叉神经、听神经、滑车神经,面神经[10]。另外,肥厚的硬脑膜还会压迫邻近的脑实质或静脉回流通路,导致局部神经系统缺损症状,表现为单瘫、偏瘫或癫痫。极少情况下,HCP可能合并颈内动脉梗阻、静脉窦阻塞及梗阻性脑积水。
MRI是HCP的主要诊断及疗效评估手段。增厚的硬脑膜可在MRI上表现为T1WI等或低信号、T2WI低信号及边缘高信号。而在增强扫描中,特别是T1WI中,多表现为高信号,这可能是硬脑膜的纤维组织及炎性反应区域表现。病灶多局限于第四脑室、双侧额叶、小脑幕等部位。颅底的病灶较少见。弥漫性硬脑膜肥厚患者中可见线性或结节状强化,结节状强化提示硬膜的不均匀增生,可能和硬脑膜的反复感染及不同部位的感染相关,此现象多提示不良预后。有时HCP患者的CT及MRI表现会被误诊为蛛网膜下腔出血,腰穿可帮助HCP的诊断。也有人推荐使用PET-CT作为诊断及治疗的一项评估检查[11]。
硬膜的病理活检有助于最终的诊断,可以对HP的病因学诊断提供线索,确定是否是结核性、真菌性或阿米巴性,这将决定进一步的治疗方案。IHP的病理结果多表现为增厚的纤维化硬膜,合并有慢性炎症细胞如淋巴细胞及浆细胞浸润所致的慢性炎症反应。HP患者病理还可见慢性非特异性颗粒样增生、淋巴滤泡形成、玻璃样变性、干酪样坏死、上皮样细胞及朗格汉斯细胞。颗粒样改变可出现在硬膜的不同区域,则提示HP在中枢神经系统的弥漫性累及。
对于继发性HP,主要的治疗方案是治疗病因,如曲霉菌性HP需要选择两性霉素B或氟康唑,而结核性HP需要抗结核治疗。目前IHP推荐的一线治疗为糖皮质激素。在使用糖皮质激素治疗前,必须明确IHP的诊断,排除其他诱因,特别是感染,否则糖皮质激素将会加重病情[12]。临床多采取激素冲击治疗,虽然有部分患者在激素减量过程常有症状反复,这可能是由于早期糖皮质激素治疗减量过快或不规律用药所致,但在调整了激素剂量后,症状大部分均可改善,这进一步证实激素冲击治疗的有效性[10]。另外,临床上不乏激素抵抗或在激素减量过程中反复发作的患者,在调整激素剂量后仍未见缓解,此时则需要额外的免疫抑制剂控制病情[13]。T.Bosman等[14]对入组的60名患者采用最多的治疗方案是糖皮质激素治疗(93%),其中糖皮质激素单药治疗占65%。在这些患者中,复发的患者占46%。另有一部分患者联合免疫抑制剂治疗,如硫唑嘌呤、环磷酰胺、甲氨蝶呤,病情均得到了长期控制。但并不是所有的患者合并免疫抑制剂治疗后均能得到症状缓解。据Tomomi Yonekawa 等[2]统计,单纯糖皮质激素治疗对于58.7%患者是有效的,而另外21.4%的患者在糖皮质激素合并免疫抑制剂后得到症状缓解。Duangnapa Roongpiboonsopit等[7]在给予患者糖皮质激素及硫唑嘌呤联合治疗后,临床症状完全康复、反复迁延发作及复发的患者率分别为40%、40%及20%。由此可见,糖皮质激素和免疫抑制剂治疗虽有可观的治疗效果,但仍有一大部分患者无法得到症状缓解。有人建议使用利妥昔单抗治疗此类患者,相关的临床证据也证实了其良好的治疗效果,但将利妥昔单抗作为皮质激素抵抗HP患者的治疗方案还需要进一步的研究[15]。此外,手术去除增生的硬膜也是HP患者的可行性选择,而临床病例也发现术后患者的症状可得到迅速缓解[16]。但是,手术难以切除脊髓腹部的长节段病灶,仅能选择去除尽可能宽的受累硬膜,这限制了手术的适合人群。
本例患者以单纯头痛症状起病,不伴有颅神经麻痹症状。头颅CT可见小脑幕增厚硬脑膜,ANA谱及ANCA谱均为阴性,甲状腺相关抗体滴度明显增加仅提示免疫性因素的参与,血清hs-CRP增加提示体内存在炎症反应。脑脊液压力明显增高,呈炎性改变,细胞中度增加,以单核细胞为主,葡萄糖、氯化物未见明显异常,脑脊液蛋白中度增加,以上均符合上文所述。由于未能发现明确致病诱因,最终诊断为特发性HCP。此患者的轻度肝功能异常可能为乙型肝炎所致。在使用糖皮质激素治疗后,患者的头痛症状明显好转。该患者在北京协和医院行活检,结果显示致密纤维结缔组织,有较多淋巴细胞、浆细胞浸润,提示其为特发性HCP。口服“老鼠药”导致的精神症状导致患者不能配合进食饮水,结合头部MRI上显示的左侧分水岭区弥散受限,部位和病变硬脑膜距离较远,排除HCP相关性脑梗死,最后考虑为低血容量性脑梗死。若HCP患者发生神经功能缺损症状,需要鉴别是HCP的硬脑膜压迫脑组织所致,还是合并其他新发疾病所致,后者发生概率极小,但也不能完全排除,本例患者即为特例之一。HCP合并脑梗死的患者目前未见报道,此患者是首例合并发生的案例。
若患者表现为慢性头痛,同时伴有难以解释的多发性颅神经损伤症状,此时需要考虑HCP的诊断。首先,MRI检查可见典型的硬脑膜肥厚病灶。其次,确定HCP是继发性的还是原发性的。原发性HCP的诊断需要通过血清学检查及脑脊液检查排除结核性、真菌性、莱姆病、梅毒性、颅内感染及肿瘤等病因。特发性HCP主要和自身免疫相关,所以若在给予糖皮质激素及免疫抑制剂治疗后,症状有所改善可进一步确定HCP的诊断。若患者表现为糖皮质激素治疗抵抗,则需要质疑特发性HCP的诊断,此时进行硬膜的活检是必要的[17]。继发性HCP的诊断主要根据病理活检及病因治疗的有效性。若病因难以确定时,试验性治疗可以帮助诊断。大多数HCP患者的预后是良好的。希望能在越来越多的关注下,HCP患者均能得到及时的正确诊断及治疗,从而减轻患者的痛苦及家庭负担,减少社会的压力。
