RANK蛋白表达在胰腺癌组织中的临床意义
2019-11-25肖烨,张健
肖 烨, 张 健
1.徐州医科大学附属医院消化内科,江苏 徐州 221002; 2.浙江大学医学院附属杭州市第一人民医院胃肠外科
胰腺癌是一种起源于胰腺导管上皮的高度恶性肿瘤,具有发病急、进展快、侵袭性强、预后极差的特点,素有“癌中之王”之称,严重威胁人们的生命健康[1]。手术切除是目前临床上治疗胰腺癌的主要手段,但由于胰腺癌早期发病较为隐匿,早期诊断较难,一旦确诊已处于中晚期,甚至已有肿瘤浸润或远处转移,手术治疗效果并不理想,预后极差,5年内生存率不足8%[2]。因此,探寻新型诊断胰腺癌检测指标已成为改善患者预后、延长患者术后生命的首要任务。细胞核因子κB受体活化因子(receptor activator of nuclear factor-κB,RANK)是肿瘤坏死因子受体超家族成员之一,既往研究证实,RANK的表达情况与子宫内膜癌、胃癌、宫颈鳞癌等恶性肿瘤患者的不良预后相关[3-5]。然而,国内外鲜有RANK在胰腺癌组织中的表达情况及临床意义的相关研究。本研究采用免疫组织化学法检测RANK在胰腺癌组织及癌旁组织中的表达情况,并分析RANK与胰腺癌临床病理特征的关系及其对生存的影响。
1 资料与方法
1.1 一般资料收集2014年1月至2018年12月在徐州医科大学附属医院行胰腺癌切除手术的胰腺癌患者标本和临床资料。患者标本包括石蜡包埋的肿瘤组织标本及其相应癌旁组织标本(距癌组织 2~3 cm),临床资料包括患者性别、年龄、既往病史、既往手术史、肿瘤位置、肿瘤大小、肿瘤TNM分期、组织学分级、肿瘤浸润情况、淋巴结转移情况、术后放化疗情况等。纳入标准:均经病理诊断为胰腺癌;均行根治性手术治疗;术前均未接受放化疗;具有完整的临床资料和随访资料。排除标准:临床资料不完整者;随访资料不完整者;有既往恶性肿瘤病史者;伴随其他恶性肿瘤者。共纳入83例胰腺癌患者,男49例,女34例;年龄(50.13±7.46)岁(年龄43~69岁);病理类型:胰腺导管癌67例、黏液癌13例、腺鳞癌2例、小细胞癌1例;肿瘤TNM分期:Ⅰ期9例、Ⅱ期41例、Ⅲ期33例;肿瘤部位:胰头56例、体尾27例。本研究经过我院医学伦理委员会批准,且患者及(或)家属均对本研究知情并签署知情同意书。
1.2 研究方法
1.2.1 免疫组化染色检测:将收集的标本进行切片、烤片,切片厚度约5 μm,然后进行免疫组织化学染色,具体操作步骤如下:(1)将切片放入二甲苯中进行脱蜡处理,然后于无水乙醇、梯度浓度乙醇及高压灭菌纯水中进行水化,清除二甲苯;(2)将水化后的切片放入抗原修复液中,于微波炉中加热至约98 ℃,自然冷却至室温后,于浓度为1 mol/L的TBS溶液中清除抗原修复液;(3)用3%过氧化氢处理切片10 min,灭活内源酶活性;(4)用质量浓度为100 g/L的山羊血清封闭室温封闭30 min;(5)甩掉封闭液,滴加RANK抗体(1∶200,美国Abcam公司,ab13918)覆盖组织,4 ℃过夜;(6)第2天于4 ℃冰箱取出切片,用TBST清洗3次,每次3 min,滴加山羊抗IgG二抗(1∶2 000,美国Abcam公司,ab205719)覆盖组织,室温下孵育30 min;(7)甩掉山羊抗IgG二抗后,用TBST清洗3次,每次3 min,滴加链霉菌抗生物素—过氧化物酶溶液覆盖组织,室温下孵育30 min,结束后用TBS清洗2次,每次3 min;(8)每张片子滴200 μl DAB溶液,室温下孵育5 min,进行DAB显色;(9)苏木素溶液复染约3 min,自来水冲洗约5 min;(10)脱水、封片,在显微镜下观察并拍照。采用TBS代替一抗作为阴性对照。每例标本均重复验证3次。
1.2.2 结果判断:胰腺癌组织中胞膜或胞质内免疫组化阳性反应产物呈紫色或蓝紫色颗粒即为阳性细胞,癌旁组织中胞膜或胞质内免疫组化阳性反应产物呈棕黄色或棕褐色颗粒的细胞即为阳性细胞,计为RANK(+)。在光学显微镜下每张病例切片随机选取10个高倍镜视野(放大400倍)采集图像,应用Image-Pro Plus 6.0软件(美国Media Cybernetics Image公司)选取所分析的阳性区域,并计算积分光密度值(IOD),来反映阳性蛋白的表达强度,IOD=阳性区面积×平均光密度。将所测得的IOD值均按百分位分为4个等级:0~25%为阴性表达,26%~55%为弱阳性表达,56%~75%为中强度阳性表达,76%~100%为高强度阳性表达。其中将阴性及弱阳性(IOD值为0~50%)定义为低表达,将中强度阳性及高强度阳性(IOD值为51%~100%)定义为高表达。本研究采用双盲法阅片,每例标本染色结果均由两名经验丰富的病理科医师进行重复判断3次,结果统一后取其平均值作为最终评分结果。
1.2.3 随访:本研究采用电话或门诊的方式对纳入患者进行随访,确定其肿瘤复发情况及生存时间,以患者死亡作为随访观察终点并定义为结局事件的发生。本研究最后一次的随访时间为2019年1月31日。

2 结果
2.1 RANK蛋白在胰腺癌及癌旁组织中的表达免疫组化结果显示,RANK蛋白在胰腺癌及癌旁组织的细胞质中均有表达,免疫组化阳性反应产物均呈棕黄色或棕褐色。RANK蛋白胰腺癌组织中表达较强,高表达者44例(53.01%),低表达者39例(46.99%)(见图1A、1B);而RANK蛋白在癌旁组织中表达相对较弱,高表达者9例(10.84%),低表达者74例(89.16%)(见图1C、1D),两者比较,差异有统计学意义(χ2=33.954,P<0.001)。进一步统计结果显示,胰腺癌组织中RANK蛋白的表达IOD值(5 165.17±247.42)显著高于癌旁组织(1 040.69±207.64),差异有统计学意义(t=116.333,P<0.001)(见图2)。

图1 RANK蛋白在胰腺癌组织及癌旁组织中的表达情况(放大400倍) A:胰腺癌组织中RANK高表达;B:胰腺癌组织中RANK
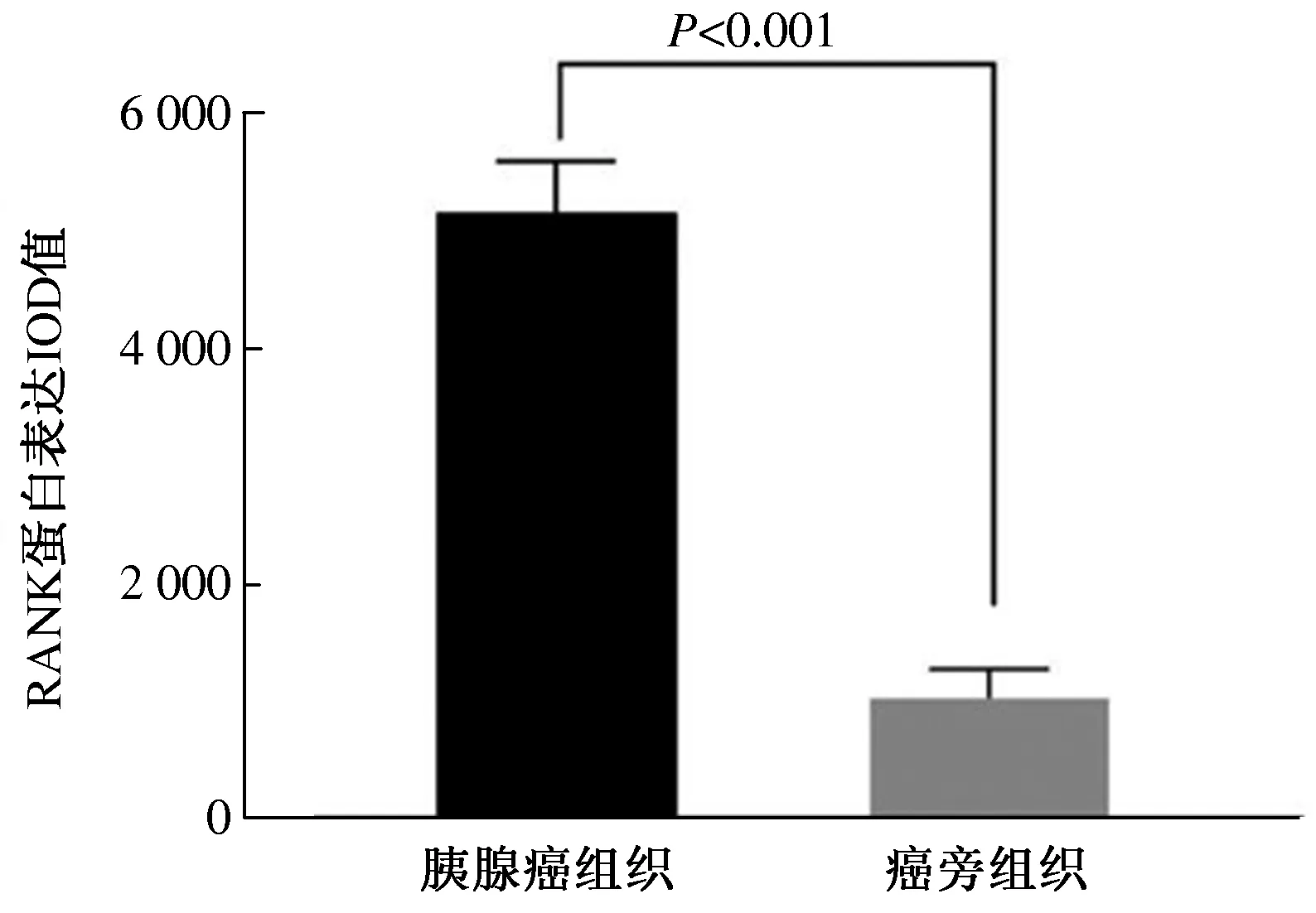
图2 胰腺癌组织与癌旁组织中RANK蛋白表达IOD值比较 Fig 2 Comparison of RANK protein expression IOD
2.2 RANK蛋白表达与胰腺癌临床病理特征的关系RANK蛋白表达在胰腺癌患者的性别、年龄、肿瘤大小、肿瘤位置及肿瘤分化程度方面差异无统计学意义(P>0.05);RANK表达与TNM分期、CA199水平及淋巴转移相关(P<0.05)(见表1)。
2.3 RANK蛋白表达与胰腺癌肿瘤分化程度、TNM分期、CA19-9水平的关系Spearman相关性分析结果显示,胰腺癌分化程度、肿瘤TNM分期与RANK蛋白表达呈负相关;CA19-9水平与RANK蛋白表达呈正相关,差异均具有统计学意义(P<0.05)(见表2)。
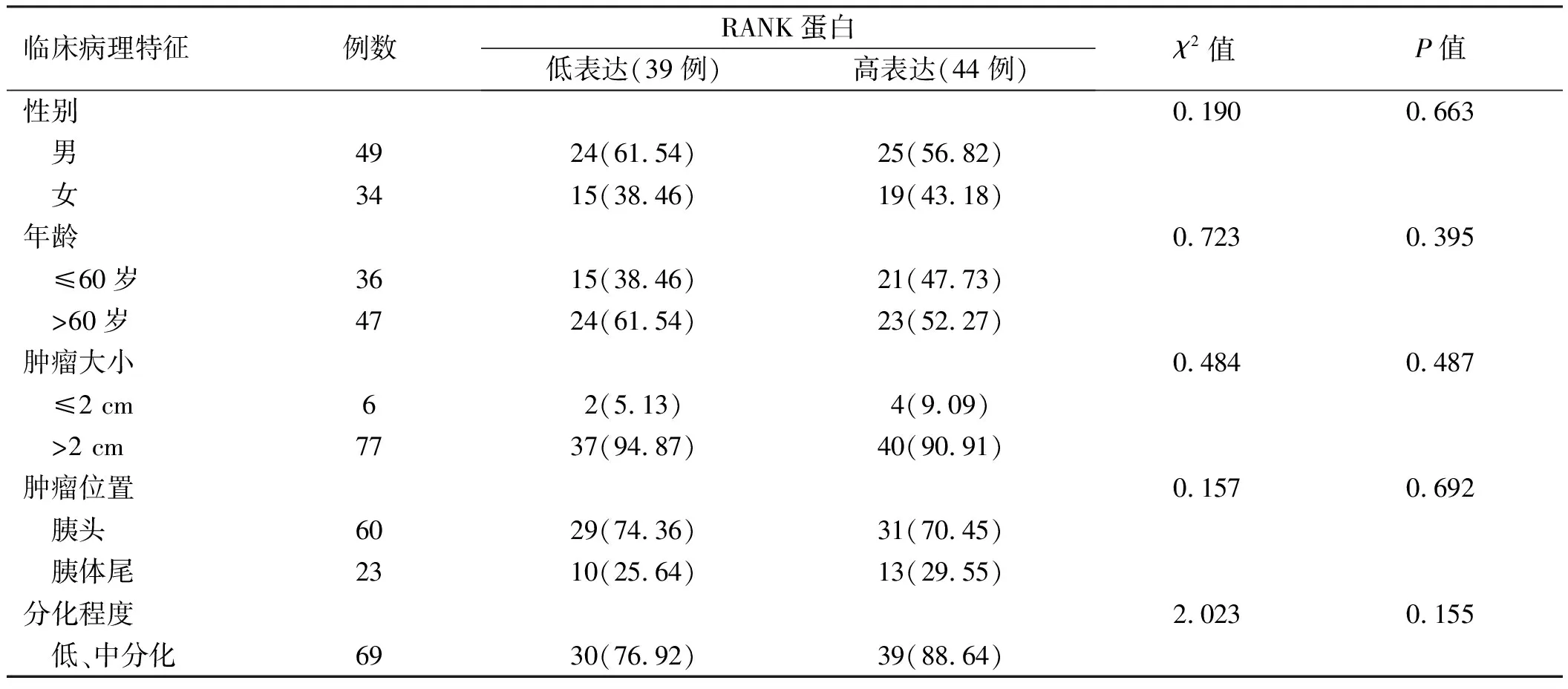
表1 RANK蛋白表达与胰腺癌临床病理特征的关系Tab 1 Relationship between RANK protein expression and clinicopathological characteristics of pancreatic cancer n/%
续表1
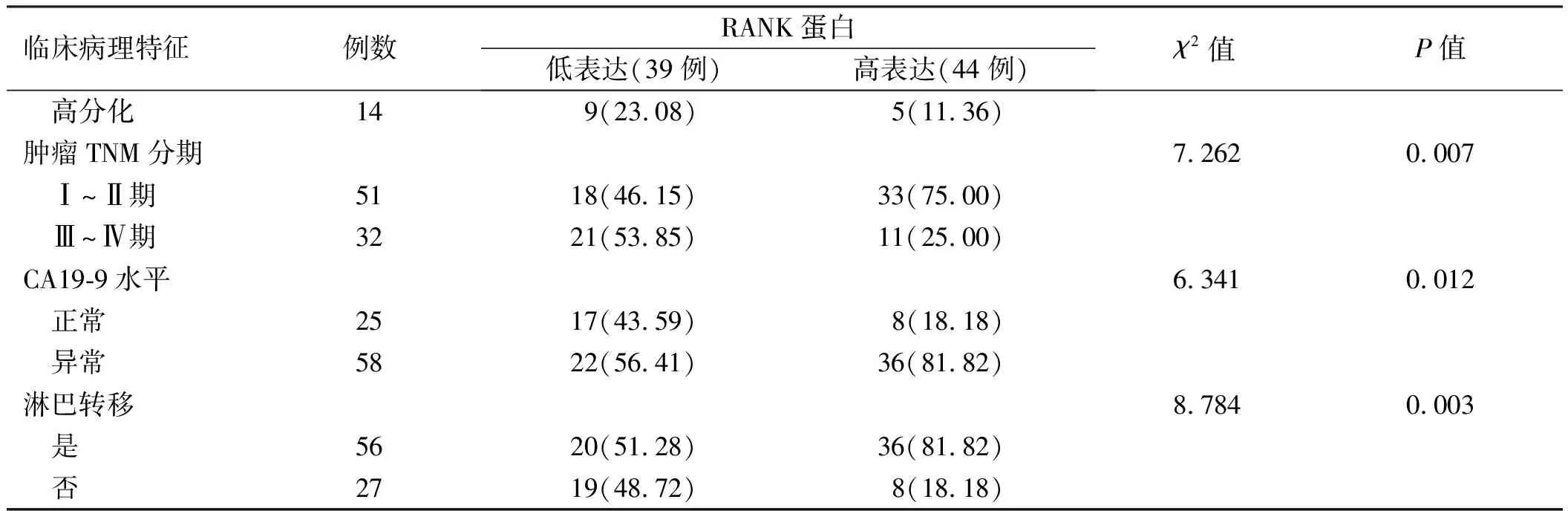
临床病理特征例数RANK蛋白低表达(39例)高表达(44例)χ2值P值 高分化149(23.08)5(11.36)肿瘤TNM分期7.2620.007 Ⅰ~Ⅱ期5118(46.15)33(75.00) Ⅲ~Ⅳ期3221(53.85)11(25.00)CA19-9水平6.3410.012 正常2517(43.59)8(18.18) 异常5822(56.41)36(81.82)淋巴转移8.7840.003 是5620(51.28)36(81.82) 否2719(48.72)8(18.18)
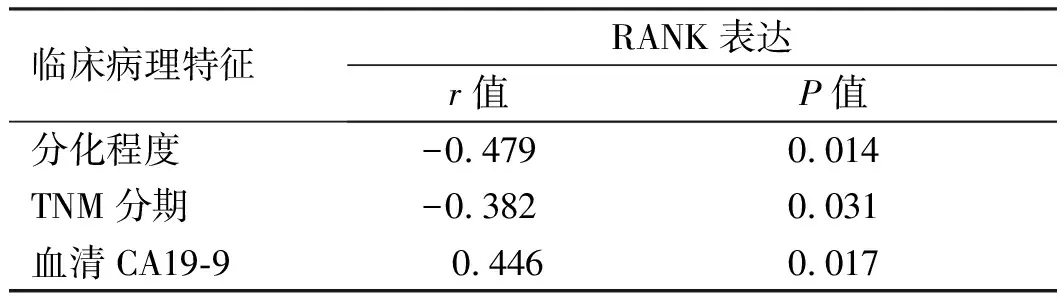
表2 RANK表达与分化程度、TNM分期、血清CA19-9的相关性分析Tab 2 Correlation among RANK expression and differentiation degree, TNM phase, serum CA19-9
2.4 RANK蛋白表达与胰腺癌患者生存期的关系RANK高表达患者中位生存期为12.85个月,RANK低表达患者中位生存期为20.15个月,RANK高表达患者5年内的生存率显著低于RANK低表达患者,(P<0.05),如图3所示。

图3 RANK蛋白表达与生存期的Kaplan-Meier曲线 Fig 3 Kaplan-Meier curve of RANK protein expression and lifetime
3 讨论
近年来胰腺癌的发病率呈逐年上升趋势,且趋于年轻化,而胰腺癌早期诊断比较困难,大部分患者确诊时已经处于中晚期,甚至已有肿瘤浸润或远处转移,错失了最佳手术时机,预后极差[6]。随着生物医学的不断发展,CA19-9、CEA、CA724等生物学标志物已经广泛应用于临床胰腺癌的早期诊断中,由于这些标志物存在诊断假阳性率高、特异性低等缺点,对诊断胰腺癌早期诊断率仍不理想[7-9]。因此,探寻能够有效对胰腺癌进行早期诊断及预后评估的新型指标,已成为改善患者预后、延长患者术后生命的首要任务。RANK来源于树突状细胞,属于Ⅰ类跨膜蛋白,在骨代谢及免疫调节过程中发挥重要作用,近年来有研究发现,RANK在恶性肿瘤的发生、发展和浸润转移中也发挥重要作用[10-11]。既往研究证实,RANK在乳腺癌、肺癌、胃癌、前列腺癌等多种恶性肿瘤组织中表达异常,且与不良预后存在一定的相关性[12-14]。本研究采用免疫组织化学法检测RANK在胰腺癌组织及癌旁组织中的表达情况,结果显示,与癌旁组织相比,RANK蛋白在胰腺癌组织中表达更强,差异有统计学意义,提示RANK蛋白表达量与胰腺癌的发生、发展有关。
核因子-κB受体活化因子/核因子-κB受体活化因子配体RANK/RANKL通路是近年来恶性肿瘤的研究热点,RANK与其配体结合后可诱导胃癌、乳腺癌细胞发生侵袭、转移,从而影响恶性肿瘤的进展[15]。李丹等[16]的相关研究结果显示,RANK蛋白在宫颈鳞癌组织中高表达,RANK高表达与宫颈癌恶性临床病理因素相关,宫颈癌恶性临床病理因素相关,且无论是单因素还是多因素分析结果均显示RANK高表达均是影响胰腺癌患者总生存率及复发率的预后影响因素,说明RANK高表达是宫颈鳞癌患者不良预后的重要影响因素。本研究结果显示,RANK蛋白表达在胰腺癌患者的性别、年龄、肿瘤大小、肿瘤位置及肿瘤分化程度等方面差异无统计学意义;RANK高表达组TNM分期Ⅰ~Ⅱ期、CA19-9水平异常、淋巴转移患者所占比例均显著高于RANK低表达组,差异均有统计学意义,提示RANK高表达可能与胰腺癌组织TNM分期、CA19-9水平及淋巴转移存在一定的相关性,但与患者的性别、年龄、肿瘤大小、肿瘤位置及肿瘤分化程度无关。进一步Spearman相关性分析结果显示,RANK蛋白表达与胰腺癌分化程度、肿瘤TNM分期呈负相关,与CA19-9水平呈正相关,表明RANK蛋白表达越高,胰腺癌分化程度越低,TNM分期越低、CA19-9水平异常越高,进一步提示RANK蛋白表达量与胰腺癌的发生、发展有关。Kaplan-Meier生存曲线分析结果显示,RANK低表达患者的5年生存率显著高于RANK高表达患者,进一步经Log-Rank检验进行组间生存率检验,结果显示,RANK高表达与胰腺癌患者预后不良相关,表明RANK高表达可能是导致胰腺癌患者不良预后的一个重要原因。
综上所述,RANK蛋白在胰腺癌组织中高表达,且与恶性临床病理特征及不良预后相关,可作为胰腺癌早期诊断及预后判断的一项重要指标。
