胃窦炎性纤维性息肉并重度贫血: 1例报道并文献复习
2019-11-25钟梓尤
张 斌, 钟梓尤, 李 健
1.广州中医药大学第四临床医学院,广东 深圳 518000; 2.深圳市中医院脾胃病科
病例患者,女,43岁,因“头晕乏力14 d”于2018年7月9日入院。患者2018年6月25日“喝凉茶”(具体成分不详)后出现乏力,头晕眼花,以体位改变时明显,解鲜血便2次,量不详,当时未予重视。次日出现乏力、头晕眼花加重,解深褐色大便,糊状不成形,1~2次/d,100~200 g/次,伴呕吐胃内非咖啡色容物多次,无意识丧失,无头痛,无偏身肢体不利,无胸闷心慌,无畏寒发热等,患者未予重视,仍未行诊疗。2018年7月9日患者因上述症持续无缓解至我院门诊就诊,查血常规示:RBC 2.17×1012L-1,Hb 44 g/L,HCT 15.6%,遂由门诊收入住院治疗。入院后予输血纠正贫血治疗后患者头晕乏力症状明显改善,完善尿常规、粪便常规及隐血、血生化、缺铁性贫血相关、溶贫筛查、地贫基因筛查、结肠镜等均未见异常,全腹增强CT除见胃窦局部不均匀增厚及增强外无其他特别所见,胃镜检查示:胃窦前壁见一不规则广基隆起性病变,边界欠清,大小约2.0 cm×3.0 cm,富士电子分光技术(FICE)观察腺管开口增粗,尚规则,顶端可见一溃疡,大小约0.8 cm×0.6 cm ,表面覆薄白苔,周边黏膜肿胀明显(见图1);胃镜诊断:(1)胃窦隆起性病变伴溃疡形成;(2)浅表性胃炎(Ⅲ级);幽门螺杆菌(+)。超声内镜(endoscopic ultrasonography, EUS)示: 胃窦前壁侧病变位置可见胃壁结构完整,第二层局部呈低回声增厚,边界尚清楚,内部回声欠均匀,中心区可见呈高回声团溃疡区(见图2);EUS下考虑起源于第二层黏膜肌层,淋巴瘤可能。于胃窦隆起溃疡处取活检病理示轻度浅表性胃炎。于2018年8月4日在全麻下行胃窦隆起性病变内镜下黏膜剥离术(ESD)。术后病理及免疫组化:(胃窦、ESD标本)符合炎性纤维性息肉(inflammatory fibroid polyp, IFP)(见图3)。免疫标记结果:梭形细胞CD34(+)、CD117(-)、SMA(-)、Calponin(-)、h-Caldesmon(-)(见图4)。
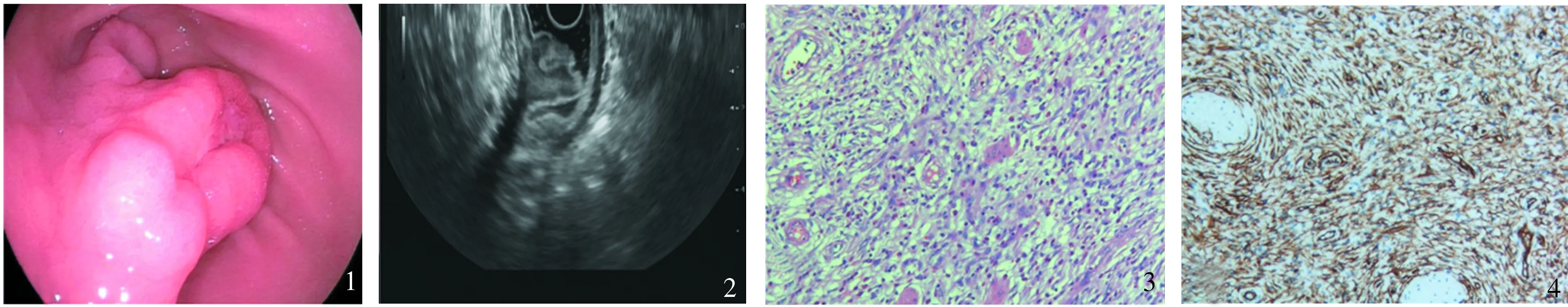
图1 胃镜检查;图2 EUS检查;图3 术后病理(HE染色,放大 200 倍);图4 免疫组化(HE染色,放大200倍)Fig 1 Gastroscope examination; Fig 2 EUS examination; Fig 3 Pathological picture of surgical specimen; Fig 4 Immunohistochemistry
讨论IFP最早在1920年被KONJETZNY[1]描述为“胃纤维瘤”。在1949年,VANEK[2]首次以“胃肠道黏膜下肉芽肿伴酸性粒细胞浸润”进行命名并对其阐述。1953年,RANIER和HELWIG[3]第1次使用了“炎性纤维性息肉”的名称,并一直沿用至今。IFP的病因和发病机制一直以来存在广泛争议。传统上,IFP被认为是炎性或反应性的,一种特殊类型的非肿瘤性病变,然而,并无具体的刺激或病原体被确认[4]。近年来,有学者[5]研究发现,IFP伴有血小板衍生生长因子受体α(platelet-derived growth factor receptor alpha,PDGFRα)激活的基因突变(尤其是12号外显子)。基于此,第四版《WHO消化道肿瘤病理学和遗传学分类》中将IFP归类为消化道良性间叶源性肿瘤[6-7]。
IFP可以发生于多个年龄段,以女性多见,发生部位主要是胃和大肠,其次是小肠,也可见于食管、阑尾和肛管[8-9]。IFP的临床症状大多并无特异性,取决于病变的部位和大小,胃IFP可出现呕吐、腹痛、出血等症状,小肠的病灶可导致肠套叠,病变在大肠则可出现腹痛、腹泻、出血等症状[6-10]。肉眼上,IFP一般表现为单发的、无包膜的、息肉样病变,直径多<5 cm。病变位于黏膜下层,但多数病例也涉及黏膜,黏膜表面光滑或溃疡[10]。影像学上,大多数病灶表现为较大的壁内肿块,但很难与胃肠道其他壁内或腔内病变鉴别[11]。而由于IFP起源于黏膜下,内镜下活检多表浅,不能取到足够的组织用于诊断,多仅提示为炎症或溃疡改变。EUS对IFP的诊断有一定帮助,其EUS特征多表现为边缘模糊、低回声、均质外观,位于第二或第三层,但不易与其他黏膜下肿物,如异位胰腺、恶性淋巴瘤等鉴别[12-13]。EUS更重要的优势也在于其有助于判断病变深度和判断是否可以内镜下切除。病理上,IFP主要由增生的梭形、卵圆形纤维母细胞和显著的毛细血管网构成,瘤细胞形态温和,核分裂像少见,伴有各种炎细胞浸润,主要是嗜酸性粒细胞,但也有肥大细胞、淋巴细胞和浆细胞[7,14]。尽管IFP以血管周围有梭形或上皮样肿瘤细胞围绕呈葱皮样改变为特征,但有文献报道只有约1/2的病例有这种外观[9]。免疫组化染色显示,Vimentin和CD34几乎全部阳性,而SMA、HHF-35、KP1和Mac 387呈可变染色,CD117、DOG1、NSE和S-100均阴性[15]。据其特征性组织病理及免疫组化表现,可与胃肠道间质瘤、炎性纤维母细胞瘤、神经鞘瘤等黏膜下病变区分[16]。
综上可见,IFP在临床上很难诊断,几乎所有的病例都需要组织学证实。本例患者,中年女性,以便血后出现明显头晕乏力就诊,入院前血常规证实为重度贫血,住院期间完善相关检查排查了常见贫血原因均无其他明显阳性所见,胃IFP继发出血被强烈怀疑是该患者重度贫血的原因。本病例内镜见病变大小4.0 cm×4.5 cm,其上黏膜表面可见一大小约0.8 cm×0.6 cm溃疡, 表面覆薄白苔,周边黏膜肿胀,提示活动期溃疡。结合患者病史,便血后半个月就诊行胃镜检查所见,其出血归因于该溃疡的可能性极大。而患者在诊断过程中,CT增强扫描提示胃窦部局部不均匀增强,不能除外恶性病变,术前内镜下活检病理示轻度浅表性胃炎,EUS所见符合黏膜下病变,为后期病变行ESD提供了支撑,最终术后标本病理见大量新生毛细血管及其周围梭形细胞围绕呈葱皮样改变的典型表现,免疫组化结果显示,梭形细胞CD34(+)、CD117(-)、SMA(-),符合IFP,最终确诊为胃IFP。
IFP的治疗可以选择内镜下切除和手术治疗。一般病变较小的胃或大肠IFP可选择内镜下切除。广基大病灶或小肠病灶,可行外科手术治疗[10]。另有报道[18],IFP可合并其他良性病变或恶性肿瘤,应注意以免遗漏。本病例采用ESD剥离病变,术后随访患者无特殊不适,复查血常规贫血纠正。IFP为消化道良性间叶源性肿瘤,预后良好,一般治疗彻底后极少复发。
结合本病例及文献检索IFP相关病例报道[9,17-20],以出血为首发症状就诊的占大多数,考虑与IFP病理结构密切相关,大量新生血管周围梭形或上皮样肿瘤细胞围绕呈葱皮样改变,该组织改变是否与易出血相关,及其发生、发展机制,尚需进一步深入研究。
