3种水分条件下深色有隔内生真菌(DSE)对芦苇生长及生理特性的影响
2019-11-22徐舟影肖宗何聪林云李静班宜辉
徐舟影 肖宗 何聪 林云 李静 班宜辉

摘要 [目的]研究在3種水分条件下接种深色有隔内生真菌(DSE)菌株沙门外瓶柄霉(Exophiala salmonis)对芦苇生长及其生理特性的影响。[方法]采用盆栽试验的方法,从芦苇生长指标、渗透调节物质、抗氧化酶活性、叶绿素含量等方面研究DSE对芦苇幼苗的接种效应。[结果]在水分正常条件下,接种DSE的芦苇幼苗生物量增加21.8%,可溶性糖含量增加19.1%,脯氨酸大幅增加70.2%,SOD活性提高27.7%,CAT活性提高18.4%(P<0.05);水淹胁迫下,接种DSE后芦苇与对照相比在生物量、地径、叶绿素含量方面差异显著(P<0.05),分别增加了42.8%、14.3%和34.4%,而可溶性糖和脯氨酸含量则分别降低20.7%和11.0%;干旱胁迫下,接种DSE后芦苇生物量和叶绿素含量分别减少13.3%和23.2%,可溶性糖、SOD和CAT分别降低17.7%、73.7%和10.8%,MDA含量反而提高40.3%(P<0.05)。[结论]在正常水分下,接种DSE对宿主生长和光合作用有明显的促进作用,渗透调节能力和抗氧化能力都有显著提高;水淹胁迫下,接种DSE对芦苇的生长有一定促进作用,可通过渗透调节作用降低水淹环境对植物的伤害;干旱胁迫下,芦苇的光合作用、渗透调节作用和抗氧化能力均有所降低,抗旱性与抗逆性也都有所下降,此条件下DSE对芦苇生长产生不利影响。双因素方差分析结果表明,接种DSE和不同水分条件均对芦苇各项生长及生理指标产生显著影响(P<0.05),其中水分条件对芦苇的苗高、地径、鲜重和MDA含量产生极显著影响(P<0.001),接种DSE对芦苇根系活力、可溶性糖、SOD和CAT含量有极显著影响(P<0.001)。
关键词 深色有隔内生真菌;芦苇;水分胁迫;生长指标;渗透调节物质;抗氧化酶活性
中图分类号 X173文献标识码 A
文章编号 0517-6611(2019)20-0048-06
doi:10.3969/j.issn.0517-6611.2019.20.014
开放科学(资源服务)标识码(OSID):
Effects of Dark Endophytic Fungi (DSE) on the Growth and Physiological Characteristics of Reed under Three Water Conditions
XU Zhou ying1 ,XIAO Zong1 ,HE Cong2 et al
(1.School of Civil Engineering and Architecture, Wuhan University of Technology, Wuhan, Hubei 430070;2.College of Chemistry, Chemical Engineering and Life Science, Wuhan University of Technology, Wuhan, Hubei 430070)
Abstract [Objective]In order to study the effects of Phragmites australis inoculated with DSE on the growth and physiological characteristics of reeds under three water conditions. [Method]This experiment used pot experiment to study on the inoculation effect of DSE on reed seedlings from various aspects such as plant growth index, osmotic adjustment substance, antioxidant enzyme activity and chlorophyll content. [Result]Under normal water condition, the biomass of reed seedlings inoculated with DSE increased by 21.8%, the soluble sugar content increased by 19.1%, the proline increased by 70.2%, the SOD activity increased by 27.7%, and the CAT activity increased 18.4% (P<0.05). Under flooding stress, there was significant difference in biomass, ground diameter and chlorophyll content of reeds after inoculation with DSE compared with the control (P<0.05), which increased by 42.8%, 14.3% and 34.4%, respectively. While the content of soluble sugar and proline decreased by 20.7% and 11.0%, respectively. Under drought stress, the biomass and chlorophyll content of reed decreased by 13.3% and 23.2%, respectively. Soluble sugar, SOD and CAT decreased by 17.7%, 73.7% and 10.8%, respectively, and MDA increased by 40.3% (P<0.05). [Conclusion] Under normal water condition, inoculation of DSE can significantly promote the growth and photosynthesis of the host, and the osmotic adjustment ability and antioxidant capacity are significantly improved. Under the flooding stress, DSE has a certain promoting effect on the growth of reed, which can reduce the damage of plants in flooded environment through osmotic adjustment. Under drought stress, photosynthesis, osmotic adjustment and antioxidant capacity of reeds were all reduced, and drought resistance and stress resistance were also reduced. Under this conditions, DSE had an adverse effect on the growth of reeds. Two way analysis of variance showed that DSE and different water conditions had significant effects on the growth and physiological indexes of reeds, and different water conditions had an extremely significant effect on the fresh weight, seedling height, ground diameter and MDA content of reeds (P<0.001). DSE has an extremely significant effect on the root activity, soluble sugar, SOD and CAT content of reeds (P<0.001).
1.5 数据处理
试验数据采用Microsoft Excel和SPSS 19.0软件进行统计分析,计算平均值±标准差,处理后的数据采用Sigmaplot 10.0进行绘图,用LSD法检验各处理平均值在0.05和0.001水平上的差异显著性。双因素方差分析采用Duncan检验方法。所有数据均为5次重复的平均值。
2 结果与分析
2.1 3种水分条件下DSE在芦苇根系的侵染率
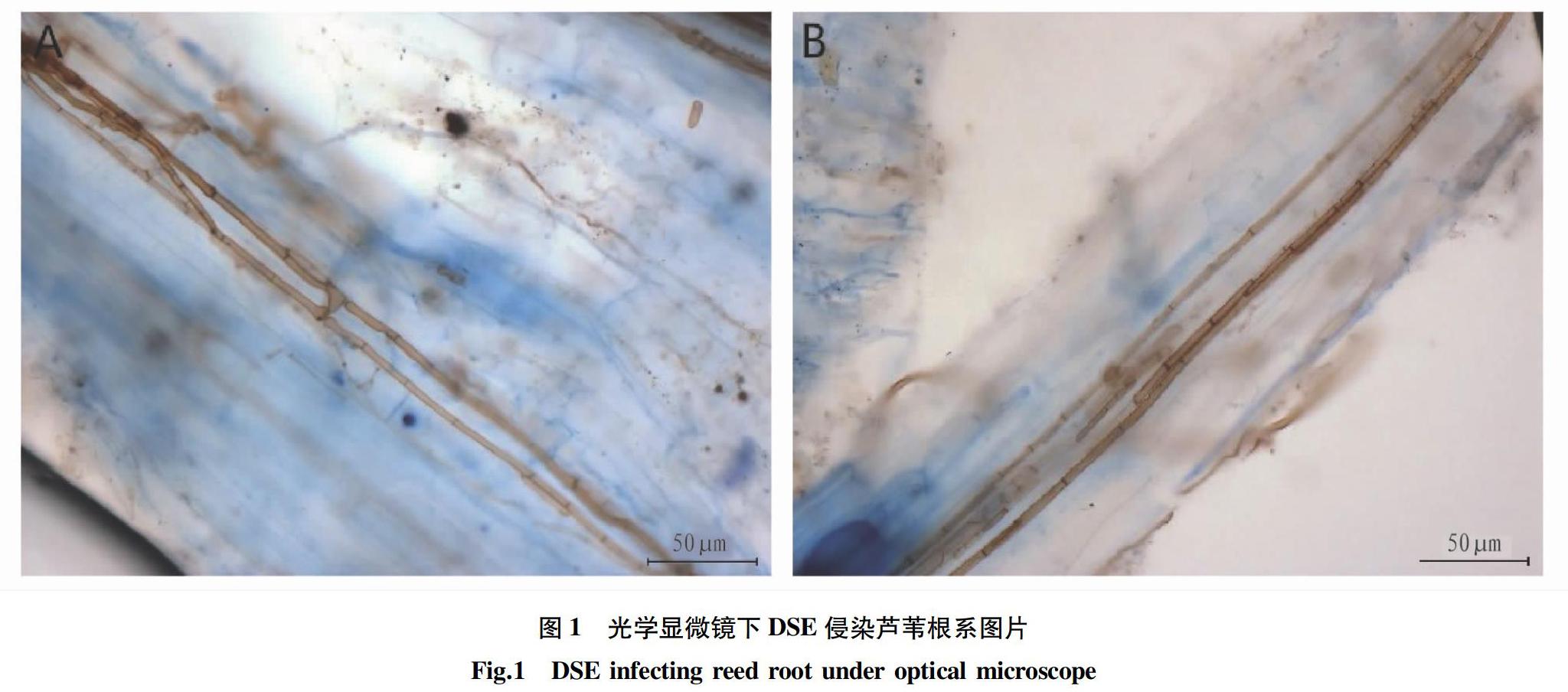
光学显微镜下沙门外瓶柄霉在芦苇根系的形态如图1所示,沙门外瓶柄霉在芦苇根系细胞间隙和细胞内形成大量的棕色有隔菌丝。不同水分条件下DSE在芦苇根系的侵染率见图2,单因素方差分析发现,水分正常和水淹条件下,DSE侵染率无显著差异(P>0.05),而干旱胁迫下的侵染率分别比水淹组、正常组高15.0%和12.5%(P<0.05)。这说明DSE侵染活性会明显受到土壤水分条件的影响,在基质含水量降低时,DSE更易与芦苇幼苗建立共生关系,基质含水量增加至水淹状态时,DSE侵染率下降,但与正常水分条件相比,未达到显著水平(P>0.05)。
2.2 接种DSE对芦苇株高、地径、根长和鲜重的影响
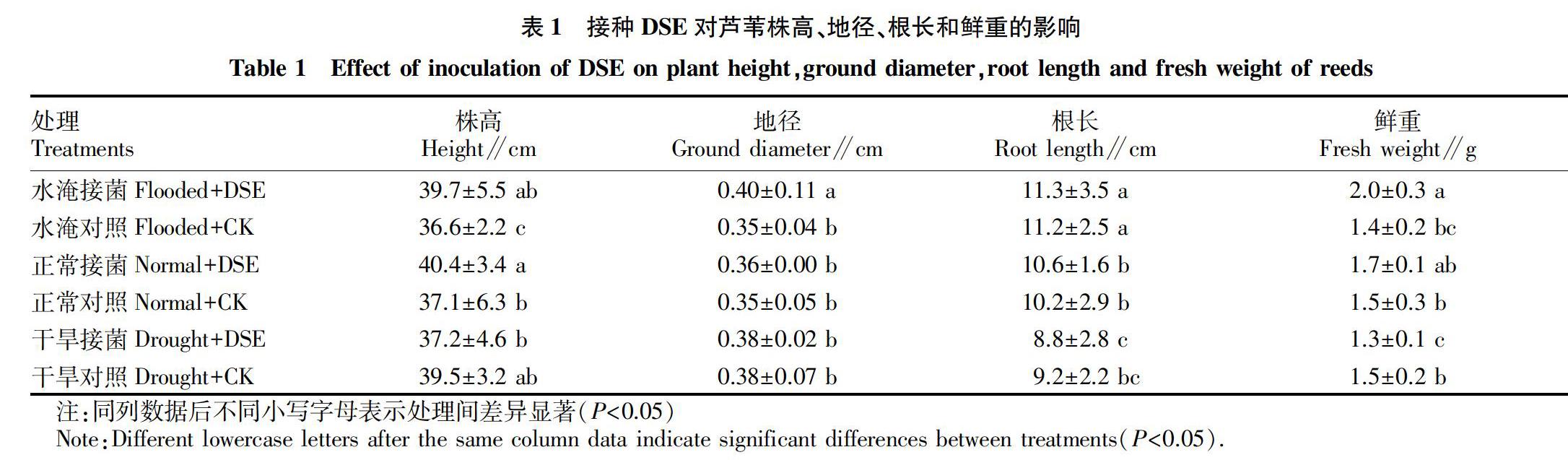
由表1可知,接种沙门外瓶柄霉的芦苇幼苗的苗高在水淹和正常水分条件下都显著高于对照组(P<0.05),干旱试验组平均苗高小于对照组,但差异不显著(P>0.05),可见在正常和水淹条件下,接种DSE能促进湿地宿主植物向上生长。水淹条件下接种DSE显著增加了蘆苇的地径(P<0.05),而在正常和干旱条件下,接种和非接种处理下芦苇地径没有显著差异(P>0.05)。芦苇根长方面,3种水分状态下,接种DSE与否并未对芦苇根长产生显著性影响(P>0.05)。水淹和正常水分条件下,接种DSE的试验组芦苇幼苗的鲜重大于对照组,但仅水淹条件下差异显著(P<0.05),而干旱胁迫下,接种处理的试验组芦苇鲜重显著小于对照组(P<0.05)。
2.3 接种DSE对芦苇幼苗根系活力的影响
由图3可知,接种沙门外瓶柄霉后,3种水分条件下芦苇的根系活力均有不同程度的提高。其中,正常和干旱胁迫下,接菌试验组芦苇根系活力显著提高(P<0.05),分别比对照组提高了8272%和22.11%;水淹条件下,接种DSE的芦苇幼苗根系活力提高了60.17%,但与未接种对照相比,差异不显著(P>0.05)。由此可知,在3种水分条件下,接种DSE均能不同程度地提高芦苇的根系活力。
2.4 接种DSE对芦苇渗透调节物质的影响
由表2可知,在水淹和干旱条件下,接种沙门外瓶柄霉后,芦苇幼苗的可溶性糖含量与未接种对照相比分别下降20.6%和11.9%,差异达到显著水平(P<0.05),而在正常水分条件下,芦苇体内的可溶性糖含量提高了18.8%,但与未接种对照相比差异并不显著(P>0.05)。干旱和正常水分条件下,接种DSE均显著提高了芦苇幼苗可溶性蛋白含量(P<0.05),与未接种对照相比分别提高了47.80%和9.57%,而水淹条件下不同接种处理可溶性蛋白差异不显著(P>0.05)。根据方差分析结果,正常和干旱条件下接种DSE的试验组芦苇幼苗的脯氨酸含量都有显著性提高(P<0.05),说明芦苇受到水分胁迫的程度得到缓解。
2.5 接种DSE对芦苇幼苗抗氧化物质的影响
由表3可知,水淹和正常水分条件下,接种DSE的试验组的SOD和CAT活性均高于对照组;与未接种对照组相比,水淹和正常水分下接种DSE的芦苇幼苗SOD活性分别提高了3.3%和27.7%,但差异并不显著(P>0.05);接种DSE的芦苇CAT活性显著性提高(P<0.05),与对照相比分别提高了5.0%和18.4%。干旱条件下,接种DSE的芦苇幼苗SOD和CAT活性与对照相比分别下降了73.7%(P<0.05)和10.8%(P>0.05)。在正常水分下,接种DSE的芦苇体内MDA含量无明显变化(P>0.05);干旱下芦苇苗体内MDA含量大幅升高40.31%(P<0.05);水淹条件下,接种DSE降低了芦苇苗体内53.7%的MDA含量。
2.6 接种DSE对芦苇幼苗叶绿素含量的影响
由图4可知,水淹和正常水分下接种DSE的芦苇叶绿素总量分别比对照组提高34.4%(P<0.05)和9.4%(P>0.05),而干旱胁迫条件下,接种DSE的试验组芦苇幼苗叶绿素总量比对照组低23.2%(P<0.05)。因此,水淹和正常水分下,接种DSE有利于芦苇幼苗叶绿素的合成,而在干旱胁迫下,DSE的接种对植物光合色素的积累产生不利影响。
2.7 双因素方差分析
双因素方差分析(表4)表明,接种DSE、不同水分条件以及二者交互作用均对芦苇苗高、地径、根长、鲜重等生长指标产生显著影响(P<0.05),其中水分条件对芦苇鲜重、苗高和地径的影响达到极显著水平(P<0.001)。接种DSE和不同水分条件对芦苇根系活力、可溶性糖、可溶性蛋白和脯氨酸含量有显著作用(P<0.05),其中接种DSE对芦苇根系活力、可溶性糖含量有极显著影响(P<0.001),但二者交互作用对宿主的根系活力、可溶性糖、可溶性蛋白和脯氨酸含量的影响不显著(P>0.05)。接种DSE和不同水分条件及二者交互作用对芦苇的SOD、CAT活性均有显著作用,其中接种DSE对SOD和CAT有极显著作用(P<0.001)。接种DSE和不同水分条件均对芦苇MDA和叶绿素含量有显著影响,其中水分条件对MDA含量有极显著影响,但二者交互作用对MDA和叶绿素含量的影响不显著。
3 讨论与结论
3.1 正常水分条件下DSE对芦苇生长的影响
绝大部分的内生真菌能够增加宿主地上部和/或地下部的生物量,这可能与植物激素的诱导及合成有关。研究发现,DSE可以通过提高硝酸还原酶和淀粉水解酶葡聚糖水合激酶的表达,促进植物体内N的积累,从而对烟草(Nicotiana tabacum L.)和拟南芥(Arabidopsis thaliana)的生长表现出明显的促生作用[22]。此外,DSE还可以与许多双子叶植物和单子叶植物(如大麦、油菜、拟南芥、烟草等)建立互惠共生关系,提高宿主对营养元素的吸收,促进生物量的增加[23-24]。
在该试验中,水分正常条件下接种DSE后,芦苇幼苗的苗高、地径、根长均有明显增加,生物量增加了21.8%,可溶性糖含量增加了19.1%,可溶性蛋白含量增加了9.6%,脯氨酸含量大幅增加了70.2%,SOD活性提高了27.7%,CAT活性提高了18.4%,叶绿素含量小幅提升8.6%。可知,在正常水分条件下,DSE对植物的生长和光合作用产生积极的影响,接种后芦苇的渗透调节能力、抗氧化能力和抗逆性也都有所提升,这与大多数研究结论一致。
3.2 水淹胁迫下DSE对芦苇生长的影响
有研究表明,水淹胁迫对植物生长和根部结构均有强烈的限制[25]。在该研究中,尽管芦苇株高、地径、根长和鲜重都由于水淹而减少,但可看出这些减少并没有统计学上的显著性(P>0.05),因此芦苇的生长没有明显被40 d的水淹所抑制。通常认为,水淹会抑制植物对营养的吸收從而影响植物的生长[26]。而在该试验中,水淹胁迫下接种了DSE的植株与未接种相比植物的苗高、地径、鲜重和叶绿素含量都有显著提高(P<0.05),表明DSE可能是通过菌丝对养分的运输功能增加了营养的吸收。
水淹是造成植物根系活力下降的一个重要原因,并且根系活力的降低与水淹胁迫的程度密切相关。同样的情况也发生在对水稻(Oryza sativa)和黄瓜(Cucumis sativus L.)的耐淹性研究上[27]。在该试验中,水淹条件下接种DSE能显著提高根系活力(P<0.05),这可能与线粒体的呼吸强弱有关。植物根部的线粒体呼吸作用是一种获得能量的基础方式,并且依赖于存在土壤空隙间的有效氧气含量。随着氧气含量的降低,线粒体的呼吸活动会逐渐受到抑制[28]。该试验中水淹条件下土壤氧气含量趋于贫乏,因此根系活力有所降低。而接种了DSE的试验组与对照组相比,出现了根系活力有显著性提升的现象(P<0.05),说明定殖了DSE的植物根部能更有效地利用氧气。
在水淹胁迫下接种DSE后,可以明显观察到可溶性糖、可溶性蛋白和脯氨酸含量的降低。显然,DSE的接种导致植物在水淹条件下消耗了更多的渗透调节物质。Tan等[29]对植物在水淹状态下的渗透调节物质的研究表明,尽管遭受水淹的植物体内渗透调节物质的含量会有一定程度的减少,但耐淹能力更强的植物可能拥有更高效的渗透调节物质代谢机制。在该试验中,尽管水淹情况下植物的可溶性糖、可溶性蛋白和脯氨酸含量均有所降低,但它们仍然维持在一个相对较高的水准。然而,该研究发现,接种了DSE后加剧了植株根部渗透调节物质含量的降低(P<0.05)。DSE侵染植物根部时,菌丝体定殖于植物根部的内皮层,有时进入到导管中,为宿主提供了一条稳定的营养运输通道,而微菌核在内外皮层细胞中起到了积累糖分蛋白和多磷酸盐的作用[30]。该研究表明水淹条件下DSE在芦苇根系的侵染率有所降低。基于此,可以推断接种DSE可能借助于菌丝体和微菌核的功能作用减弱养分的分解运输和增强碳水化合物的转化来改善其对水淹胁迫的响应。
水淹通常造成根际和根内氧气的缺乏,因此在植物体内易造成氧化胁迫[31]。活性氧过度增加,会对脂质、蛋白和核酸中造成氧化伤害[32]。SOD存在于所有好气微生物中,它在清除本体亚细胞结构产生的活性氧、防卫植物抵抗氧胁迫中扮演了重要的角色,而CAT在缺氧环境下的重要性在于它可以利用过氧化产物H2O2释放出O2。MDA是膜脂过氧化的最终分解产物,其含量可以反映植物遭受逆境伤害的程度。水淹状态下,与未接种对照相比,接种DSE的芦苇幼苗SOD、 CAT活性均有所提升,MDA大幅下降,说明接种DSE提高了宿主植物的抗逆能力。
3.3 干旱胁迫下DSE对芦苇生长的影响
有研究表明,在干旱胁迫下,接种DSE能够提高植物的相关生长指标,如光合速率、生物量以及抗氧化酶的活性等,同时降低MDA、脯氨酸的含量,从而提高植物的抗旱性[33-34]。在该试验干旱胁迫下,与未接种对照组相比,接种DSE后的芦苇幼苗的株高、地径、根长、鲜重、叶绿素、可溶性糖、SOD和CAT等指标均有不同程度的降低,MDA含量反而有大幅度上升。这说明接种DSE对宿主的生长、抗氧化性、渗透调节能力和抗逆性均有所抑制。胡桂馨等[35]对高羊茅的研究中也出现了类似的结论,认为有可能是接种DSE后某种酶被激发而抑制另一种酶的活性所致。黄承玲等[36]研究证明,干旱胁迫的时间和程度对植物也有很大影响。随着干旱胁迫时间的延长,土壤含水率逐渐下降,宿主植物叶片的SOD、POD、CAT活性呈现先升后降的趋势,而MDA含量则先升后降再升,说明不同植物本身的防御系统启动时间有差异,一些植物需要有适应过程。因此,在今后的研究中,应测定不同干旱胁迫时间及胁迫程度内植物酶的活性以及MDA含量的变化,才能进一步了解接种DSE的植物经干旱胁迫后引起的生理生化反应机制及其对宿主抗旱性的影响。此外,DSE与植物间的相互作用是非常复杂的,它们通过多样化途径来增强植物体的营养生理和抗性机能,但这种生理功能的实现依赖于双方的调控机制,所以宿主种类、真菌基因型以及环境因子(如温度、水分、土壤等)等都会对互作结果产生很大影响。因此,在以后深入探讨植物与DSE的互作机制时应该充分考虑环境影响、植物细胞生理生化的变化和相关抗性基因表达等因素。
参考文献
[1] ZHAO X F,YUAN S H,SONG H C,et al.Arbuscular mycorrhizal and dark septate fungal associations in riparian plants of the Three Gorges Reservoir Region,Southwest China[J].Aquatic botany,2016,133:28-37.
[2] XIE L L,HE X L,WANG K,et al.Spatial dynamics of dark septate endophytes in the roots and rhizospheres of Hedysarum scoparium in northwest China and the influence of edaphic variables[J].Fungal ecology,2017,26:135-143.
[3] ROTHEN C,MIRANDA V,ARANDA-RICKERT A,et al.Characterization of dark septate endophyte fungi associated with cultivated soybean at two growth stages[J].Applied soil ecology,2017,120:62-69.
[4] 邓勋,宋小双,尹大川,等.深色有隔内生真菌提高宿主植物抗逆性的研究进展[J].安徽农业科学,2015,43(31):10-1 17.
[5] JUMPPONEN A,MATTSON K G,TRAPPE J M.Mycorrhizal functioning of Phialocephala fortinii with Pinus contorta on glacier forefront soil:Interactions with soil nitrogen and organic matter[J].Mycorrhiza,1998,7(5):261-265.
[6] UPSON R,READ D J,NEWSHAM K K.Nitrogen form influences the response of Deschampsia antarctica to dark septate root endophytes[J].Mycorrhiza,2009,20(1):1-11.
[7] BAN Y H,XU Z Y,YANG Y R,et al.Effect of dark septate endophytic fungus Gaeumannomyces cylindrosporus on plant growth,photosynthesis and Pb tolerance of maize(Zea mays L.)[J].Pedosphere,2017,27(2):283-292.
[8] 农倩,张雯龙,蓝桃菊,等.一株抗香蕉枯萎病DSE菌株的筛选鉴定及抗病机理初探[J].热带作物学报,2017,38(3):559-564.
[9] BARROW J R,AALTONEN R E.Evaluation of the internal colonization of Atriplex canescens(Pursh)Nutt.roots by dark septate fungi and the influence of host physiological activity[J].Mycorrhiza,200 11(4):199-205.
[10] RAJ KRICˇ N,PONGRAC P,KLEMENC M,et al.Mycorrhizal colonisation in plants from intermittent aquatic habitats[J].Aquatic botany,2006,85:331-336.
[11] DOLINAR N,REGVAR M,ABRAM D,et al.Water level fluctuations as a driver of Phragmites australis primary productivity,litter decomposition,and fungal root colonization in an intermittent wetland[J].Hydrobiologia,2016,774(1):69-80.
[12] STEVENS K J,WELLNER M R,ACEVEDO M F.Dark septate endophyte and arbuscular mycorrhizal status of vegetation colonizing a bottomland hardwood forest after a 100 year flood[J].Aquatic botany,2010,92:105-111.
[13] 李芳芳.白洋淀湿地植物AM真菌和DSE物種多样性及DSE重金属抗性研究[D].保定:河北大学,2017.
[14] YAZDI S E,PRINSL O G,HEYMAN H M,et al.Metabolomic analysis on anti HIV activity of selected Helichrysum species[J].South African journal of botany,2017,109:376.
[30] YU T,NASSUTH A,PETERSON R L.Characterization of the interaction between the dark septate fungus Phialocephala fortinii and Asparagus officinalis roots[J].Canadian journal of microbiology,200 47(8):741-753.
[31] SAIRAM R K,KUMUTHA D,EZHILMATHI K,et al.Waterlogging induced oxidative stress and antioxidant enzyme activities in pigeon pea[J].Biologia plantarum,2009,53(3):493-504.
[32] HOSSAIN Z,LPEZ CLIMENT M F,ARBONA V,et al.Modulation of the antioxidant system in citrus under waterlogging and subsequent drainage[J].Journal of plant physiology,2009,166(13):1391-1404.
[33] WANG B X,SEILER J R,MEI C S.A microbial endophyte enhanced growth of switchgrass under two drought cycles improving leaf level physiology and leaf development[J].Environmental and experimental botany,2016,122:100-108.
[34] ANSARI A,RAZMJOO J,KARIMMOJENI H.Mycorrhizal colonization and seed treatment with salicylic acid to improve physiological traits and tolerance of flaxseed(Linumuzita tissimum L.)plants grown under drought stress[J].Acta Physiol Plant,2016,38(2):1-10.
[35] 胡桂馨,王代軍,刘荣堂.干旱胁迫下内生真菌对高羊茅保护酶活性的影响[J].草原与草坪,2001(1):28-31.
[36] 黄承玲,陈训,高贵龙.3种高山杜鹃对持续干旱的生理响应及抗旱性评价[J].林业科学,201 47(6):48-55.
