玉米黄曲霉毒素污染拮抗菌的筛选·鉴定及控制效果
2019-11-22杜立武高素艳杜瑞焕张立田王玉丽项爱丽董李学
杜立武 高素艳 杜瑞焕 张立田 王玉丽 项爱丽 董李学

摘要 黄曲霉毒素是饲料等农副产品中重要的有毒有害污染物,是一类强致癌性、剧毒性真菌毒素,对畜禽健康危害巨大。该研究对黄曲霉毒素污染拮抗菌开展研究,为黄曲霉毒素污染治理提供技术支持。从河北迁安、迁西、遵化、玉田及丰南饲用玉米或饲料中分离细菌,通过室内外试验,获得对黄曲霉具有较强拮抗力的菌株B45和B6。经分子生物学及理化性质鉴定,菌株B45和B6为解淀粉芽孢杆菌。进一步开展了B45和B6对黄曲霉菌丝生长的抑制作用、黄曲霉毒素的消减作用及黄曲霉毒素的分解作用研究,结果表明,拮抗菌可以显著抑制产毒黄曲霉菌丝生长,降低黄曲霉毒素的产生及消除黄曲霉毒素。
关键词 农产品;饲料;黄曲霉毒素污染;拮抗菌;抗菌活性
中图分类号 TS210.1文献标识码 A
文章编号 0517-6611(2019)20-0007-03
doi:10.3969/j.issn.0517-6611.2019.20.002
开放科学(资源服务)标识码(OSID):
Screening,Identification and Control Effects of Aflatoxin contaminated Antagonistic Bacteria in Corn
DU Li wu GAO Su yan2, DU Rui huan2,3 et al
(1.The Agricultural and Pastoral Bureau of Qianxi County,Tangshan,Hebei064000;2.Tangshan City Food and Drug Comprehensive Inspection and Testing Center,Tangshan,Hebei 063000;3.Hebei Province Agricultural Products Quality and Safety Engineering Technology Research Center,Tangshan,Hebei063000)
Abstract Aflatoxin is a kind of important pollutants in corn and fodder,is extremely strong harmful for beasts and birds health.Aflatoxin contaminated antagonistic bacteria was screened in order to provide support for controlling aflatoxin.The antagonistic bacteria were isolated from corn kernel and fodder in Qianxi,Qianan,Zunhua,Yutian and Fengnan County.Through indoor screening and control test,two strong strains B45 and B6 were obtained.B45 and B6 isolation were characterized to be Bacillus subtilis by molecular biology and physiology.They were studied on several aspects including the inhibition against the germination of Aspergillus spores,the inhibition against the growth of A.flavus,the extension of their mycelia,the reduction of the aflatoxin production,and the degradation effects of aflatoxin.The results showed that the inhibition strains could significantly inhibit the growth of toxin producing Aspergillus strains and the extension of their mycelia,reduce the production of aflatoxin,as well as the degradation of aflatoxin.
Key words Agricultural products;Fodder;Aflatoxin contamination;Antagonistic bacteria;Antagonistic activity
玉米是世界上重要的糧食作物和饲料原材料,它们在收获、储藏、转运及加工过程中极易受到霉菌的侵染而染毒,特别是黄曲霉毒素。黄曲霉毒素(Aftatoxin)是主要由黄曲霉(Aspergillus flavus)、寄生曲霉(Aspergillus parasiticus)等曲霉属真菌产生的次生代谢产物,具有很强的致癌性和毒性,广泛存在于玉米、花生、油菜籽和稻米等农产品中[1-3]。这将严重威胁农产品及食品的质量安全,影响人畜健康[1-3]。如何科学高效地治理农产品中黄曲霉毒素污染是一个亟待解决的全球性难题。根据现有的研究,黄曲霉毒素能够导致动物的肝功能下降、降低动物的免疫力、影响奶牛的产奶量,受到毒素污染的动物更易感染其他微生物而发病,通常年幼的动物对黄曲霉菌较敏感,更易受到毒素污染的危害[4-6]。
自黄曲霉毒素被发现以来,科技人员研究出许多毒素治理的办法和措施,包括物理、化学脱毒等方法。但上述办法或多或少都存在一定的局限性和不足,甚至会对农产品品质造成极大的破坏,且化学方法可能会造成二次污染,因而极大地限制了这些方法的应用。黄曲霉毒素污染重在源头治理,生物防控由于绿色环保、生态安全、防治兼备而逐渐受到科研人员的青睐[7-8]。以黄曲霉及其毒素为研究对象,构建抑黄曲霉毒素拮抗菌高效筛选体系,筛选有效微生物菌株,研究其抗菌活性、抑毒效果及解毒能力,以期为农产品中黄曲霉毒素污染治理探索新的途径。
1 材料与方法
1.1 供试菌株
黄曲霉菌株由笔者所在团队从玉米籽粒中分离获得;拮抗菌从河北省迁安市、迁西县、遵化市、玉田县及丰南区等多个玉米主产区的饲用玉米籽粒上分离获得。
1.2 内生菌的获得 将从各个区县采回的玉米籽粒带回实验室进行菌株分离,将籽粒放在3%的次氯酸钠溶液中浸泡3~5 min,然后用无菌水冲洗3~5次,沥干水分备用。用研钵将玉米籽粒研碎后放置LB平板上,于28℃恒温条件下培养,及时分离生长良好的单菌落并进行纯化,在LB斜面上保藏备用[9-10]。
1.3 拮抗菌离体筛选 采用离体对峙培养法对黄曲霉拮抗菌进行筛选,具体方法
参考文献[10]。
1.4 拮抗菌活体筛选
拮抗菌培养液、发酵液、上清液及滤液的准备及活体筛选参照文献[10]的方法。
1.5 拮抗菌对黄曲霉的抑制作用
1.5.1 上清液和过滤液制备。将活化后的拮抗菌于37℃在LB培养液中进行培养, 160 r/min振荡48 h,制备的培养液在12 000 r/min条件下离心15 min,分离的上清液用0.22 μm细菌过滤器过滤后制备成过滤液。
1.5.2 菌悬液制备。培养液离心后弃上清,加入无菌水制备成菌悬液。
1.5.3 蛋白粗提液。为达70%的饱和度,在上清液中加入固体硫酸铵,过夜后在10 000 r/min及4℃下离心20 min,在沉淀中加入pH7.0磷酸缓冲液进行悬浮,然后用0.22 μm细菌过滤器过滤。
1.5.4 拮抗菌对黄曲霉菌丝生长及毒素产生的影响。将黄曲霉培养在制备好的上清液、过滤液及蛋白粗提液中,测定其对黄曲霉菌生长及其毒素的作用[9]。
1.5.5 拮抗菌对黄曲霉毒素的消减作用。将4种黄曲霉毒素的混合标准品加入经拮抗菌发酵24 h的肉汤培养基中,37℃ 培养2、4、6 d 后,检测毒素含量,试验重复3 次。
1.5.6 模拟胃液的耐受性试验。模拟胃液的制备参照Huang等[11]的方法,将0.5 mL菌液加入4.5 mL模拟胃液中,在振荡器上混合后置于培养箱中在37 ℃条件下充分培养,分别培养0、2和4 h后取出并统计残存芽孢的活菌数。
1.6 拮抗菌株的鉴定
1.6.1 常规鉴定。常规鉴定方法参见文献[12]。
1.6.2 16S rDNA PCR扩增及序列测定。拮抗菌DNA的提取采用试剂盒的方法。以27 F(5′- AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-CTACGGCTACCTTGTTACGA-3′)为引物扩增拮抗菌16S rDNA。PCR扩增条件:98 ℃ 5 min;95 ℃ 35 s,55 ℃ 35 s,72 ℃ 1 min,35个循环;72 ℃ 8 min。PCR扩增体系:dNTPs (10 mmo1)l μL,模板DNA约10 pmol,引物27f 和R1492 (10 μmol/L) 各1 μL,引物Taq酶 (5 μmol/μL) 0.25 μL,10×PCR缓冲液5 μL,加重蒸水至50 μL。測序结果利用BLAST软件在GenBank进行同源性比较,鉴定拮抗菌。
2 结果与分析
2.1 菌株分离
根据菌落形态、颜色及出现早晚,从玉米籽粒中共获得细菌350株,其中,从玉田获得35株,从迁西获得86株,从迁安获得45株,从遵化获得66株,从丰南获得118株。
2.2 拮抗菌的筛选
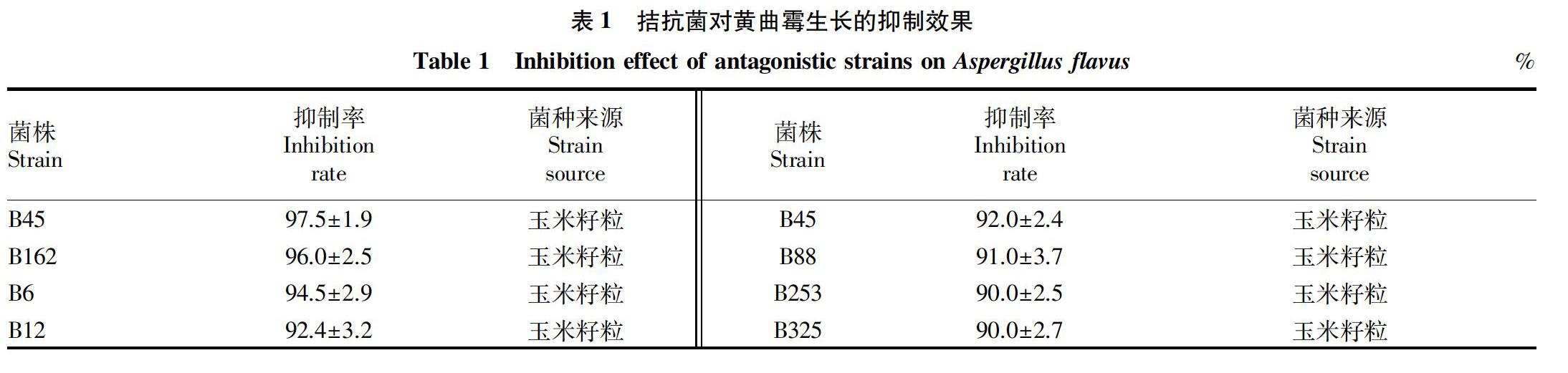
2.2.1 离体拮抗效果。菌株B45对黄曲霉的抑制率可达97.5%,其次为菌株B162的96.0%和B6的94.5%,3株拮抗菌抑菌作用显著(表1)。
2.2.2 活体条件下拮抗效果。
将离体条件下筛选获得的具有较强拮抗效果的菌株在玉米籽粒中开展抑黄曲霉毒素污染活体拮抗试验,LC/MS/MS检测结果发现,拮抗菌在玉米籽粒上对黄曲霉毒素污染表现出较强的抑制效果。其中,菌株B45对黄曲霉毒素的抑制效果可达75.5%,其次为B6的70.0%,B12的68.3%,
B162的63.8%,B325的60.0%,B45的55.5%,B88的50.5%,B253的50.0%。
2.3 拮抗菌代谢物对黄曲霉生长的效果
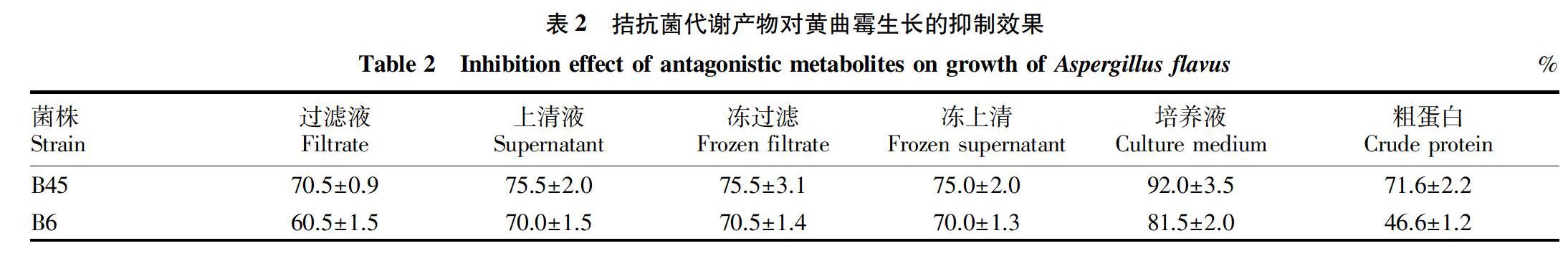
研究发现,拮抗菌培养液、上清液、过滤液及蛋白粗提液对黄曲霉抑制作用显著。菌株B45培养液对黄曲霉菌丝生长的抑制率可达92%,其上清液、过滤液及蛋白粗提液对黄曲霉生长的抑制率分别达75.0%、70.5%及71.6%;菌株B6培养液对黄曲霉菌丝生长的抑制率达81.5%,其上清液、过滤液对黄曲霉生长的抑制率达70.0%、60.5%,与菌株B45相比,菌株B6蛋白粗提液抑菌率较低(表2)。
2.4 拮抗菌对黄曲霉毒素产生的抑制作用
研究發现,黄曲霉与菌株B45及B6混合培养后能显著降低毒素的产生,培养72 h后4 种黄曲霉毒素(AFB1、AFB2、AFG1及AFG2)均未检出(表3)。
2.5 拮抗菌对毒素的降解作用
利用LC/MS/MS检测技术,研究表明,拮抗菌B45和B6能够显著降解黄曲霉毒素。培养第4天时,拮抗菌对黄曲霉毒素AFG1和AFG2完全降解,均未检出,对AFB1和AFB2的降解率在90%以上,表明菌株B45和B6能够显著降解黄曲霉毒素。同时研究发现,拮抗菌对AFG1、AFG2 的降解速度显著高于对黄曲霉毒素AFB1、AFB2的降解速度(表 4)。
2.6 模拟胃液的耐受性试验 试验显示,在模拟胃液条件下,菌株B45活菌数比B6活菌数高;经模拟胃液处理2、4 h后,菌株B45活菌数没有显著受到模拟胃液的影响,活菌率达95.75%,说明菌株B45对胃酸具有很强的耐受性(表5)。
2.7 拮抗菌B45和B6的鉴定
2.7.1 生理生化鉴定。
根据菌株B45和B6的理化指标检测结果(表6),结合文献[10],2株拮抗菌初步鉴定为解淀粉芽孢杆菌。
2.7.2 16S rDNA的序列分析。
菌株B45和B6 PCR扩增后得到1.48 kb左右的产物。后经BLAST比对及Clustal W多重序列对比,2株拮抗菌与解淀粉芽孢杆菌菌株JF496388同源性可达98%,结合上述生理生化检测指标,将B45和B6鉴定为解淀粉芽孢杆菌。
47卷20期杜立武等 玉米黄曲霉毒素污染拮抗菌的筛选·鉴定及控制效果
3 结论
黄曲霉毒素能够严重污染农产品及食品,威胁人畜健康,甚至导致死亡。目前,世界各国都在积极采取措施来消除农产品中霉菌毒素污染问题,但难以用一般的加工处理方法去除[13-16],化学方法又存在二次污染的危害,因此探索高效灵敏的霉菌毒素污染的治理措施势在必行。农产品中黄曲霉毒素污染重在源头治理,生物防控及生物降解毒素的方法由于绿色环保、生态安全而备受科学家的青睐[12,17-18]。该研究针对饲用玉米中黄曲霉毒素污染防控难题,采用对人体无害、对环境友好的生物防治技术,以期为我国玉米黄曲霉毒素污染治理探索一条有效途径。该试验从350株菌中分离获得对黄曲霉毒素具有较强拮抗能力的菌株2株,离体条件下对毒素的抑制率均在97%以上,活体条件下控毒效果也可达60%,其中菌株B45可达75.5%,效果显著,具有极大的开发应用潜力。代谢产物抑菌解毒试验表明,2株拮抗菌(B45、B6)培养液、上清液、过滤液及蛋白粗提液能显著降低黄曲霉生长和毒素产生。另外研究发现,获得的2株拮抗菌能够显著抑制黄曲霉菌丝生长,抑制和减轻黄曲霉侵染和毒素污染的发生。先期的研究中,国内外已有利用微生物来降解黄曲霉毒素的报道,孔青等[19]发现海洋巨大芽孢杆菌对黄曲霉毒素的抑制率可达50.8%;Abbas 等[20]证明不产毒素的黄曲霉能够抑制黄曲霉产毒,抑毒率可达65%。该试验筛选获得的拮抗菌B45及B6具有更强的抑菌控毒效果,且发现消除黄曲霉毒素的物质主要为蛋白类代谢物,具有广阔的应用前景。但2株拮抗菌对黄曲霉毒素的消除机制、微生态区系的影响及农产品品质的影响有待于进一步研究。
参考文献
[1] 范素芳,李培武,王秀嫔,等.高效液相色谱和高效液相色谱·离子阱质谱测定花生、玉米和大米中黄曲霉毒素方法比较[J].食品科学,2011,32(12):254-258.
[2] LIU X.Strengthen research work of exposure and control of mycotoxin[J].Chinese journal of preventive medicine,2006,40:307-308.
[3] ALPERT M E,HUTT M S,WOGAN G N,et al.Association between aflatoxin content of food and hepatoma frequency in Uganda[J].Cancer,1971,28(1):253-260.
[4] JACOBSON W C,WISEMAN H G.The transmission of aflatoxin B1 into eggs [J].Poultry science,1974,53(5):1743-1745.
[5] TRUCKESS M W,STOLOFF L,YOUNG K,et al.Aflatoxicol and aflatoxins B1 and M1 in eggs and tissues of laying hens consuming aflatoxin contaminated feed[J].Poultry science,1983,62(1):2176-2182.
[6] IBEH I N,URAIH N,OGONAR J I.Dietary exposure to aflatoxin in human male infertility in Benin City,Nigeria[J].International journal of fertility and menopausal studies,1994,39(4):208-2 l 4.
[7] DEY R,PAL K K,BHATT D M,et al.Growth promotion and yieid enhancement of peanut (Arachis hypogaea L.) by application of plant growth-promoting rhizobacteria[J].Microbiological research,2004,159(4):371-394.
[8] 何红,邱恩鑫,胡方平,等.植物内生细菌生物学作用研究进展[J].微生物学杂志,2004,24(3):40-45.
[9] 姚彦坡,张立田,郑百芹,等.花生黄曲霉毒素污染生防细菌筛选及菌株B85-1的鉴定和抗菌活性[J].花生学报,2016,45(3):20-26.
[10] 姚彦坡,丁丹,张友青,等.玉米黄曲霉毒素污染生防菌筛选及菌株B42-3抗菌活性研究[J].中国粮油学报,2018,33(3):84-88.
[11] HUANG Y,ADAMS M C.In vitro assessment of the upper gastrointestinal tolerance of potential probiotic dairy propionibacteria[J].International journal of food microbiology,2004,91(3):253-260.
[12] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[13] WU F,KHLANGWISET P.Health economic impacts and cost effectiveness of aflatoxin reduction strategies in Africa:Case studies in biocontrol and post harvest interventions[J].Food additives and contaminants,2010,27(4):496-509.
[14] LIU Y,WU F.Global burden of aflatoxin induced hepatocellular carcinoma:A risk assessment[J].Environmental health perspectives,2010,118(6):818-824.
[15] VAN EGMOND H,DRAGACCI S.Liquid chromatographic method for aflatoxin M1 in milk[J].Methods in molecular biology,2001,157:59-69.
[16] TEKINSEN K K,EKEN H S.Aflatoxin M1 levels in UHT milk and kashar cheese consumed in Turkey[J].Food and chemical toxicology,2008,46:3287-3289.
[17] KIRK G D,BAH E,MONTESANO R.Molecular epidemiology of human liver cancer:Insights into etiology,pathogenesis and prevention from The Gambia,West Africa[J].Carcinogenesis,2006,27(10):2070-2082.
[18] GROOPMAN J D,KENSLER T W,WILD C P.Protective interventions to prevent aflatoxin induced carcinogenesis in developing countries[J].Annual review of public health,2008,29:187-203.
[19] 孔青,劉奇正,于方塘,等.1 株海洋芽孢杆菌抑制黄曲霉生长和毒素合成的研究[J].浙江大学学报(农业与生命科学版),2010,36(4):387-392.
[20] ABBAS H K,ZABLOTOWICZ R M,BRUNS H A,et al.Biocontrol of aflatoxin in corn by inoculation with non aflatoxigenic Aspergillus flavus isolate[J].Biocontrol science and technology,2006,16(5):437-449.
