贡菊再生体系建立及羧苄青霉素浓度筛选
2019-11-22徐亚男任镘蓉岳圆圆廉美兰
徐亚男, 任镘蓉, 岳圆圆, 赵 丽, 廉美兰, 高 日*
(1.延边大学农学院;2.延边林业科学研究院:吉林 延吉 133000)
贡菊(Chrysanthemummorifolium(Ramat) Tzvel. cv. Gongju)系菊科菊属多年生草本植物,主产黄山歙县金竹岭地区。贡菊以头状花序入药,是我国4大药用菊之一,味甘苦、性微寒,具有疏风清热、平肝明目、解毒消肿的功效,同时作为高级茶饮、保健品被开发,具有广阔的市场前景[1]。然而,近年来因贡菊重茬种植等问题,造成种质严重退化,加上病虫害严重,造成产量下降,甚至绝产[2]。植物基因工程技术是获得创新品种的技术手段,在改良植物的抗病虫害和抗逆性、提高天然药物含量等方面起着重要作用。目前,这种技术在菊属植物中研究较多,如通过超表达F3′H基因,使菊花花色发生明显改变[3];DREBa基因的转入,提高了地被菊的抗旱能力[4];超表达E2F基因,使甘菊花朵变大[5],这些研究表明,通过功能基因的转入可有效地改良菊花种质特性,促进菊花产业的发展。但是,至目前为止贡菊转基因研究处薄弱状态,对其再生体系建立的研究尚未见报道。因此,为了建立贡菊再生体系,该研究以试管苗叶片作为材料,研究了提高不定芽诱导的条件,并对生根条件也进行了优化,为今后开展贡菊转基因研究鉴定基础。
1 材料与方法
1.1 材料
选择田间生长的健壮贡菊,切取1 cm的茎段,用洗洁剂清洗,自来水冲洗1 h,再用70%酒精消毒40 s,然后用0.1%氯化汞溶液消毒2 min,用无菌水冲洗4次,用无菌滤纸吸干表面水分后,接种到MS+蔗糖30 g/L+琼脂0.8%的培养基中。培养基的pH值调节为5.8。培养条件为光照强度2 000 lx,光周期16 h/d,温度(25±2) ℃。
1.2 方法
1.2.1 BA和NAA对不定芽分化的影响
无菌试管苗培养30 d后,选择顶部第3和第4片叶,将其切成0.5 cm×0.5 cm大小的叶盘后,叶背下放到含不同浓度6-苄基腺嘌呤(BA)和萘乙酸(NAA)的MS培养基的培养皿中,每个培养皿接入16个叶盘。BA浓度设置为1.0,1.5,2.0和2.5 mg/L,而NAA浓度设置为0.1,0.3,0.6和0.9 mg/L。培养条件同上。每个处理重复3次,培养30 d后调查不定芽的分化率和分化的不定芽数。
不定芽分化率=分化不定芽的外植体总数/接种的外植体总数×100%;
不定芽数=分化的不定芽总数/分化不定芽的外植体总数。
1.2.2 试管苗叶龄对不定芽分化的影响
在茎端培养20,25,30,35和40 d时,分别取底端第2、3片叶片作为外植体,将叶片切成0.5 cm×0.5 cm,接入MS+BA 2.0 mg/L +NAA 0.6 mg/L+30 g/L蔗糖+0.8%琼脂培养基中。每个培养皿放入16个叶盘,每个处理重复3次,30 d调查不定芽的分化率和平均每个外植体分化不定芽数,培养条件同上。
1.2.3 IBA浓度对生根的影响
将从叶片中分化的不定芽切成2 cm长,分别接种含不同浓度吲哚丁酸(IBA)的培养基中,IBA浓度设为0,0.25,0.5,0.75和1.0 mg/L。每个培养瓶接种3个外植体,每个处理重复3次,30 d后调查幼苗生根和生长状况,培养条件同上。
1.2.4 羧苄青霉素(Carb)浓度对不定芽分化的影响
将培养25 d的贡菊试管苗叶片切成1 cm×1 cm大小,接种到MS+BA 2.0 mg/L +NAA 0.6 mg/L+0.8%琼脂+30 g/L蔗糖培养基中,附加不同浓度的Carb抗生素(1 000,750,500,250和100 mg/L)。30 d后调查不定芽的分化率和平均每个外植体
1.3 数据分析
试验数据3次重复平均值,采用SPSS 11.0软件进行统计分析,采用邓肯氏新复极差法作显著性差异分析,显著水平为0.05。
2 结果与分析
2.1 BA和NAA浓度对不定芽诱导的影响
为筛选出适合诱导贡菊愈伤组织和不定芽的培养基,将BA和NAA以不同浓度分别组合进行诱导不定芽研究。接种10 d后,叶盘边缘开始形成愈伤组织,30 d后,部分愈伤组织形成小芽,其中,BA 2.0 mg/L+NAA 0.6 mg/L组合每个叶盘能分化出3.4个小芽,诱导不定芽数80.7%,诱导不定芽数最多,其次为BA 2.5 mg/L+NAA 0.6 mg/L和BA 1.5 mg/L+NAA 0.3 mg/L组合。其他的BA和NAA组合,都能形成愈伤组织,但是愈伤组织不能形成不定芽或者不定芽形成的较少(表1,图1a)。适合诱导不定芽的激素组合为BA 2.0 mg/L+NAA 0.6 mg/L。
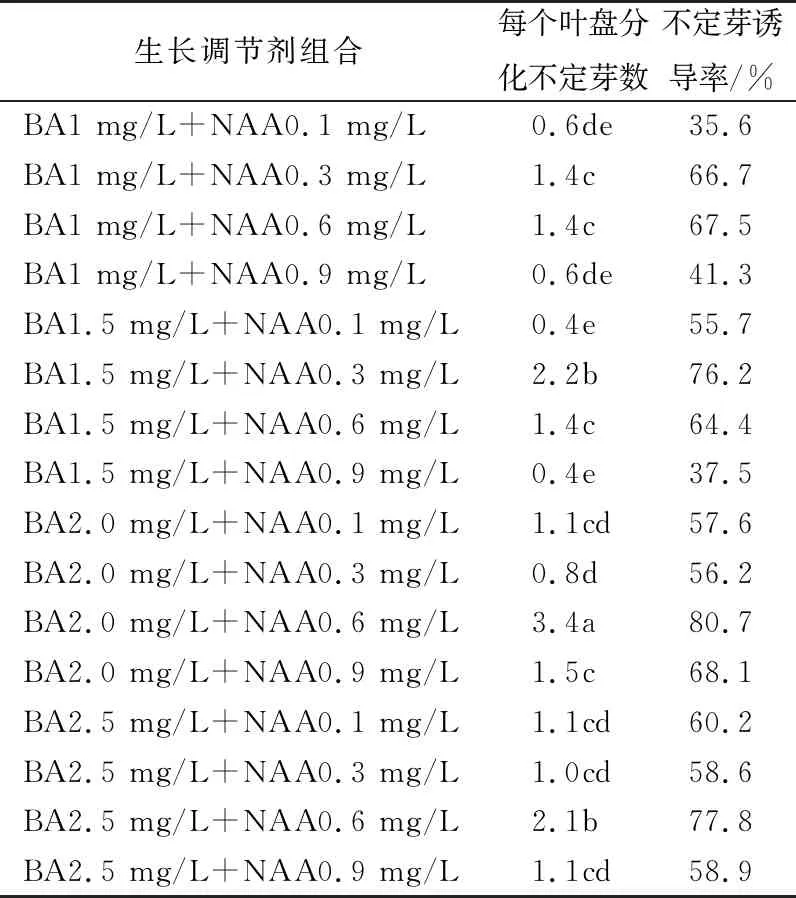
表1 BA和NAA浓度对诱导不定芽的影响
注: 同列数据后小写英文字母表示不同处理间差异显著(P<0.05),下同。
2.2 不同叶龄诱导分化不定芽数
由表2可知,叶龄不同分化的不定芽数也有差异,叶龄小,叶面积较小,且叶片较薄,诱导不定芽数也低;叶龄为25 d的叶片鲜嫩,诱导不定芽率最高,为88.4%,平均每个叶盘分化不定芽数为4.6个(图1b);叶龄继续增加,叶片增厚,适合操作,但是诱导的不定芽数逐渐减少。因此,适合诱导不定芽的叶龄为25 d。
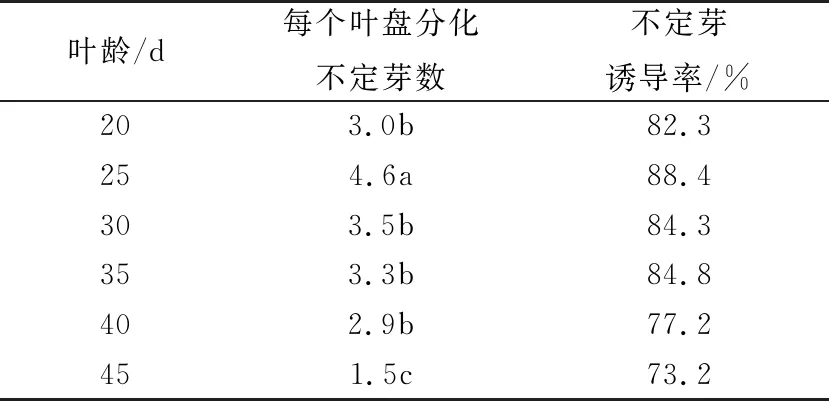
表2 试管苗叶龄对不定芽分化的影响
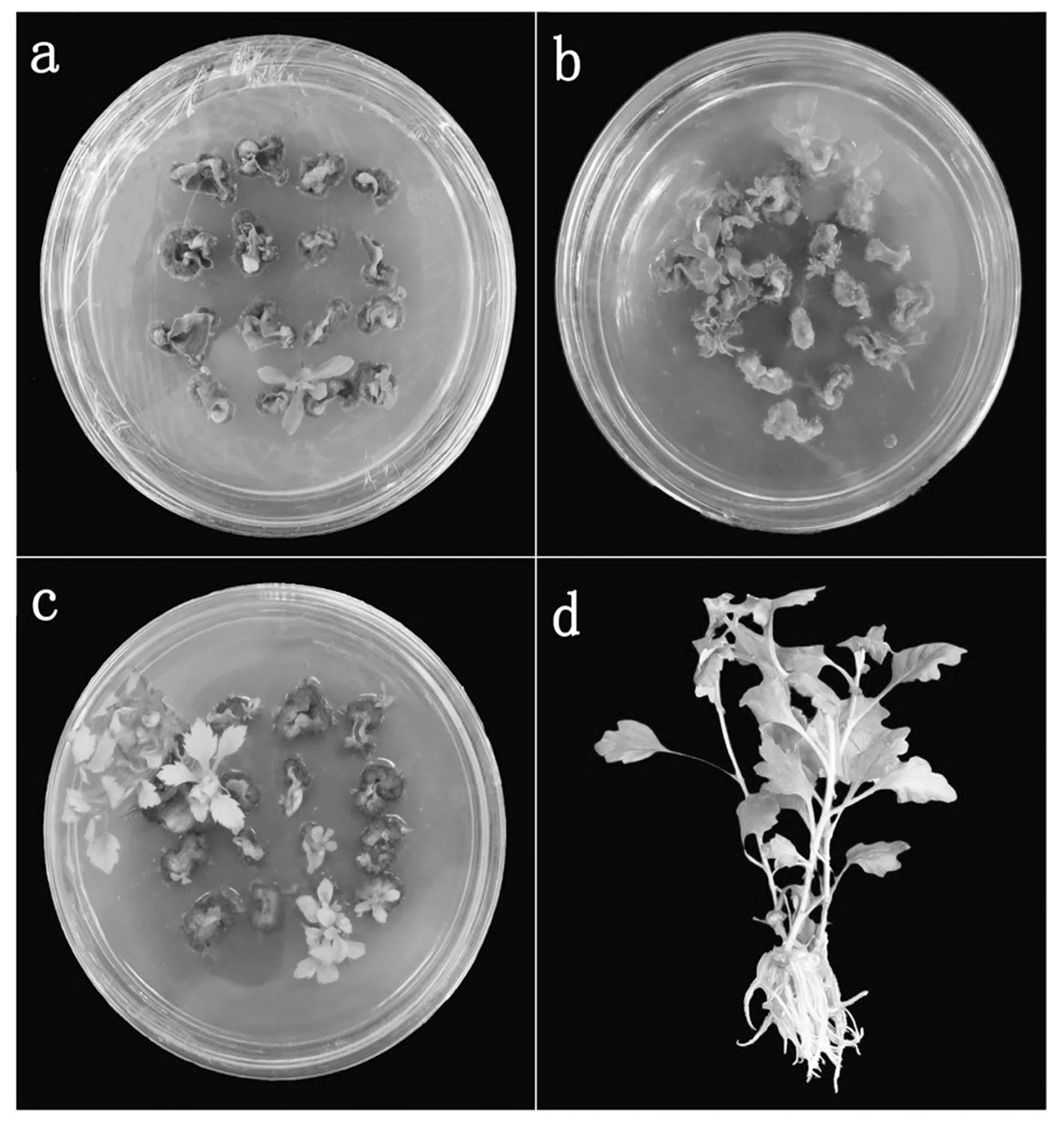
a:试管苗叶片接种于MS+BA 2.0 mg/L +NAA0.6 mg/L培养基中后的第30天。b: 培养30 d后,不定芽的分化;c: 叶片接种到含250 mg/L的Carb的培养基中培养40 d后的不定芽分化和生长情况;d: 在IBA浓度为0.25 mg/L的培养基中培养30 d后的试管苗生根及生长状况。
图1 贡菊不定芽分化和生根
Fig.1 Adventitious bud differentiation androoting of chrysanthemum Gongju
2.3 IBA浓度对幼苗生长和生根的影响
IBA促进贡菊无菌苗生根,接种7 d后,加入IBA的处理,在幼苗茎底端形成白色凸起,14 d后,能分化出数条不定根。未加入IBA的处理,在12 d后,茎的底端形成白色凸起,20 d后能形成不定根。由表3可知,IBA浓度为0.25和0.5 mg/L时,株高、根数、地下部鲜物重和干物重都显著高于其他处理;在根长中,IBA浓度为0.25 mg/L的处理好于0.5 mg/L处理。继续增加IBA浓度,幼苗地上部和地下部的生长都明显下降。因此,IBA浓度为0.25 mg/L时更适合贡菊生根。

表3 IBA浓度对幼苗生长和生根的影响
2.4 Carb对诱导不定芽的影响
Carb抗生素不仅对农杆菌有抑制作用,同时也会抑制贡菊叶盘的不定芽形成,Carb浓度在100和250 mg/L,不定芽诱导率分别为87.6%和85.7%,每个叶盘平均分化3.7和3.9个植株(表4,图1c),与不加Carb处理的诱导率和叶盘分化苗数无显著差异。Carb浓度继续增加,不定芽诱导率和叶盘平均分化不定芽数逐渐降低(表4)。
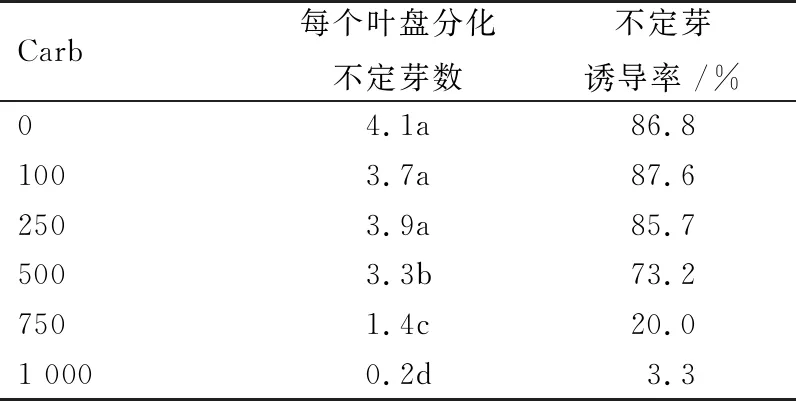
表4 Carb对诱导愈伤不定芽的影响
3 讨论与结论
植物激素是组织和器官等组织培养过程中不可缺少的物质,激素的种类,浓度和配比是植物器官诱导愈伤组织和不定芽的关键因子。以菊花叶片为外植体建立再生体系,其中激素BA、NAA等应用的较多[6]。梁芳等[7]研究表明,MS+NAA 0.1 mg/L+BA 1.0 mg/L适合传统菊花“狮子头”愈伤组织诱导及分化。地被菊品种“铺地金”和“北林红”再生培养基分别为MS+BA 2.0 mg/L+NAA 1.0 mg/L和MS+BA 1.0 mg/L+NAA 0.5 mg/L[8];切花菊“神马”的最适诱导不定芽再生培养基为MS+NAA 1.0 mg/L+BA 1.0 mg/L[9]。本研究发现,适合诱导愈伤组织和不定芽的培养基是MS+BA 2.0 mg/L+NAA 0.6 mg/L,与上面所报道的菊花再生体系中激素浓度有差异,这可能是不同品种导致,菊花可以异花授粉,菊属遗传背景复杂,不同基因型需要不同激素浓度和配比。
目前,常用的抗生素主要有羧苄青霉素、头孢霉素(Cef)、卡那霉素(Kan)、氨苄青霉素(Amp)和潮霉素(Hyg)等[10],周小梅等[11]报道,9种抗生素对根癌农杆菌EHA105有抑制效果,发现羧苄青霉素效果最好。羧苄青霉素浓度过高抑制转基因细胞生长,浓度过低则不足以抑制农杆菌生长[12]。羧苄青霉素浓度在菊花“Reagan Elite White”遗传转化体系中为200~300 mg/L,而菊花“神马”为300 mg/L能够抑制不定芽分化。因此,不同基因型的植株遗传转化体系添加的羧苄青霉素浓度不同。本研究发现,250 mg/L的羧苄青霉素对贡菊叶片诱导不定芽无影响,且能够抑制农杆菌生长,但浓度为500 mg/L时,不定芽诱导率明显降低(表4),这与茶,大豆和葡萄遗传转化体系中的羧苄青霉素浓度相似[13-16]。
