新RGD嵌合体肽对黑色素瘤细胞B16增殖及其黑色素合成的影响
2019-11-22赵瑞利金天明马吉飞孙英峰于晓雪刘梦月潘晨浩
姜 轩,付 超,赵瑞利,金天明,马吉飞,孙英峰,于晓雪,张 欣,刘梦月,潘晨浩
(天津农学院动物科学与动物医学学院,天津300384)
抗菌肽(Antimicrobial peptides,AMPs)是天然免疫系统的重要组成部分,其中两栖动物皮肤抗菌肽大多都是阳离子的碱性多肽,可与酸性的生物膜层状排列的脂类双分子层相结合[1]。近年来AMPs 的抗细菌、真菌、病毒和肿瘤的作用逐步被发掘,而RGD 肽是一种以精氨酸- 甘氨酸- 天冬氨酸为结构的短肽,基质蛋白RGD 三肽序列能与整合素αvβ3特异性结合,是整合素αvβ3 与其对应配体蛋白相互识别的作用位点[2-3],RGD 在细胞的黏附、增殖、分化、转移凋亡等过程中起着重要的调控作用,并参与肿瘤的侵袭与转移。因此,在肿瘤药物的新型药物研发过程中整合素受体成为重要的靶点[4]。
黑色素瘤是一种常见的皮肤恶性肿瘤,是目前首位致死性皮肤肿瘤,且其恶性程度高,转移能力强[5]。有研究证实,恶性黑色素瘤患者预后主要取决于是否发生淋巴结转移[6],黑色素瘤细胞的分裂速度与肿瘤侵袭和迁移密切相关[7-8]。有研究表明合成黑色素是黑色素瘤细胞增殖过程中的重要过程,该过程主要受酪氨酸酶(TYR)调控[9],TYR 是黑色素合成的关键限度酶,受小眼相关转录因子(MITF)的调节,MITF 是黑色素细胞的特异性转录因子,可以直接激活TYR 启动子,促进黑色素的生成[10-11]。已有研究结果表明新牛蛙抗肿瘤肽Temporin-La(T-La)在体外对肿瘤细胞的增殖有抑制作用[12],本实验以从牛蛙皮肤cDNA 文库中筛选的T-La 抗肿瘤肽为基序,通过生物信息学设计合成新型抗肿瘤肽T-La(S)与 T-La(FS),并将其与 RGD 肽偶联成RGD-T-La(S)和 RGD-T-La(FS),以小鼠黑色素瘤B16 细胞为对象,研究新合成的新牛蛙抗肿瘤RGD嵌合体肽抑制B16 细胞黑色素生成的机制,旨在为研究 RGD 嵌合体肽RGD-T-La(S)和 RGD- T-La(FS)靶向抗肿瘤的作用机制以及为临床相关抗肿瘤药物的研发提供科学依据。
1 材料与方法
1.1 主要实验材料小鼠黑色素瘤B16 细胞由天津农学院兽医学实验室保存;抗肿瘤肽由浙江昂拓莱司生物技术有限公司合成(表1);CCK8 检测试剂盒购自上海碧云天生物技术有限公司;RPMI1640 细胞培养基购自美国HyClone 公司;TRIton X-100 购自北京索莱宝科技有限公司;左旋多巴L-DOPA 购自阿拉丁试剂有限公司;812 包埋剂购自SPI 公司;Cell Meter Fluorimetric Live cell cycle Assay Kit 购自北京达科为生物技术有限公司;RNA 提取试剂盒购自天根生化科技(北京)有限公司;UltraSYBR Mixture 购自康为世纪科技有限公司;TYR 及MITF 基因扩增引物由金唯智科技有限公司合成。
1.2 各抗菌肽对B16 细胞增殖抑制率的检测于96 孔板中常规培养小鼠黑色素瘤B16 细胞[13],每孔100 μL,并于37 ℃ 5 % CO2过夜培养,分别加入表1 中的4 种多肽使其终浓度分别为 200 μg/mL、100 μg/mL、 50 μg/mL、 20 μg/mL、 10 μg/mL、5 μg/mL,每组设4 个重复。同时设未经任何处理的B16 细胞为对照,后面试验均如此。分别继续培养 12 h、24 h 时加入 10 μL/ 孔 CCK8,37 ℃孵育40 min,分别在OD490nm和OD630nm处读取每孔的吸光度值并记录结果,分析4 种肽对小鼠黑色素瘤B16细胞抑制作用。

表1 抗肿瘤肽序列Table 1 Antitumor peptide sequences
1.3 乳酸脱氢酶(LDH)测定同1.2 培养小鼠黑色素瘤B16 细胞后分别加入4 种多肽使其终浓度分别为 100 μg/mL 、50 μg/mL、20 μg/mL、10 μg/mL、5 μg/mL,每组设3 个重复。分别继续培养12 h 后收集细胞培养液,采用LDH 测定试剂盒测定各组样品中LDH 含量,测定OD450nm值。按照公式:培养液中 LDH 活性(U/L)=(测定 OD450nm值 - 对照 OD450nm值)/(标准 OD4450nm值 - 空白 OD450nm值)×标准品浓度(0.2 μmol/mL)×1 000 计算试验结果。
1.4 细胞超微结构的观察同1.2 培养B16 细胞后分别加入 4 种多肽使其终浓度分别为 10 μg/mL、50 μg/mL,弃培养液于戊二醛溶液中固定,磷酸缓冲液(PB)漂洗4 次。锇酸室温固定2 h,PB 漂洗3次。依次入梯度乙醇- 丙酮脱水后包埋。超薄切片机切片。铀铅双染色,室温干燥过夜后利用透射电镜观察小鼠黑色素瘤B16 细胞超微结构,比较分析4 种肽对其超微结构的影响。
1.5 不同细胞周期细胞含量的检测取培养至对数生长期的B16 细胞至12 孔板中,过夜培养,实验组加不同浓度的(10 μg/mL、20 μg/mL、50 μg/mL)4 种多肽处理细胞,对照组不加多肽,继续培养24 h后用含0.25 % EDTA 的胰蛋白酶消化细胞,采用PBS 洗涤,收集 1×106个细胞制成 500 μL 单细胞悬液,按照细胞周期试剂盒说明书,加入2.5 μL 200×Nuclear Green LCS1,置于 37 ℃ 5%CO2孵育 30 min,利用流式细胞仪检测荧光吸收量,用Modfit 软件分析细胞周期各时期细胞比例,测定4 种多肽对B16细胞周期的影响。
1.6 黑色素含量测定取培养至对数生长期的B16细胞于6 孔板中,置37 ℃、5 % CO2中培养24 h 后PBS 洗涤一次换液,分别加入不同浓度(终浓度为5 μg/mL、 10 μg/mL、 20 μg/mL、 50 μg/mL、100 μg/mL、200 μg/mL)的 4 种多肽,并设立对照组。继续作用24 h 后收获细胞,消化细胞后将细胞悬浮离心,PBS 洗涤两次,加入1 mol/L 的NaOH,置于80 ℃水浴30 min 至细胞团块完全溶解,再加入超纯水将NaOH 终浓度稀释至0.2 mol/L。混匀后取各组溶液至96 孔板中,每孔100 μL,每组设立8个重孔,利用酶标仪测定每孔OD490nm值。黑色素含量(%)=(OD490nm实验组 /OD490nm对照组)×100 %,分析比较4 种肽对B16 细胞黑色素的影响。
1.7 TYR 活性的测定按照1.6 方法培养多肽作用的B16 细胞,多肽作用24 h 后每孔加入1 % Triton X-100 溶液100 μL,手动平稳震荡5 min,移至-20 ℃冻存1 h,室温融化使细胞裂解,37 ℃预温后每孔加入0.1 %左旋多巴溶液100 μL,37 ℃孵育 2 h,用酶标仪测定 OD490nm值。TYR 活性激活率(%)=(OD490nm实验组/OD490nm对照组)×100 %,分析比较4种肽对小鼠黑色素瘤B16 细胞TYR 活性激活率的影响。
1.8 TYR 和MITF 基因转录水平的检测取对数生长期的B16 细胞至6 孔板中,过夜培养后分别加入不同浓度(20 μg/mL、50 μg/mL、100 μg/mL)的 4 种多肽处理细胞,对照组不加多肽,继续培养24 h 后收集细胞,采用RNA 提取试剂盒提取样品总RNA,利用反转录试剂盒获得cDNA,分别以各组cDNA为模板,利用表2 中引物,按照SYBR Green 荧光定量PCR 试剂盒说明书检测并分析4 种肽对TYR及MITF 基因转录水平的影响。
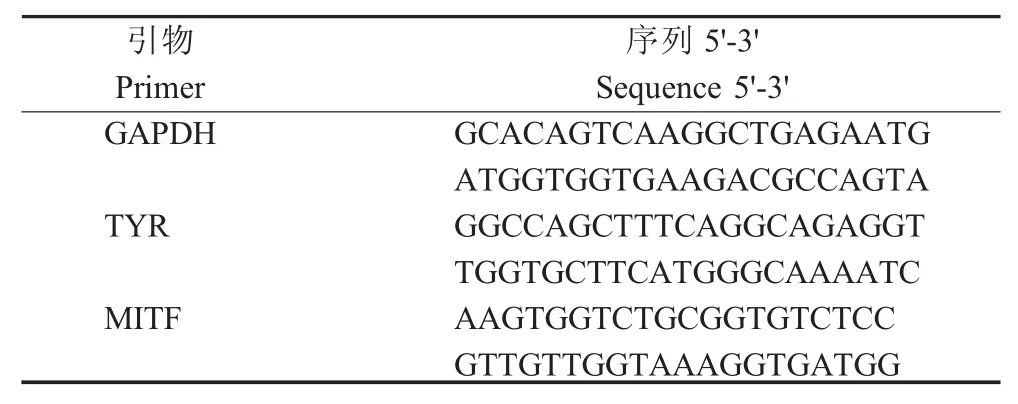
表2 目的基因扩增的引物Table 2 Target gene primers
1.9 数据处理试验结果采用统计学软件SPSS Statistics 17 对数据进行处理,数据用平均值±标准差表示,组间比较采用单因素方差分析,p<0.05 为两组间的差异具有统计学意义。
2 结 果
2.1 对细胞增殖抑制的检测结果利用CCK8 法测定不同浓度的RGD- 嵌合体肽对小鼠黑色素瘤B16细胞增殖的影响,结果显示,在分别加入4 种多肽12 h、24 h 后,B16 细胞增殖均受到明显抑制,并且呈现时间浓度依赖性(表3)。RGD-T-La (FS)作用24 h 后对B16 细胞抑制率达到84 %,显著高于T-La (FS)组 (p<0.05),一 定 程 度 上 RGD-T-La (S)、RGD-T-La (FS)组抑制B16 细胞增殖程度高于T-La(FS)、T-La (FS)组。表明4 种多肽均能抑制B16 细胞增殖,且RGD-T-La (FS)的抑制作用较强。
表3 多肽对B16 细胞增殖的抑制率12 h、24 h(n=4,)Table 3 Inhibition rate of B16 cell treat with peptide 12 h,24 h (n=4,)
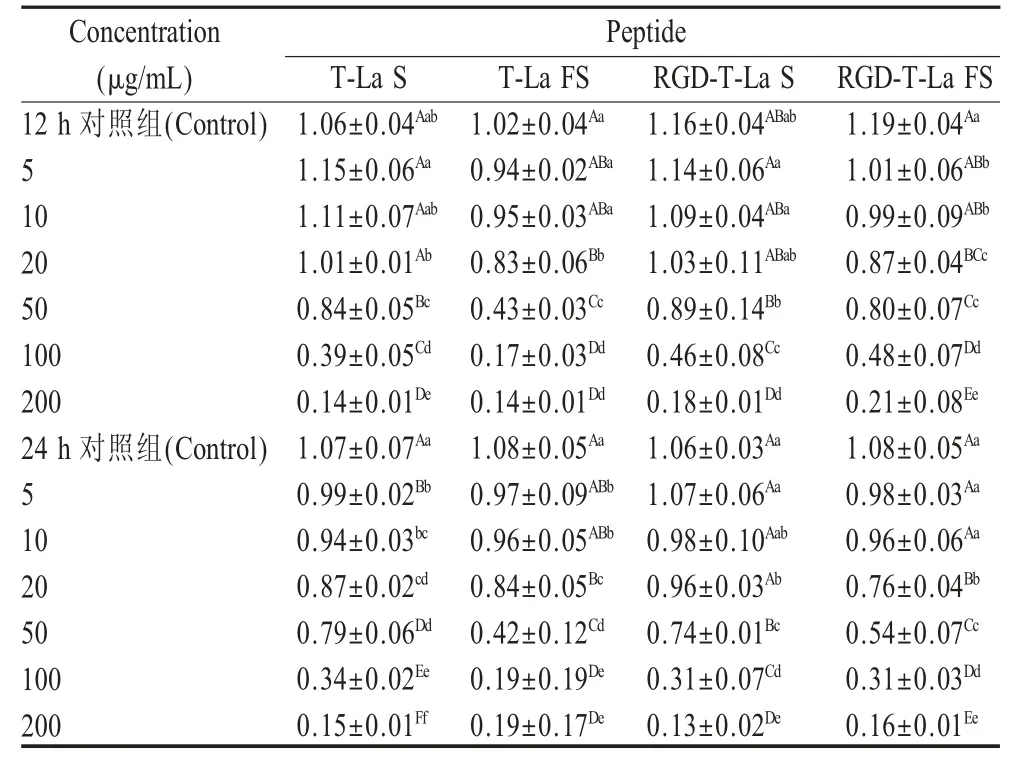
表3 多肽对B16 细胞增殖的抑制率12 h、24 h(n=4,)Table 3 Inhibition rate of B16 cell treat with peptide 12 h,24 h (n=4,)
注:A 和a 表示在同一列数据中后跟相同字母的平均值没有显著差异(p>0.01)、(p>0.05)。Note: A and a mean in the same column followed by the same letters do not differ significant (p>0.01), (p>0.05).
Concentration(μg/mL)12 h 对照组(Control)5 10 20 50 100 200 24 h 对照组(Control)5 10 20 50 100 200 Peptide T-La S 1.06±0.04Aab 1.15±0.06Aa 1.11±0.07Aab 1.01±0.01Ab 0.84±0.05Bc 0.39±0.05Cd 0.14±0.01De 1.07±0.07Aa 0.99±0.02Bb 0.94±0.03bc 0.87±0.02cd 0.79±0.06Dd 0.34±0.02Ee 0.15±0.01Ff T-La FS 1.02±0.04Aa 0.94±0.02ABa 0.95±0.03ABa 0.83±0.06Bb 0.43±0.03Cc 0.17±0.03Dd 0.14±0.01Dd 1.08±0.05Aa 0.97±0.09ABb 0.96±0.05ABb 0.84±0.05Bc 0.42±0.12Cd 0.19±0.19De 0.19±0.17De RGD-T-La S 1.16±0.04ABab 1.14±0.06Aa 1.09±0.04ABa 1.03±0.11ABab 0.89±0.14Bb 0.46±0.08Cc 0.18±0.01Dd 1.06±0.03Aa 1.07±0.06Aa 0.98±0.10Aab 0.96±0.03Ab 0.74±0.01Bc 0.31±0.07Cd 0.13±0.02De RGD-T-La FS 1.19±0.04Aa 1.01±0.06ABb 0.99±0.09ABb 0.87±0.04BCc 0.80±0.07Cc 0.48±0.07Dd 0.21±0.08Ee 1.08±0.05Aa 0.98±0.03Aa 0.96±0.06Aa 0.76±0.04Bb 0.54±0.07Cc 0.31±0.03Dd 0.16±0.01Ee
2.2 对细胞LDH 含量影响的检测结果采用微量酶标法测定不同浓度的多肽对B16 细胞中LDH 含量的影响。结果显示,与对照组相比,T-La(S)与RGD-T-La(S)的 LDH 含量均显著升高(p<0.05),在多肽含量为 100 μg/mL 时LDH 含量分别达到283.1 U/L、340.9 U/L,在多肽浓度 5 μg/mL、10 μg/mL 时LDH 含量RGD-T-La(S)处理组显著高于T-La(S)。与对照组相比,T-La(FS)与RGD-T-La(FS)处理的B16细胞的LDH 含量均显著升高(p<0.05),在多肽含量为100 μg/mL 时 B16 细胞 LDH 含量达到最高,分别为329.8 U/L、225.8 U/L (图1)。表明4 种多肽均能使B16 细胞中LDH 含量显著升高,RGD-T-La(S)处理的 B16 细胞中LDH 含量高于其它多肽处理组,LDH 含量升高与线粒体活跃有关。
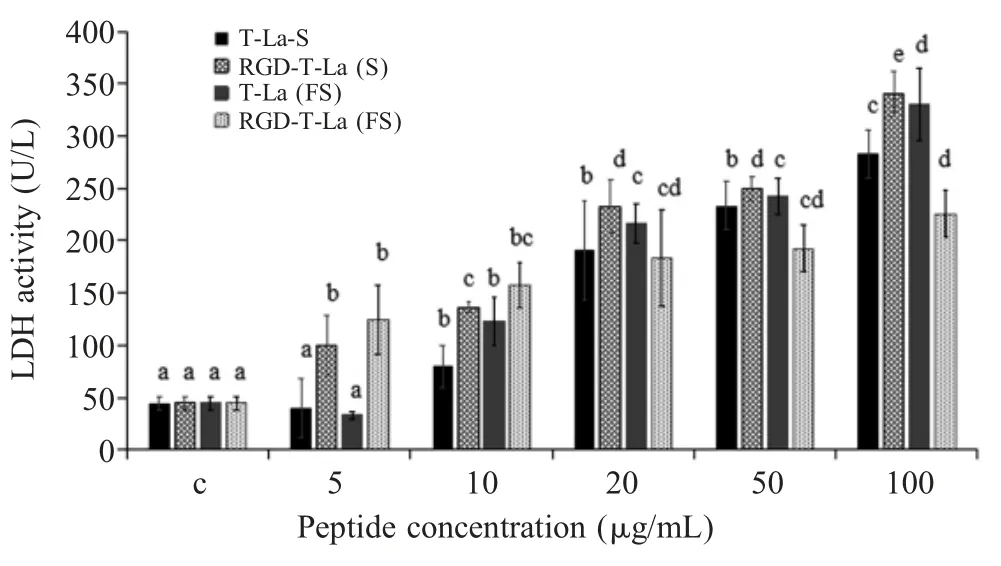
图1 不同浓度的多肽对B16 细胞中LDH 含量影响的检测结果Fig.1 Effect of different concentrations of peptides on LDH content in B16 cells
2.3 RGD 嵌合体肽作用B16 细胞后的电镜观察经多肽作用B16 细胞24 h 后,透射电镜观察细胞超微结构。结果显示,与对照组相比,经4 种多肽作用后的B16 细胞出现核质淡染,呈现区域性密集的颗粒样物质,线粒体肿大。其中经RGD-T-La (S)、RGD-T-La (FS)50 μg/mL 作用后的 B16 细胞出现自噬体和线粒体自噬的现象(图2B、2E),RGD-T-La(FS)50 μg/mL 作用后的B16 细胞在损伤的线粒体中出现若干游离的膜结构,形成自噬小体,自噬小体结构更典型(图2D、2E),细胞内部结构出现明显变化,细胞器排列紊乱且出现空泡化,出现次级溶酶体。表明,RGD 嵌合体肽可能通过作用于B16 细胞线粒体导致细胞凋亡。
2.4 对细胞周期影响的检测结果通过流式细胞仪测定4 种多肽对B16 细胞周期的影响。结果显示,与对照组相比,4 种多肽均可引起B16 细胞G0/G1期阻滞。T-La(S)和 RGD-T-La(S)在 50 μg/mL 时作用B16 后,G0/G1 期细胞比例由(56.43±0.33)%分别增加到(68.66±0.38)%和(62.22±0.35)% (p<0.05)。T-La(FS)和 RGD-T-La(FS)在 50 μg/mL 时作用 B16 后,G0/G1 期细胞比例由(56.43±0.33)%分别增加到(66.10±0.21)%和(41.83±0.22)% (p<0.05)。其中 RGDT-La(FS)组还可引起B16 细胞S 期阻滞,在20 μg/mL作用于 B16 细胞后,S 期细胞比例达到(54.97±0.38)% (表4)。表明,4 种多肽可通过阻滞B16 细胞G0/G1 期导致细胞凋亡,其中RGD 嵌合体肽可通过作用B16 细胞S 期导致其增殖受阻。
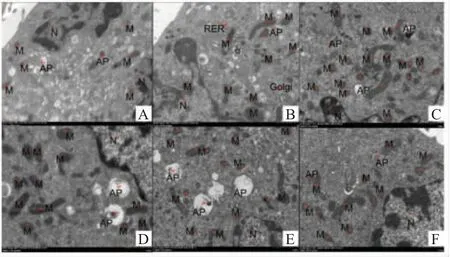
图2 多肽体外杀伤B16 细胞的透射电镜观察结果Fig.2 Transmission electron microscopy observation of peptides killing of B16 cells in vitro
表4 不同浓度多肽对B16 细胞周期分布的影响(n=3,,%)Table 4 Effects of different concentrations of peptides on cell cycledistribution of B16 Cells (n=3,, %)
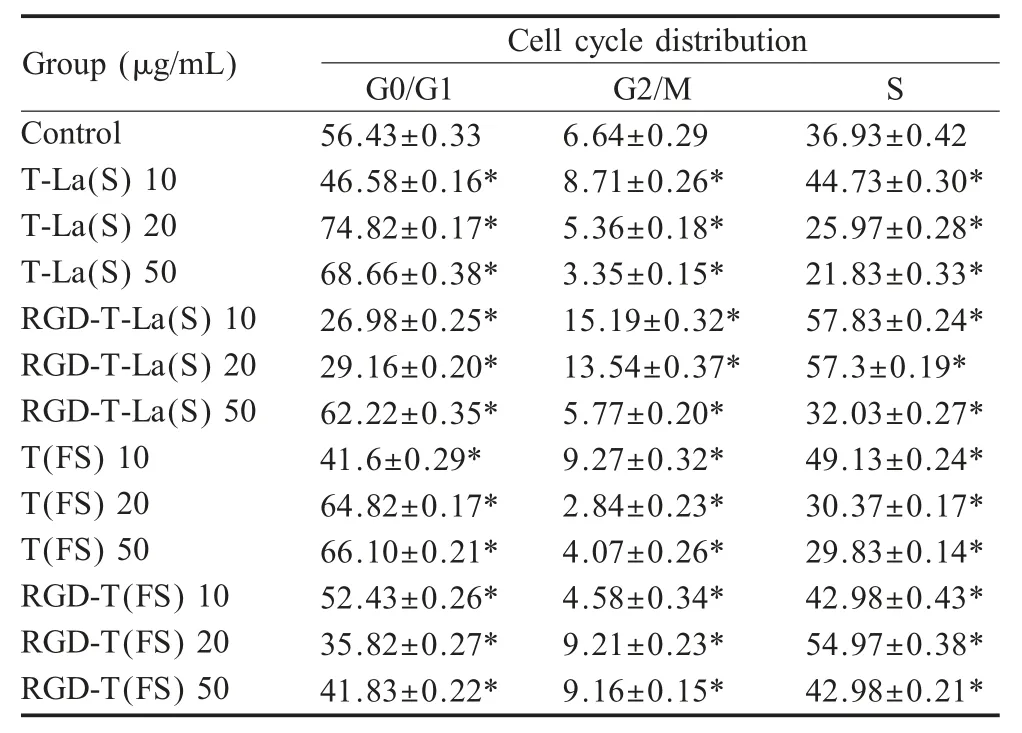
表4 不同浓度多肽对B16 细胞周期分布的影响(n=3,,%)Table 4 Effects of different concentrations of peptides on cell cycledistribution of B16 Cells (n=3,, %)
注:表中数据肩标符号“*”表示差异显著(p<0.05)Note: The shoulder symbols of the data in the table "*" indicate significant differences.
Group (μg/mL)Cell cycle distribution S Control T-La(S)10 T-La(S)20 T-La(S)50 RGD-T-La(S)10 RGD-T-La(S)20 RGD-T-La(S)50 T(FS)10 T(FS)20 T(FS)50 RGD-T(FS)10 RGD-T(FS)20 RGD-T(FS)50 G0/G1 56.43±0.33 46.58±0.16*74.82±0.17*68.66±0.38*26.98±0.25*29.16±0.20*62.22±0.35*41.6±0.29*64.82±0.17*66.10±0.21*52.43±0.26*35.82±0.27*41.83±0.22*G2/M 6.64±0.29 8.71±0.26*5.36±0.18*3.35±0.15*15.19±0.32*13.54±0.37*5.77±0.20*9.27±0.32*2.84±0.23*4.07±0.26*4.58±0.34*9.21±0.23*9.16±0.15*36.93±0.42 44.73±0.30*25.97±0.28*21.83±0.33*57.83±0.24*57.3±0.19*32.03±0.27*49.13±0.24*30.37±0.17*29.83±0.14*42.98±0.43*54.97±0.38*42.98±0.21*
2.5 对黑色素形成影响的检测结果利用NaOH 裂解法测定4 种多肽对B16 细胞中黑色素含量的影响,结果显示,加入多肽后细胞黑色素含量均显著低于空白对照组(p<0.05),随着多肽浓度的增加,黑色素含量下降,RGD-T-La(S)在 50 μg/mL、100 μg/mL作用时B16 细胞黑色素含量分别下降到70.4 %和66.3 %,RGD-T-La(FS)在 100 μg/mL 时黑色素含量下降到66.3 %,低于T-La(S)处理组的B16 细胞黑色素含量,T-La(S)处理的B16 细胞黑色素含量虽然也有下降,但其各浓度间差异不明显(p>0.05)(图3)。表明RGD- 嵌合体肽对B16 细胞黑色素的合成有显著的抑制作用。

图3 多肽对B16 细胞黑色素合成的影响Fig.3 Effect of peptide on melanin synthesis in B16 cells
2.6 对TYR 活性影响的检测结果通过L-Dopa 氧化法测定4 种多肽对B16 细胞TYR 活性的影响。结果显示,与对照组相比,不同浓度的多肽对B16 细胞中TYR 活性均具有显著的抑制作用(p<0.05),其中 RGD-T-La(S)和 RGD-T-La(FS)在 10 μg/mL 作用于B16 细胞时TYR 下降趋势明显,在100 μg/mL 作用于B16 细胞时TYR 活性分别降到49.2%和55.9%,对TYR 活性的抑制率要高于T-La(S)与T-La(FS)(图4)。表明RGD 嵌合体肽能够降低B16 细胞的TYR活性。
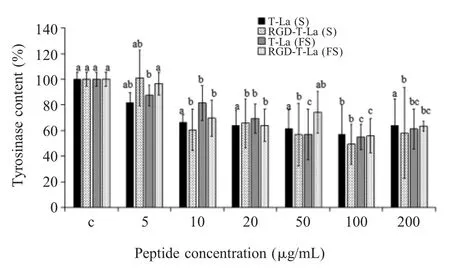
图4 多肽对B16 细胞TYR 活性的影响Fig.4 Effect of peptide on tyrosinase activity of B16 cells
2.7 对TYR 和MITF 基因转录水平影响的检测结果通过荧光定量PCR(q-PCR)检测多肽对黑色素合成关键因子TYR 和MITF 基因转录水平的影响。结果显示,与对照组相比,RGD-T-La(S)处理的B16细胞在 100 μg/mL 时 TYR 基因的 mRNA 转录水平显著降低(p<0.05),在 20 μg/mL、50 μg/mL、100 μg/mL 时MITF 基因的mRNA 转录水平均显著降低(p<0.05);50 μg/mL、100 μg/mL RGD-T-La(FS)处理的 B16 细胞的TYR 和MITF 基因转录水平均显著降低(p<0.05)(表5)。表明,RGD 嵌合体肽通过降低B16 细胞TYR 和MITF 基因转录水平控制黑色素含量生成。

表5 多肽对B16 细胞TYR、MITF mRNA 转录水平的影响(n=3,X±S)Table 5 Effects of peptideon TYR and MITF mRNA expression in B16 cells (n=3, X±S)
3 讨 论
刁昱文等人证实合体RGD-Las 可以靶向裸鼠人肝癌原位移植瘤。伊文斯蓝显色反应结果显示了嵌合体 RGD-Las 和肿瘤组织穿透能力强于Temporin-La[13]。目前RGD 肽即作为潜在的示踪剂而成为研究的主要方向之一,特别是某些肿瘤细胞和肿瘤新生血管内皮细胞高表达的整合素αvβ3 分子可与外源性含RGD 肽的分子发生特异性结合,从而抑制肿瘤的生长并启动肿瘤细胞的凋亡过程。
经研究表明恶性肿瘤的发生和发展的关键之一是肿瘤细胞异常增殖及分化,细胞凋亡受阻,某些天然抗肿瘤药物的机制在于通过抑制微管的解聚进而抑制细胞的有丝分裂,阻滞细胞的G2/M 期,诱导细胞发生凋亡[14]。本实验通过采用不同浓度的抗肿瘤肽对B16 细胞进行研究,结果显示4 种多肽对B16 细胞G0/G1、G2/M 期均有明显阻滞作用,从而表现出强烈的抑制细胞增殖的作用。经流式细胞仪检测细胞周期分布情况,结果显示,与T-La(S)、T-La(FS)相比,经 RGD-T-La(S)、RGD-T-La(FS)作用后的B16 细胞G0/G1 期的比例显著增加,表明多肽及RGD 嵌合体肽可能通过改变细胞周期,使细胞阻滞在G1 期,阻滞其DNA 合成,从而抑制黑素瘤细胞增殖。
有研究发现TYR 在催化黑色素生成过程中主要参与两个阶段:一是催化L- 酪氨酸羟基化转变为L- 多巴(羟苯丙氨酸),多巴形成后又反过来催化酪氨酸和TYR 的反应;二是氧化L- 多巴失去两个氢原子形成多巴醌[15]。合成黑色素是黑色素瘤细胞增殖生长的重要特征,其合成过程主要由黑色素合成关键限速酶TYR 基因调控,其通过调节因子MITF上调TYR 基因的表达,从而促进黑色素的生成[16]。本实验研究结果显示,T-La(S)、T-La(FS)及其RGD嵌合体肽可能通过抑制MITF mRNA 转录水平而下调TYR mRNA 的转录水平,从而抑制B16 细胞黑色素的生成。刘梦月等人初步证明RGD 嵌合体肽具有靶向抗肿瘤作用,通过作用于细胞膜表面的靶点迅速作用于肿瘤细胞[17]。本研究在此基础上进一步证明RGD 嵌合体肽对诱导B16 细胞凋亡的影响,未偶联RGD 的多肽虽然也具有抗肿瘤作用,却与其作用机制有所区别。
通过透射电镜观察到多肽作用于B16 细胞后出现了线粒体肿大及自噬体,表明多肽及RGD 嵌合体肽可能通过激活与线粒体有关的活动导致细胞凋亡。研究发现,自噬体形成的过程中所涉及的信号转导分子通过调节自噬相关基因的活性和表达来调控自噬[18]。调节自噬的因子包括蛋白激酶(Tor、Erk1/2、G 蛋白等)[19],自噬体的发生需要多信号的参与,依赖多种基因和蛋白的调控,自噬可能成为一种新的凋亡途径,其更进一步的抗肿瘤机制还有待进一步研究。本研究为RGD-嵌合体肽RGD-T-La(S)和RGD-T-La(FS)的靶向抗肿瘤的作用机制以及为临床相关抗肿瘤药物的研发提供科学依据。
