蓝舌病病毒8型可视化RT-LAMP检测方法的建立
2019-11-22李富祥赵文华杨仕标
李富祥,赵文华,杨仕标
(云南省畜牧兽医科学院云南省热带亚热带动物病毒病重点实验室,云南 昆明 650224)
蓝舌病(Bluetongue,BT)是由 BT 病毒(BTV)引起绵羊、山羊、水牛、骆驼和野生反刍动物的一种非接触性虫媒传播疾病。BTV 血清型众多,目前已发现27 个血清型[1],其中BTV-8 致病性较强,严重危害羊、牛、骆驼和野生反刍动物的健康[2-4]。2006年荷兰首次报道BTV-8 感染,随后比利时、德国、法国、卢森堡、丹麦、美国、意大利和瑞士等国家相继暴发,造成严重的经济损失。目前,虽然我国尚无BTV-8 感染病例的报道,但随着国际贸易的日益频繁,我国存在BTV-8 传入风险,因此建立快速检测方法对BTV-8 感染的防控具有重要意义。
目前,国内外已建立的针对BTV-8 的检测方法有病毒分离及病毒中和试验[5]、RT-PCR[6]、BTV-8型特异性荧光定量PCR (qPCR)[7-8]和反转录环介等温扩增(Reverse transcription loop-mediated isoth- ermal amplification,RT-LAMP)[9],但未见国内有针对BTV-8 型特异性的 RT-LAMP 检测方法的报道。RT-LAMP 具有可视化、高通量、高敏感性、高特异性、快速、不需复杂昂贵的仪器等诸多优点。本研究根据BTV-8 VP2 基因保守序列设计型特异性引物,建立BTV-8 可视化RT-LAMP 检测方法,以期为我国牛、羊和骆驼BTV-8 感染的早期快速诊断提供技术储备。
1 材料与方法
1.1 病毒及核酸 BTV-8 South Africa-ref 株RNA由南非安德斯波得兽医研究所蓝舌病参考实验室惠赠;BTV-1~7 以及BTV-9~24 RNA、鹿流行性出血热病毒(Epizootic haemorrhagic disease virus,EHDV)RNA 和阿卡斑病毒(Akabane virus,AKV)RNA 由云南出入境检验检疫局惠赠;灭活的O 型、A 型、AsiaⅠ型口蹄疫病毒(Food and mouth disease virus,FMDV)来自中国农业科学院兰州兽医研究所生产的口蹄疫抗体液相阻断ELISA 试剂盒;狂犬病病毒(Rabies virus,RV)来自勃林格殷格翰动物保健(美国)有限公司生产的狂犬病灭活疫苗;小反刍兽疫病毒 (Peste des petits ruminants virus, PPRV)疫 苗 株Nigeria 75/1 由云南省热带亚热带动物病毒病重点实验室保存。
1.2 主要试剂 柱式病毒RNA 抽提纯化试剂盒购自生工生物工程(上海)股份有限公司;Bst 2.0 WarmStart DNA polymerase 购自 New England Biolabs公司;PrimeScript One Step RT-PCR Kit Ver.2、AMV反转录酶和dNTP Mixture 均购自宝生物工程(大连)有限公司;硫酸镁、甜菜碱和氯化锰均购自北京索莱宝科技有限公司;钙黄绿素购自合肥巴斯夫生物科技有限公司。
1.3 引物设计 利用 DNAStar 软件包中的MegAlign 软件对 BTV-8 South Africa-ref 株 VP2 基因序列(AJ585129)以及其它 BTV-8 株 VP2 基因序列(AJ585183、 KX815885、 KT317686、 KM053259、JF423934、 JF423935、 JF423936、 JF423937 和JF423938)进行比对分析选择其保守片段,利用在线软件PrimerExplorer 4 (http://primerexplorer.jp/elamp4.0.0/index.html)设计1 对外引物(BTV-8-F3 和BTV- 8-B3)和 1 对内引物(BTV-8-FIP 和 BTV-8-BIP) (表1)。OIE 标准套式 RT-PCR 外引物 PA:GTTCTCTAGT TGGCAACCACC/PB:AAGCCAGACTGTTTCCCGAT(扩增片段 272 bp,退火温度52 ℃)和内引物 PC:GCAGCATTTTGAGAGAGCGA/PD: CCCGATCATA CATTGCTTCCT(扩增片段101 bp,退火温度62 ℃),引物均由北京擎科新业生物技术有限公司合成。

表1 BTV-8 RT-LAMP 引物序列引物名称Primer name BTV-8-F3 BTV-8-B3 BTV-8-FIP BTV-8-BIP引物序列Primer sequences(5'→3')ACAAAATAGTACACTGGGAGTA TACATTTGCGCCATCCTC CCTCAGGGAACAGATCGCACTTACTTAATGAGGTACGAGAGG GAAGAGTTTACCACCAAGTTCCATGAATCTCGTTGATTCCATCCAC
1.4 可视化RT-LAMP 反应体系及反应条件的优化以 BTV-8 RNA 为模板,参考文献[10-11]建立 25 μL 基础反应体系:ddH2O 8 μL、10×Isothermal amplification buffer 2.5 μL、dNTP Mixture (10 mmol/L) 1.5 μL、Bst 2.0 WarmStart DNA polymerase (8 U/μL) 1 μL、AMV 反转录酶(5 U/μL) 0.5 μL、Betaine (10 mol/L)2 μL、硫酸镁(100 mmol/L)1.5 μL、钙黄绿素(200 μmol/L)5 μL、氯化锰(25 mmol/L)0.8 μL、BTV-8-FIP(20 μmol/L)0.3 μL、BTV-8-BIP(20 μmol/L) 0.3 μL、BTV-8-F3(20 μmol/L) 0.3 μL、BTV-8-B3(20 μmol/L) 0.3 μL和BTV-8 RNA 模板1 μL。并设立基础反应条件为60 ℃反应1 h,在此反应体系和反应条件的基础上,利用棋盘法分别优化硫酸镁浓度(2-1~2-10稀释)、内外引物比例(1∶1、1∶2、1∶3、1∶4、1∶5、1∶6、1∶7、1∶8、1∶9 和 1∶10)、反应温度(58 ℃、60 ℃、62 ℃、64 ℃、66 ℃和 68 ℃)和反应时间(40 min、50 min、60 min、70 min、80 min 和90 min);分析确定最佳反应体系和条件。
1.5 特异性试验 利用病毒RNA 抽提纯化试剂盒提 取 FMDV-A、 FMDV-O、 FMDV-Asia Ⅰ 、 RV、PPRV 的RNA 以及保存的其它23 个血清型 BTV、EHDV 和AKV RNA 分别作为模板,按照优化的反应体系和反应条件进行RT-LAMP 反应,分析该方法的特异性。
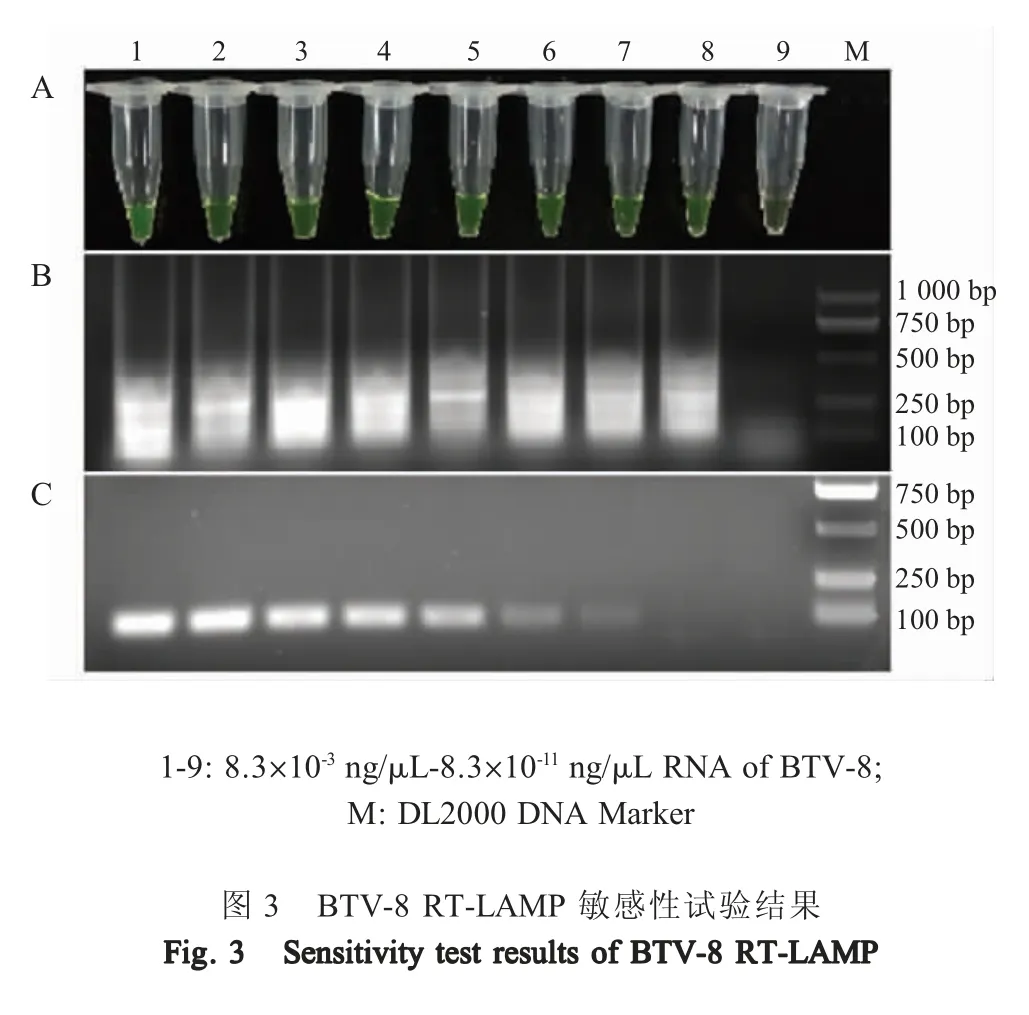
1.6 敏感性试验 利用紫外分光光度法测定BTV-8 RNA 样品的浓度,并将其10 倍倍比稀释9 个梯度(100~10-8),按照本研究建立的RT-LAMP 对每个稀释度样品进行检测,同时采用OIE 推荐的套式RT-PCR 检测,分析该RT-LAMP 方法的敏感性。
1.7 临床样品检测 利用病毒RNA 抽提纯化试剂盒分别提取来自昆明市的12 头牛和26 只羊的组织样品(肺脏、肝脏、脾脏、肾脏和淋巴结)的RNA,利用本研究建立的RT-LAMP 方法和OIE 推荐的套式RT-PCR 方法对38 份牛羊组织样品的RNA 进行检测,分析两种检测方法的符合情况。
2 结 果
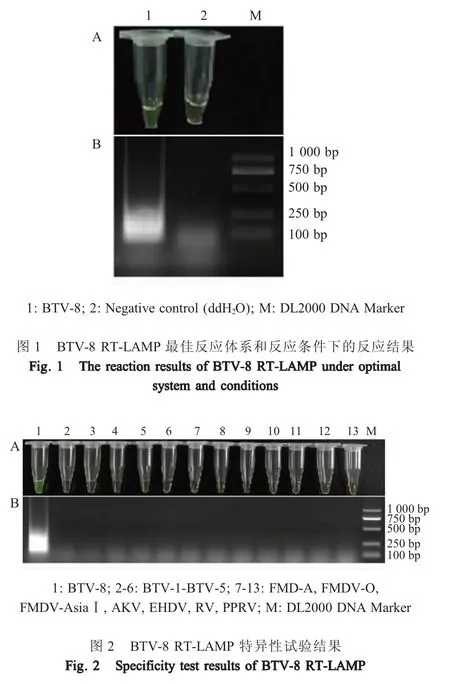
2.1 可视化RT-LAMP 反应体系及反应条件的优化结果 利用棋盘法得到最佳内外引物比例为1∶5,最佳反应体系为:ddH2O 5.6 μL、10×Isothermal amplification buffer 2.5 μL、dNTP Mixture (10 mmol/L)1.5 μL、Bst 2.0 WarmStart DNA polymerase (8 U/μL)1 μL、AMV 反转录酶(5 U/μL) 0.5 μL、Betaine(10 mol/L) 2 μL、硫酸镁(1.56 mmol/L) 1.5 μL、钙黄绿素(200 μmol/L)5 μL、氯化锰(25 mmol/L)0.8 μL、BTV-8-FIP(20 μmol/L)0.3 μL、BTV-8-BIP(20 μmol/L)0.3 μL、BTV-8-F3 (20 μmol/L) 1.5 μL、BTV-8-B3(20 μmol/L) 1.5 μL 和 BTV-8 RNA 模板 1 μL。最佳反应条件为60 ℃反应1 h,在最佳反应体系和反应条件下的扩增效果见图1。
2.2 特异性试验结果 利用RT-LAMP 方法对31株病毒RNA 样品进行检测,结果显示仅BTV-8 检测结果为阳性(反应液变为鲜艳黄绿色;反应产物电泳有特异性条带),其它 30 株病毒(BTV-1 ~7、BTV-9 ~24、FMDV-A、FMDV-O、FMDV-Asia Ⅰ、RV、PPRV、EHDV 和AKV)检测结果均为阴性(部分特异性试验结果见图2),表明该方法具有较强的特异性。
2.3 敏感性试验结果 采用紫外分光光度法测定BTV-8 RNA 样品的浓度为 8.3×10-3ng/μL,用建立的 RT-LAMP 方法和 OIE 推荐的套式 RT-PCR 方法对不同稀释度BTV-8 RNA 样品进行检测,结果显示RT-LAMP 检测为阳性的最低病毒RNA 浓度为8.3×10-10ng/μL (图3A、B);套式 RT-PCR 检测为阳性的最低病毒 RNA 浓度为 8.3×10-9ng/μL (图3C),表明RT-LAMP 的敏感性较高。
2.4 临床样品检测 利用建立的RT-LAMP 对38份牛羊各组织样品的检测结果均为阴性,利用普通RT-PCR 对38 份牛羊各组织样品的检测结果也均为阴性,两种检测方法的检测结果一致。表明本研究建立的RT-LAMP 可以用于临床检测,同时也说明目前我国尚无该病毒感染。
3 讨 论
与其它血清型BTV 不同的是,BTV-8 不仅对羊具有较强的致病性,而且对牛和骆驼也具有较强的致病性,病畜的临床症状除了口腔黏膜及舌头变蓝外,鼻和口腔黏膜严重充血等临床症状更加严重,对动物健康的危害更加严重[2-4]。目前我国没有BTV-8 感染病例的报道,因此建立BTV-8 型特异性的可视化RT-LAMP 早期快速检测方法对BTV-8 的监测和检测具有重要意义。由于BTV 血清学众多,各血清型病毒株间VP2 基因的同源性最低,不同血清型之间同源性仅为29 %~63.9 %[12-13],VP2 基因与BTV 血清型密切相关,已成为BTV 血清型特异性RT-PCR、qPCR 和RT-LAMP 检测方法引物设计的主要靶基因[6-8]。本研究在比对10 株不同国家来源的BTV-8 分离株VP2 基因同源性的基础上,选择最为保守的基因片段设计2 对RT-LAMP 引物,通过硫酸镁浓度、内外引物浓度、反应温度和反应时间的优化以及特异性和敏感性验证,在我国首次建立了特异性强、敏感性高和简便快速的RT-LAMP检测方法,只需在水浴锅中60 ℃反应1 h,通过肉眼观察反应前后的颜色变化即可对检测结果进行判定。
在反应条件优化试验中,本研究发现硫酸镁浓度和内外引物比例是该RT-LAMP 方法的关键因素。当硫酸镁浓度≥3.13 mmol/L 时,RT-LAMP 反应完全被抑制;当 1.56 mmol/L ≥硫酸镁浓度≥0.10 mmol/L 时, RT-LAMP 扩增都较好,为保证足量的硫酸镁激活Bst DNA 聚合酶,选择1.56 mmol/L 作为最佳硫酸镁浓度。由此推断过高的硫酸镁浓度会抑制RT-LAMP 反应,该结论与之前报道的结论一致[11]。另外,内外引物比例也是该RT-LAMP 反应的又一个关键因素,当固定外引物体积0.3 μL 不变,将内外引物体积比例分别调整至 1∶1、2∶1、3∶1、4∶1、5∶1 和 6∶1 时,仅当内外引物比例为 1∶1 时出现较弱的RT-LAMP 扩增,其它比例均没有RT-LAMP扩增(图省略)。当固定内引物体积各0.3 μL 不变,将内外引物体积比例分别调整为 1∶1、1∶2、1∶3、1∶4、1∶5、1∶6、1∶7、1∶8、1∶9 和 1∶10 时,均有 RT-LAMP扩增,且当内外引物比例为1∶5 时扩增效果最好,因此选择 1 ∶5 作为内外引物最佳体积比例,该RT-LAMP 反应体系中,外引物浓度高于内引物浓度,该结果与贾坤等报道的结果相同[14],因此推测在RT-LAMP 反应体系中,内引物浓度并不都是高于外引物浓度,具体的比例必须由试验确定。
虽然国外Mulholland 等已建立了BTV-8 血清型特异的RT-LAMP 检测方法,该方法已用其它血清型BTV 以及EHDV 检验无交叉反应,但未用其它病毒对RT-LAMP 方法的特异性进行验证[9]。本研究建立的RT-LAMP 方法不仅与其它血清型BTV 以及EHDV 无交叉反应,而且与牛羊常见病毒FVDV-A、FMDV-O、FMDV-AsiaⅠ、AKV、RV、和 PPRV 无交叉反应,具有更强的特异性。另外,敏感性试验表明本研究建立的RT-LAMP 检测方法的敏感性是OIE 套式RT-PCR 的10 倍,临床样品检测结果表明该RT-LAMP 方法与普通RT-PCR 方法检测结果一致,可以用于我国BTV-8 感染的病原学早期快速检测,对BTV-8 感染疫病的防控具有重要意义。
